对马耳蕨孢子体和配子体光合生理生态特性比较
敖金成,苏文华,郭晓荣,周 睿,张光飞
对马耳蕨孢子体和配子体光合生理生态特性比较
敖金成1,2,苏文华1,郭晓荣1,周 睿1,张光飞1
(1.云南大学 生态学与地植物学研究所,云南 昆明 650091;2.云南瑞升烟草技术(集团)有限公司,云南 昆明650106)
以蕨类植物对马耳蕨为研究材料,对其孢子体和配子体的光合生理生态特性进行了比较研究。结果表明:(1)孢子体叶绿素a、叶绿素b、叶绿素(a+b)、类胡萝卜素和总黄酮含量分别是配子体的2.31、3.12、2.58、1.71、1.26倍,均有极显著性差异(P<0.01);(2)初始荧光、最大荧光、最大光能转化效率、光化学淬灭系数、PSⅡ潜在光化学活性分别是配子体的1.33、1.41、1.03、0.97、1.06倍,差异极显著或显著;(3)随着光照强度的增加,对马耳蕨孢子体表观电子传递速率和非光化学淬灭系数上升幅度较配子体大;(4)当孢子体和配子体同时受到短时强光照射时,孢子体最大光能转化效率下降了59.9%,配子体下降了69.3%,次日清晨孢子体最大光能转化效率恢复至初始值的81.4%,配子体仅恢复初始值的65.5%。以上结果说明对马耳蕨孢子体对光生境的适应能力较配子体强,当两者同处强光生境时,配子体较容易受到光抑制或光损伤危害。
蕨类植物;对马耳蕨;孢子体;配子体;叶绿素荧光特性;光适应
光照是影响植物生长发育的重要环境因子,适应光环境变化的能力很大程度上决定着植物分布模式和物种丰度[1]。许多植物通过光合调控[2-8]、生成抗氧化物质[9-10]及改变形态特征[11]等途径以适应不同的光生境。
黄酮类化合物作为植物体内一类重要的抗氧化物质,对活性氧基团具有较强的清除作用[12],可有效防止叶片组织受损。研究表明,许多蕨类植物孢子体含有丰富的黄酮类化合物[13-14],喜阴植物对马耳蕨孢子体也含有丰富的黄酮类化合物[15]。目前关于蕨类植物配子体是否含有黄酮类化合物质未见报道,受到光抑制后其恢复特征也鲜见报道。
蕨类植物生活史分为孢子体(无性)和配子体(有性)两个世代,且均能独立生活。普遍认为配子体是蕨类植物生活史的脆弱阶段,但尚无充分证据表明配子体阶段是蕨类植物生活史的脆弱阶段。随着人类社会和经济的发展,以及一些地区保护意识和力度的薄弱,导致森林破坏相当严重。森林的破碎及片段化常使林下生境由阴湿低光生境向干暖高光生境转变,林下植物必定暴露在高光下。许多蕨类植物是典型的林下植物,生境光强的增加必然影响到喜阴或阴生蕨类植物的生存与繁衍。关于蕨类植物孢子体光适应能力有一定的研究报道[15-17],但关于喜阴蕨类植物孢子体和配子体对光环境的适应差异未见报道。因此,笔者以喜阴蕨类植物对马耳蕨孢子体和配子体为研究材料,研究了喜阴蕨类植物孢子体和配子体光合生理生态特性,并揭示其光适应机理,旨在评价生境光强增加对林下蕨类植物种群繁衍的影响,为制定森林保育、生物多样性维持政策制定等提供理论依据。
1 材料与方法
1.1 材料采集与培养
对马耳蕨孢子体于2009年2月12日采自于云南省昆明市西山密闭的林下,采样时连土挖起,尽量不伤根,并迅速装入密封袋,洒水保湿。带回后栽入相同口径的陶盆中(内径30 cm,深25 cm),共40盆,栽培后进行遮荫管理,光强与原生境基本一致,约为自然光的(7±1)%。当孢子成熟后,连同叶片剪下,装入牛皮纸袋中,放置通风干燥处约1周,然后将自然脱落的孢子去杂备用。采回的孢子体均为2~3年苗龄,株高35~40 cm,待新叶发育成完整功能叶时进行相关指标的测定。
1.2 配子体的培养
1.2.1 孢子消毒
于2010年3月5日进行实验,取成熟孢子2 mg(孢子大小为60~93 μm)置于离心管,加入5%NaClO水溶液115 mL,3 500 r·min-1离心8 min,弃去上清液,加入无菌水离心冲洗4~5遍即可。
1.2.2 播种采用
1/2MS无机培养基培养。将已灭菌的培养基倒入培养皿(已灭菌)中,待冷却固定后将已消毒的孢子均匀播在培养基上,然后用封口膜将口封好,以免失水干燥。为使孢子萌发及生长发育具有一致性,先将接种好的培养皿放在黑暗下24 h,后置于云南大学植物生理组培室培养。共接种40盘,使用尼康DXM-1200F显微镜进行镜检,以准确判断配子体发育进程。待90%以上原叶体发育成“V”形(成熟原叶体最大者可达8 mm×4.5 mm)时进行相关荧光参数及叶绿素含量的测定。采用日光灯光源,光照强度20~30 μmol·m-2s-1,光照时间12 h·d-1,白天组培室温度24~26℃,夜间20~22℃。
1.3 测定指标与方法
1.3.1 叶绿素含量
叶绿素用80%丙酮提取,提取液在663、646和470 nm处测定吸光值,按Lichtenthaler等[18]的方法计算叶绿素a(CChla)、叶绿素b(CChlb)、类胡萝卜素的含量及叶绿素(a+b)(CChla+CChlb)、叶绿素值a/b(CChla/CChlb)。实验重复3次。
1.3.2 总黄酮含量
将对马耳蕨孢子体和配子体剪下置于信封中,在60℃下烘至恒质量后磨成粉末,精密称取孢子体和配子体样品粉末0.5 g于25 mL容量瓶中,加入60%乙醇定容,在60℃下600 KH超声提取20 min,定容,过滤。总黄酮含量的测定标准曲线按照叶春等[19]的方法制备。以无水芦丁为标准品配置成标准溶液,测定510 nm波长下的吸光度,得到标准方程(y=11.163x+0.001 1,R2=0.999 8)。取滤液1 mL于25 mL容量瓶中,用30%的乙醇定容,按标准曲线制备方法测定吸光值,代入标准方程计算孢子体和配子体样品液的总黄酮含量。试验重复3次。
1.3.3 叶绿素荧光动力学参数
于2010年6月8日至10日,利用PAM-2100便携式叶绿素荧光仪(Walz, Germany)测定对马耳蕨孢子体和配子体叶绿素荧光基本参数。主要测定指标包括初始荧光(Fo)、最大荧光(Fm),光化学淬灭系数(qP)、光下最大荧光(Fm′)、光下最小荧光(Fo′)。主要计算如下参数:PSⅡ潜在活性(Fv/Fo)=(Fm-Fo)/Fo。孢子体测定10盆,每盆测定1片叶(共测定10片叶),配子体测定10盘,每盘测定一个配子体。实验连续测定3 d,求平均值。
1.3.4 叶绿素荧光动力学曲线
采用PAM-2100自带标准试验Run9测定孢子体和配子体叶绿素荧光动力学曲线。首先使试验材料充分暗适应(一般在15~20 min),先测得Fm和Fo参数,再进行Run9试验设置。选择饱和脉冲模式并打开测量光和光化光,初始光化光强度(2Int)设为1,饱和脉冲强度(3Int)设为9,远红光照射时间(8 s)设为0,按Run开始测定。孢子体和配子体随机选择6盆或盘,每盆或盘测定1条曲线。
1.3.5 光抑制恢复能力
于2010年6月21日至25日早上7:00,利用PAM-2100先测得经充分暗适应的Fv/Fm初始值。12:00将对马耳蕨孢子体和配子体搬至阳光照射的地方,并测定自然光强(大于1 000 μmol•m-2s-1即可),处理时间为2.0 h。将经强光处理的孢子体和配子体搬回室内弱光环境立即测定Fv/Fm值,然后分别在第2、5、10、20、40和80 min时测定Fv/Fm的恢复情况。次日清晨(7:00)再测一次Fv/Fm值。孢子体和配子体每盆或盘测定1片叶,共10个重复。
1.4 数据分析
采用SPSS13.0统计软件进行方差分析。
2 结果与分析
2.1 孢子体和配子体光合色素和总黄酮特征分析
2.1.1 叶绿素含量特征分析
光合色素参与光合作用过程中光能的吸收、传递和转化,其含量直接影响着植物光合能力。叶绿素中的类胡萝卜素为黄酮类化合物,在植物体内具有抗氧化作用,在一定程度上可保护光合器官免受强光损害。表1显示,孢子体和配子体光合色素Chl a、Chl b、Chl(a+b)、Car含量有极显著差异(P<0.01)。与配子体相比,孢子体Chl a、Chl b、Chl(a+b)、Car含量分别是配子体的2.3、3.1、2.5、1.7倍。Chl(a/b)的值与两个光系统吸光能力的平衡有关,较高的Chl(a/b)表明具有较高的PSⅡ:PSⅠ,比值越高,说明达到PSⅠ的光能被有效利用的比例越高[20]。孢子体Chl(a/b)值极显著低于配子体(P<0.01),说明对马耳蕨配子体对光能的利用效率较高,是适应弱光生境的结果。以上结果表明,对马耳蕨孢子体对光能的捕获效率和抗氧化能力较配子体强。

表1 对马耳蕨孢子体和配子体叶绿素含量特征及方差分析†Table 1 Comparison of chlorophyll contents of P. tsus-simense sporophyte and gametophyte
2.1.2 孢子体和配子体总黄酮特征分析
对马耳蕨孢子体和配子体总黄酮含量差异较大(见图1),孢子体总黄酮含量是配子体总黄酮含量的1.26倍,差异极显著(P<0.01),表明孢子体对高活性化学基团的清除能力较强,当两者同时受高光胁迫后,孢子体光抑制恢复能力较强。
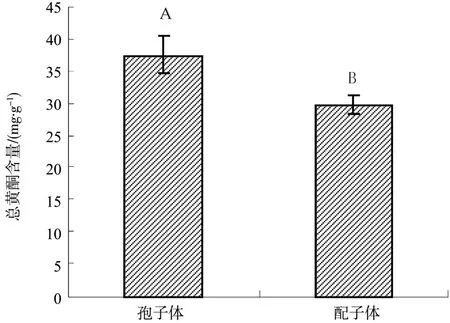
图1 对马耳蕨孢子体和配子体总黄酮含量比较Fig. 1 Comparison of total flarvonoid contents between P.tsus-simense sporophyte and gametophyte
2.2 孢子体和配子体叶绿素荧光特征分析
叶绿素荧光参数可反映光合机构内一系列重要的生理调节过程。PSⅡ的最大光化学量子产量(Fv/Fm),反映了开放的PSⅡ反应中心原初光能捕获效率。PSⅡ潜在活性(Fv/Fo)反映了PSⅡ潜在的光化学活性,与有活性的PSⅡ反应中心数量呈正比。光化学淬灭系数(qP)大小反映了PSⅡ天线色素吸收的光能用于光化学电子传递的份额和PSⅡ原初电子受体QA的氧化还原状态[21]。
由表2可知,对马耳蕨孢子体Fm、Fv/Fm、Fo极显著高于配子体(P<0.01),qP极显著低于配子体(P<0.01),Fv/Fo差异显著(P<0.05)。以上结果表明,对马耳蕨孢子体PSⅡ对光能的吸收、转化效率及光系统活性较配子体强,当二者同时处于高光生境时,孢子体能够利用更多光能,一定程度上降低光损害风险。

表2 对马耳蕨孢子体和配子叶绿素荧光特征分析Table 2 Fluorescence characteristics analysis of sporophyte and gametophyte of P. tsus-simense on chlorophyll
2.3 对马耳蕨孢子体和配子体叶绿素荧光对光强的响应
2.3.1 孢子体和配子体表观电子传递速率(rETR)对光强的响应
表观光合电子传递速率(rETR)是光合速率的一种表达方式,其值的大小在一定程度上反映了PSⅡ反应中心电子捕获效率的高低[23-24]和植物光合速率的大小[25-26]。从图2(A)可以看出,在相同的光合有效辐射条件下,对马耳蕨孢子体rETR始终高于配子体并维持在较高水平,表明孢子体在一定的高光条件下依然能够保持较高的电子传递速率,光合机构没有因为强光受到抑制,而且rETR随光合有效辐射的增加上升较快,说明其初始斜率较高,光化学反应启动快,光能利用效率高。当光强达到900 μmol·m-2s-1时,孢子体rETR达到峰值(76.84 μmol·m-2s-1);光 强 达到 300 μmol·m-2s-1时, 配子体rETR达到峰值(34.35 μmol·m-2s-1),孢子体rETR最大值约是配子体的2.24倍,差异极显著(P<0.01),且光饱和点也较低。说明对马耳蕨孢子体光适应范围较配子体宽,光适应能力较强。
2.3.2 孢子体和配子体非光化学淬灭系数(qN)对光强的响应
对马耳蕨孢子体和配子体qN均随光强的增加逐步升高(图2,B)。在低光强(<100 μmol·m-2s-1) 下,孢子体 qN和配子体 qN基本重合。当光合有效辐射大于100 μmol·m-2s-1后,孢子体qN上升较快,配子体相对较慢,且孢子体qN上升的幅度均较配子体高。以上结果表明,当光合色素吸收的光能超过自身需要时,对马耳蕨孢子体能很好地通过热耗散将富裕能耗散掉,有效减少富裕电子的产生,避免光合器官受到光抑制损害,配子体耗散能力明显偏弱。
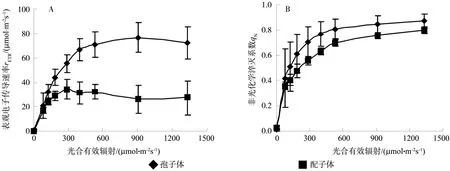
图2 对马耳蕨孢子体和配子体电子传递速率和非光化学淬灭系数对光强的响应Fig. 2 Response of rETR and qN of P. tsus-simense sporophyte and gametophyte to light intensity
2.4 孢子体和配子体光抑制恢复能力比较
最大光能转化效率(Fv/Fm)常用来判断在特定条件下植物光合系统状态,它的降低意味着PSⅡ的光合能力受到抑制[22]。当对马耳蕨孢子体和配子体经过强光处理后,孢子体Fv/Fm恢复速度明显快于配子体,两者光抑制恢复能力差异较大(见图3,A)。其中,孢子体Fv/Fm相比初始值(0.82)下降了59.9%,经过80 min仍未恢复至初始水平,仅恢复至初始值的70.4%;配子体Fv/Fm相比初始值(0.80)下降了69.3%,经过80 min仅恢复至初始值的47.8%,仍未恢复至初始水平,说明对马耳蕨孢子体和配子体均表现出明显的喜阴特征。次日清晨的测定数据(见图3,B)表明,对马耳蕨孢子体Fv/Fm恢复至初始水平的81.4%,配子体Fv/Fm仅恢复至初始值的65.5%。可见,在强光处理之后,对马耳蕨孢子体和配子体光合器官均发生一定程度的光破坏,但配子体受到的破坏程度较大,经过较长一段时间也难以恢复至正常生理状态。
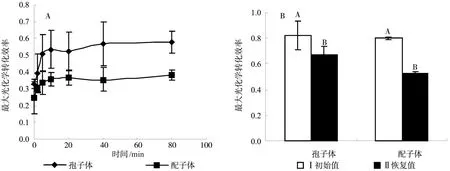
图3 对马耳蕨孢子体和配子体光抑制恢复能力比较Fig. 3 Comparison of photo-inhibition restorability capacity of P. tsus-simense sporophyte and gametophyte
3 讨论与结论
光合色素含量对光能的捕获和转化具有重要作用。本研究发现,对马耳蕨孢子体叶绿素a、叶绿素b及叶绿素(a+b)均极显著高于配子体(P<0.01),仅叶绿素 a/b显著低于配子体,说明对马耳蕨孢子体对光能的捕获能力较高。光合器官捕获了较多的光能,必然需要较强的光能转化和利用系统。试验中,对马耳蕨孢子体初始荧光、最大光能转化效率、最大荧光、PSⅡ潜在光化学活性均极显著或显著高于配子体,且随着光照强度的增加,孢子体表观电子传导速率上升幅度及光饱和点较配子体高,说明对马耳蕨孢子体对光能的吸收、转化能力强于配子体,因而能够消耗掉更多光能,降低孢子体在高光下的损害风险。
非光化学淬灭系数反映PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分,是一种自我保护机制,对光合机构起到一定的保护作用[27]。非光化学淬灭系数随着光强的增加逐渐升高是对生存环境适应的一种保护机制[28]。本研究显示,随着光照强度的增加,孢子体非光化学淬灭系数上升速度较配子体快,上升幅度较大,说明配子体对光能的利用能力有限,且耗散能力也有限。若孢子体和配子体同时发生光抑制,孢子体通过增强光化学能力和耗散途径来耗散过剩光能,保护光合机构在一定程度减轻光损害,从而充分利用光强进行生长[24]。说明增强PSⅡ反应中心对光能的转化利用,并及时耗散掉过剩光能是对马耳蕨孢子体和配子体适应高光强的对策之一。
当提高光合电子在碳还原和光呼吸之间的分配能力[3-5,28],以及利用热耗散消耗掉过多激发能仍不能耗散掉过多激发能时,便会产生大量具有破坏性的活性氧基团[29],降低光系统活性,最终导致光抑制的发生,所以严格意义上的光抑制是强光胁迫下光化学量子产量下降的现象[30]。最大光能转化效率是研究光抑制或各种环境胁迫对光合作用影响的重要指标[31]。本试验中,强光胁迫(直射光照射2 h)后,孢子体和配子体最大光能转化效率均显著下降(P<0.01),配子体下降幅度最大,次日清晨二者均未恢复至初始水平,但孢子体恢复能力明显强于配子体(P<0.05),这可能与孢子体含有较高的类胡萝卜素和黄酮类化合物有关。类胡萝卜素既是捕光色素,又是内源抗氧化剂,可有效耗散富裕能量,并清除活性氧,从而防止膜脂过氧化,有效保护光合器官[32],黄酮类化合物也是植物体内一类重要的抗氧化剂,对光合器官具有重要的保护作用。当孢子体和配子体同处高光生境时,可有效减少过剩光能的产生并及时清除具有破坏性的活性氧基团,因此即使受到一定程度的光抑制,孢子体也能在短时内恢复至较高水平。
综上所述,对马耳蕨孢子体具有较强的光能捕获能力、光能利用能力、热耗散能力和抗氧化能力,受短时强光胁迫后恢复较快,其光适应能力较强,而配子体则相对较弱。可见,当生境破坏,光强增加,配子体的生长发育将受到严重影响,这也说明配子体是蕨类植物生活史的脆弱阶段。
致谢:实验开展得到姜维、潘燕、杨慧同学的热心帮助,特致谢忱!
[1] Greer D H,Berry J A,Bjorkman O. Photoinhibition of photosynthesis in intact bean leaves:the role of light and temperature, and requirement for chloroplast-protein synthesis during recovery[J].Planta,1996,(168):253-260.
[2] 师生波,王学英,李惠梅,等.青藏高原药用植物唐古特莨菪和唐古特大黄光合作用对强光的响应[J].植物生理与分子学报.2006,32(3):387-394.
[3] 董 然,王 莹,赵国禹,等.长白山5种橐吾光合生理日变化及光响应特征研究[J].中南林业科技大学学报,2011,9(31):49-54.
[4] 张 华,闫文德,郑 威,等.不同PAHs污染水平对栾树幼苗光合特性和生长量的影响[J].中南林业科技大学学报,2011,5(31):111-116.
[5] Li Y, Gao Y X, Xu XM, et al. Light-saturation photosynthesis rate in high-nitrogen rice (Oryza sativa L.) leaves in related to chloroplastic CO2concentration[J].Journal of Experimental Botany,2009,(60):2 351-2 360.
[6] Thomas D J, Thomas J, Youderian P A, et al. Photoinhibition and light induced cyclic electron transport in ndhB-and psaE-mutants of synechocystis sp.PCC 6803[J].Plant Cell Physiology,2001,42(8):803-812.
[7] 苏 行,胡迪琴,林植芳,等.广州市大气污染对两种绿化植物叶绿素荧光特性的影响[J].植物生态学报,2002,26(5):599-604.
[8] 张教林,曹坤芳.光照对两种热带雨林树种幼苗光合能力、热耗散和抗氧化系统的影响[J].植物生态学报,2002,26(6):639-646.
[9] Moore B D, Wallis I R, Wood J T, et al. Foliar nutrition,site quality,and tempe -rature influence foliar chemistry of Tallowwood(Eucalyptus microcorys)[J]. Ecological Monographs,2004, 74 (4):553-568.
[10] 苏文华,张光飞,李秀华,等.植物药材次生代谢产物的积累与环境的关系[J].中草药,2005,36(9):1 415-1 418.
[11] Lusk CH.Leaf area accumulation helps juvenile evergreen trees tolerate shade in a temperate rainforest[J].Oecologia,2002,(132):188-196.
[12] Close D C,McArthur C.Rethinking the role of many plant phenolics-protection from photodamage not herbivores?[J].Oikos,2002,(99):166-172.
[13] 蔡建秀,吴文珊,吴凌云,等.22种药用蕨类植物的总黄酮含量研究[J].福建师范大学学报:自然科学版,2000, 16(4):63-66.
[14] 方云山,杨雪琼,刘劲芸,等.32种云南蕨类植物中的总黄酮测定[J].云南大学学报:自然科学版,2008,30(4):401-404.
[15] 敖金成,苏文华,张光飞,等.对马耳蕨光合作用对生境光强增加的响应[J].西北植物学报,2010,30(11):2 265-2 271.
[16] 张光飞,苏文华,施荣林,等.珍稀蕨类植物扇蕨光合速率与环境因子[J].武汉植物学研究,2004,22(2):125-128.
[17] 蔡志全,曹坤芳,李保贵.热带雨林剑叶凤尾蕨对光强变化的适应[J].武汉植物学研究,2002,20(4):283-287.
[18] Lichtenthaler H K, Wellburn A R. Determination of total carotenoids and chloro -phylls a and b of leaf extracts in different solvents[J].Biochem. Soc.Trans.,1983,(603): 591-592.
[19] 叶 春,徐丽娟,杨根勤,等.鱼腥草叶总黄酮含量的测定及鉴别[J].食品研究与开发,2007,28(9):130-133.
[20] Walters R G. Towards an understanding of photosynthetic acclimation[J]. Journal of Experimental Botany,2005,(56): 435-447.
[21] 李 晓,冯 伟,曾晓春.叶绿素荧光分析技术及应用研究[J].西北植物学报,2006,26(10):2 186-2 196.
[22] Oliveira G, Penuelas J. Allocation of absorbed light energy into photochemistry and dissipation in a semi-deciduous and an evergreen mediterranean woody species during winter[J]. Australian Journal of Plant Physiology, 2001,28(6):471-480.
[23] 李 伟,曹坤芳.干旱胁迫对不同光环境下的三叶漆幼苗光合特性和叶绿素荧光参数的影响[J].西北植物学报,2006,26(2):266-275.
[24] Michal K. On the relation between the non-photochemical quenching of chlorophyⅡ fluo -rescence and photosystemⅡ light harvesting efficiency. A repetitive flash fluorescence induction study[J]. Photosynthesis Research, 2001, (68):571-576.
[25] Joäo S, Rui S. Can chlorophyll fluorescence be used to estimate photosynthetic production in the seagrass Zostera nohtii[J].Biology and Ecology,2004,(307):207-216.
[26] D'Ambrosio N, Arena C, Santo A V D. Temperature response of photosynthesis,excitation energy dissipation and alternative electron sinks to carbon assimilation in Beta vulgaris L[J].Environmental and Experimental Botany, 2006,(55):248-257.
[27] 何炎红,郭连生,田有亮.白刺叶不同水分状况下光合速率及其叶绿素荧光特性的研究[J].西北植物学报,2005,25(11):2 226-2 233.
[28] Werner T,Holst K,Pörs Y,et al.Cytokinin deficiency causes distinct changes of sink and source parameters in tobacco shoots and roots[J].Journal of Experimental Botany,2008,(59):2 659-2 672.
[29] Niyogi K K. Photoprotection revisited: genetic and molecular approaches[J]. Annual Review of Plant physiology and Plant Molecular Biology, 1999,(50):333-359.
[30] Long S P, Humphries S, Falkowski P G. Photoinhibition of photosynthesis in nature[J]. Annu. Rev. Plant Physiol. PlantMol.Bio., 1994,(45):633-662.
[31] 韩博平,韩志国,付 翔.藻类光合作用机理与模型[M].北京:科学出版社,2003.
[32] 王博轶,冯玉龙.生长环境光强对两种热带雨林树种幼苗光合作用的影响[J].生态学报,2005,25(1):23-30.
Comparison of photosynthetic eco-physiological characteristics between fern Polystichum tsus-simense(Hook.)J. sporophyte and gametophyte
AO Jin-cheng1,2, SU Wen-hua1, GUO Xiao-rong1, ZHOU Rui1, ZHANG Guang-fei1
(1.Institute of Ecology and Geobotany, Yunnan University, Kunming 650091, Yunnan, China; 2.Yunnan Reascend Tobacco Technology(Group).Co.,LTD, Kunming 650106, Yunnan, China)
By taking Polystichum tsus-simense as the tested materials, the photosynthetic eco-physiological characteristics between its sporophyte and gametophyte were compared. The results show that (1) Contents of sporophyte Chl a, Chl b, Chl(a+b) , carotenoids and total flavonoids of P.tsus-simense were 3.21, 3.12, 2.58, 1.7 and 1.14 times to gametophyte respectively; (2) Values of sporophyte Fo,Fm, Fv/Fm, qP and Fv/Fo were 1.33、1.41、1.03、0.97、1.06 times to gametophyte respectively; (3) With light intensity increased,the values of sporophyte rETR and qN increased more than gametophyte, but there was no difference under low light intensity both of them; (4) Value of sporophyte Fv/Fm of sporophyte decreased by 59.9%, gametophyte decreased by 69.3% when suffered from a short-time photoinhibition both of them. next morning, compared to the initial value, the values of sporophyte Fv/Fm recovered to 81.4%, gametophyte just 65.5%; The present study found that P. tsus-simense sporophyte would adapt well to high light habitat than gametophyte when both of them exposure to high light intensity.
pteridophytes; Polystichum tsus-simense(Hook.)J.; sporophyte; gametophyte; chlorophyll fluorescence characteristics; light adaption
S718.3
A
1673-923X(2012)11-0067-06
2012-10-10
国家自然科学基金项目(NO.30760043) ;云南省基础研究项目(NO.2010ZC008);云南省国际河流与跨境生态安全重点实验室开放基金项目(NO.WX092393);云南大学研究基金项目(NO.2010YB003)
敖金成(1984-),男,硕士,主要从事植物生理生态学研究;E-mail: aojincheng@ yahoo.com.cn
张光飞(1966-),男,副教授,主要从事植物生理生态学研究;E-mail:gfzhang@ynu.edu.cn
[本文编校:谢荣秀]

