五种中药酚酸类化合物体外抗DNA损伤的作用
王长松,田莉莉,张俊刚,季祥武,赵广荣
〔1.天津大学化工学院制药工程系系统生物工程重点实验室(教育部),天津300072;2.潍坊市人民医院心内科,山东潍坊261041〕
五种中药酚酸类化合物体外抗DNA损伤的作用
王长松1,田莉莉1,张俊刚2,季祥武2,赵广荣1
〔1.天津大学化工学院制药工程系系统生物工程重点实验室(教育部),天津300072;2.潍坊市人民医院心内科,山东潍坊261041〕
目的探究中药酚酸类化合物抑制DNA损伤的效应,分析其构效关系。方法以人工合成抗氧化剂水溶性维生素E Trolox为阳性对照,选取结构相近的没食子酸、咖啡酸、芥子酸、阿魏酸和对香豆酸5种天然酚酸类化合物,通过琼脂糖凝胶电泳检测其体外清除羟自由基、过氧自由基及过氧亚硝基阴离子从而抑制DNA氧化损伤的作用。对电泳结果进行吸光度分析,计算开环态DNA所占百分比,由此得出各化合物的IC50值。结果5种酚酸类化合物均表现出抑制DNA损伤的作用,开环态DNA所占百分比随药物浓度增加而减少。5种化合物可抑制羟自由基引起的DNA损伤,IC50值分别为:没食子酸(1.13±0.03)mmol·L-1≈咖啡酸(1.14±0.07)mmol·L-1<对香豆酸(1.41±0.06)mmol·L-1<芥子酸(1.68±0.04)mmol·L-1<阿魏酸(1.80±0.04)mmol·L-1<Trolox(3.42±0.03)mmol·L-1;抑制过氧自由基引起的DNA损伤,IC50值分别为:没食子酸(0.12±0.02)mmol·L-1<咖啡酸(0.14±0.03)mmol·L-1<对香豆酸(0.17±0.08)mmol·L-1<芥子酸(0.20±0.05)mmol·L-1<阿魏酸(0.26±0.07)mmol·L-1<Trolox(0.52±0.06)mmol·L-1;抑制过氧亚硝基阴离子引起的DNA损伤,IC50值分别为:芥子酸(0.81±0.01)mmol·L-1<没食子酸(0.90±0.01)mmol·L-1<阿魏酸(1.20±0.02)mmol·L-1<对香豆酸(1.62±0.02)mmol·L-1≈咖啡酸(1.71±0.03)mmol·L-1<Trolox(3.38±0.07)mmol·L-1。结论该五种中药酚酸类化合物均具有抑制羟自由基、过氧自由基及过氧亚硝基引起的DNA损伤的作用,随相邻羟基数量增加,化合物抑制羟自由基和过氧自由基引起的DNA氧化损伤作用加强,而侧链-CH=CHCOOH和对位供电子基团能增强化合物抑制过氧亚硝基阴离子引起的DNA氧化损伤作用。
酚酸类;羟自由基;过氧自由基;过氧亚硝基阴离子;构效关系
随着现代医学和分子生物学的发展,人们认识到危害人类健康的重大疾病如癌症、心脑血管疾病和帕金森综合征等均与DNA损伤有着密切的关系[1]。细胞内过多的活性氧,如羟自由基、超氧阴离子和过氧亚硝基阴离子等,是造成DNA等生物大分子氧化损伤的主要来源[2]。有效清除体内过多的自由基,保护DNA免受氧化损伤,可以预防上述疾病的发生[3]。酚酸类化合物广泛存在于丹参、当归和川芎等中药和葡萄等水果[4]中,具有很强的抗氧化活性和清除活性氧的能力[5-6],具有治疗和预防心血管疾病、延缓衰老和抗癌等药理作用。本课题组曾用丹参素建立了荧光检测筛选抗DNA畸变药物模型[7]。本研究选取了没食子酸、咖啡酸、芥子酸、阿魏酸和对香豆酸5种中药酚酸类化合物(图1),并以人工合成抗氧化剂Trolox(水溶性维生素E)作为阳性对照,研究其在体外清除羟自由基、过氧自由基和过氧亚硝基阴离子从而保护DNA分子免受氧化损伤的作用,并探讨其构效关系。
Fig.1 Structures of five natural phenolic acids and Trolox.
1 材料与方法
1.1 药物、试剂和仪器
咖啡酸(≥99%)和Trolox(≥99%)购自Sigma公司;没食子酸(>98%)和对香豆酸(>98%)购自陕西宝鸡辰光生物有限公司;阿魏酸(>98%)和芥子酸(>98%)购自陕西森弗生物技术有限公司。2,2'-偶氮二(2-脒基丙烷)二盐酸盐〔2,2'-azobis(2-methylpropionamidine)dihydrochloride,AAPH〕购自上海楷洋生物技术有限公司;5-氨基-3-(4-吗啉基)-1,2,3-噁二唑鎓盐酸盐(5-amino-3-morpholinyl-1,2,3-oxadiazolium chloride,SIN-1)购自Cayman公司;质粒提取试剂盒购自北京天根生物技术有限公司,用于从大肠杆菌中提取pUC18质粒;其他试剂均为国产分析纯。DYY-6C型电泳仪:北京六一仪器厂;ND-1000微量紫外分光光度计:德国Thermo Scientific公司;紫外凝胶成像系统:美国UVP公司。
1.2 抑制羟自由基引起的DNA损伤作用的检测
在离心管中依次加入0.8 μg超螺旋态质粒DNA,Tris-HCl缓冲液(50 mmol·L-1,pH 7.0)及受试化合物0,0.5,1,2,3,4和6 mmol·L-1,充分混匀,再加入Fenton反应试剂(FeSO425 μmol·L-1,H2O2100 μmol·L-1),最终体积为10 μl,于室温下反应30 min。反应结束后,加入上样缓冲液,用1%的琼脂糖凝胶电泳。用溴化乙锭染色凝胶后,用紫外凝胶成像系统照相并保存。用Labworks4.0软件对电泳图中各泳道的两条DNA带进行吸光度分析,参考文献[8]中的方法以空白对照(未处理的超螺旋质粒DNA)做修正,按下式计算实验组抑制DNA损伤百分数,以表征受试化合物抑制DNA损伤的能力。由于超螺旋态DNA比开环态不易被溴化乙锭染色,因此超螺旋态条带吸光度乘以校正因子1.24,再计算两条带吸光度各占该泳道的相对百分比。
开环态DNA百分比(%)=〔开环态DNA吸光度×1.24/(开环态DNA吸光度×1.24+超螺旋态DNA吸光度)〕×100%;抑制DNA损伤百分率(%)=〔1-(加入药品组开环态DNA所占百分比/损伤组开环态DNA所占百分比)〕×100%。其中损伤组为加入药品浓度为0的阴性对照组。每组至少重复3次,取平均值,采用Origin7.5软件作图并用S拟合,获得R2>0.98的拟合曲线,求出受试化合物的IC50值。
1.3 抑制AAPH引起的DNA损伤作用的检测
在离心管中依次加入0.8 μg超螺旋态质粒DNA,受试化合物0,0.05,0.1,0.2,0.4,0.6和1 mmol·L-1,充分混匀,再加入AAPH 160 mmol·L-1(由PBS缓冲液稀释,pH 7.2),最终体积为10 μl,于37℃下反应2 h。反应结束后,按上述方法进行琼脂糖凝胶电泳,对电泳图中各泳道的两条DNA带进行吸光度分析,计算实验组抑制DNA损伤百分率。每组至少重复3次,取平均值,采用Origin7.5软件作图并用S拟合,获得R2>0.98的拟合曲线,求出受试化合物的IC50值。
1.4 抑制SIN-1引起的DNA损伤作用的检测
在离心管中依次加入0.8 μg超螺旋态质粒DNA,与受试化合物0,0.1,0.5,1,2,4和6 mmol·L-1充分混匀,再加入SIN-1 2 mmol·L-1(由PBS缓冲液稀释,pH 7.2),最终体积为10 μl,于37℃下反应2 h。反应结束后,按上述方法进行琼脂糖凝胶电泳,对电泳图中各泳道的两条DNA带进行吸光度分析,计算实验组抑制DNA损伤百分率。每组至少重复3次,取平均值,采用Origin7.5软件作图并用S拟合,获得R2>0.98的拟合曲线,求出受试化合物的IC50值。
2 结果
2.1 酚酸类化合物抑制羟自由基对DNA的损伤
图2为没食子酸实验组凝胶电泳结果。由图3可见,没食子酸、咖啡酸、阿魏酸、芥子酸、对香豆酸和Trolox均表现出抑制羟自由基对DNA损伤的作用,而且具有浓度依赖效应(R2>0.98,P<0.05),随着酚酸类化合物浓度的升高,DNA损伤程度减弱。受试化合物抑制DNA损伤的IC50值见表1。抑制羟自由基对DNA损伤的作用由强到弱依次为:没食子酸≈咖啡酸>对香豆酸>芥子酸>阿魏酸>Trolox。其中没食子酸和咖啡酸清除羟自由基的作用最强,约为Trolox的3倍。
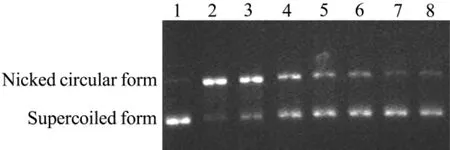
Fig.2 Agarose gel electrophoresis of gallic acid protecting aginst supercoiled plasmid DNA damage from hydroxyl radicals.Gallic acid,supercoiled DNA and Fen ton reagents were incubated for 30 min at room temperature,following electrophoresis on 1%of agarose gel in TAE buffer.Lane 1:supercoiled plasmid DNA;lane 2:supercoiled plasmid DNA+Fenton reagents(FeSO425 μmol·L-1,H2O2 100 μmol·L-1)(negative control);lanes 3-8:supercoiled plasmid DNA+Fenton reagents+gallic acid at concentrations of 0.5,1,2,3,4 and 6 mmol·L-1,respectively.
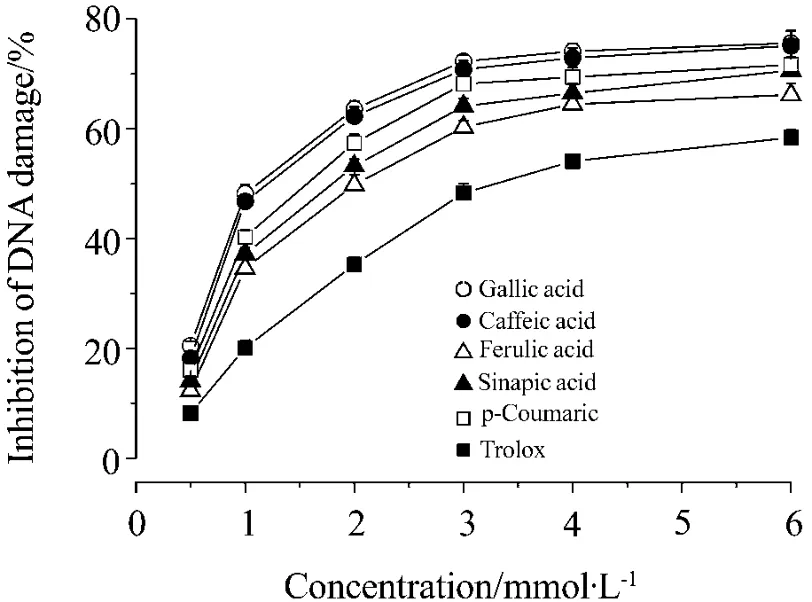
Fig.3 Protective effect of gallic acid,caffeic acid,ferulic acid,sinapic acid,p-coumaric acid and Trolox against plasmid DNA damage induced by hydroxyl radicals.The tested compounds incubated with supercoiled plasmid DNA for 30 min at room temperature.The percent inhibition of DNA damage was measured using electrophoresis of agarose gel.Inhibitory rate of DNA damage(%)=〔1-(A/B)〕×100%,where A is the percentage of the nicked DNA with the tested compounds;B is the percentage of the nicked DNA without the tested compounds.
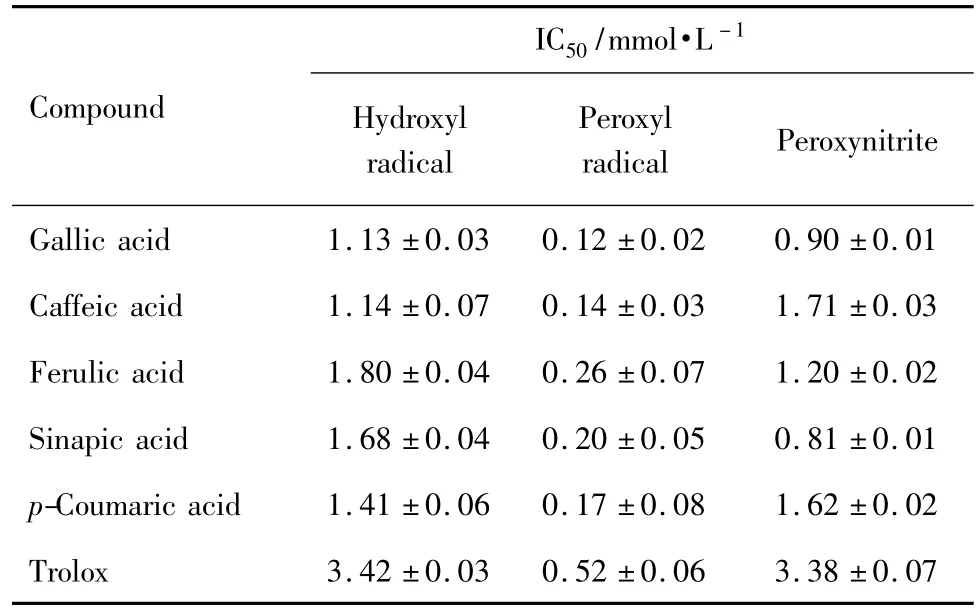
Tab.1 IC50values for scavenging various radicals of five natural phenolic acids
2.2 酚酸类抑制过氧自由基损伤DNA的效应
没食子酸、咖啡酸、阿魏酸、芥子酸、对香豆酸和Trolox抑制过氧自由基所致DNA损伤的作用见图4。5种酚酸类化合物均表现出抑制过氧自由基损伤DNA的作用,且具有明显的浓度依赖性(R2>0.98,P<0.05)。各化合物抑制DNA过氧自由基损伤的IC50值见表1,没食子酸的保护效应最强,约为Trolox的4.3倍。各化合物清除过氧自由基的作用由强到弱依次为:没食子酸>咖啡酸>对香豆酸>芥子酸>阿魏酸>Trolox,该顺序与清除羟自由基抑制DNA损伤的作用基本一致。
2.3 酚酸类抑制过氧亚硝基阴离子损伤DNA的效应

Fig.4 Protective effect of gallic acid,caffeic acid,ferulic acid,sinapic acid,p-coumaric acid and Trolox against plasmid DNA damage induced by 2,2'-azobis(2-methylpropionamidine)dihydrochloride(AAPH).The tested compounds incubated with the supercoiled plasmid DNA and AAPH 160 mmol·L-1for 2 h at 37℃.
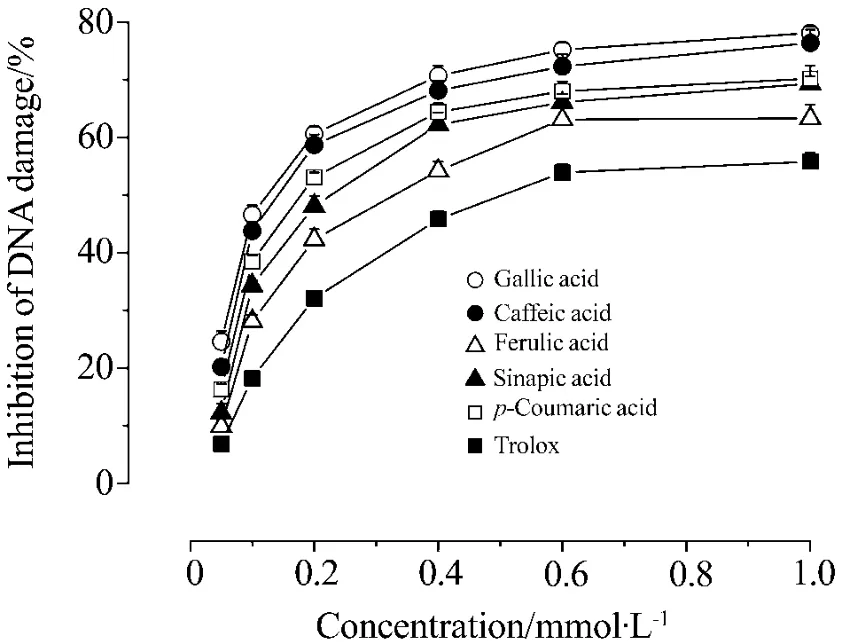
Fig.5 Protective effect of gallic acid,caffeic acid,ferulic acid,sinapic acid,p-coumaric acid and Trolox against plasmid DNA damage induced by ONOO-.The tested compounds incubated with the supercoiled plasmid DNA and amino-3-morpholinyl-1,2,3-oxadiazolium chloride(SIN-1)2 mmol·L-1for 2 h at 37℃.
如图5所示,没食子酸、咖啡酸、阿魏酸、芥子酸、对香豆酸和Trolox具有清除ONOO-、保护DNA免受氧化损伤的能力,具有明显的浓度依赖性(R2>0.98,P<0.05)。各受试化合物抑制ONOO-损伤DNA的IC50值见表1。与清除羟自由基和过氧自由基的作用存在明显差异,保护ONOO-所致的DNA损伤的作用由强到弱依次为:芥子酸>没食子酸>阿魏酸>对香豆酸≈咖啡酸>Trolox。其中芥子酸表现出了很强的保护DNA免受ONOO-损伤的作用,约为Trolox的4.2倍;咖啡酸的抑制作用最弱,仅为Trolox的2.0倍。
3 讨论
酚酸类化合物主要是通过递氢反应来清除Fenton反应引发的羟自由基和AAPH引发生产的过氧自由基,起到抗氧化作用。同时,研究表明酚酸类化合物可以通过递氢的方式直接与DNA被氧化后所形成的自由基作用[9]。酚酸类化合物传递出氢原子后自身成为相对稳定的苯氧自由基,从而终止自由基引起的链式反应,起到清除自由基的作用。因此,酚酸类化合物递氢能力及所形成的苯氧自由基的稳定性很大程度上决定了其抗氧化能力。
本研究结果表明,5种中药酚酸类化合物清除羟自由基与过氧自由基的作用大小顺序基本一致,即没食子酸最强,咖啡酸次之,阿魏酸最弱,但均强于Trolox。没食子酸分子中具有3,4,5-三羟基结构,在所有化合物中含有的酚羟基数目最多,递氢能力最强,在受试的酚酸类化合物中抗氧化能力也最强。同时,没食子酸中1位的COOH基团具有吸电子能力,会减弱4位羟基的递氢作用,所以在3,4,5位的三个羟基中只有3,5位的羟基递氢能力较强,因此没食子酸清除羟自由基的能力与咖啡酸接近。咖啡酸具有3,4-二羟基结构,且1位是-CH=CHCOOH基团。由于-CH=CHCOOH的供电子效应使4位羟基的递氢作用强于3位羟基。4位羟基递氢之后形成的单电子可以通过乙烯桥增强稳定性,同时3位羟基的氢原子可以与4位氧原子形成分子内氢键,能够稳定氧原子上的单电子[9],并且容易生成稳定的半醌式自由基,使咖啡酸具有较强的清除氧自由基的能力。对香豆酸、芥子酸和阿魏酸均只有一个酚羟基,三者中以对香豆酸清除氧自由基的能力最强,阿魏酸最弱。这与文献[10]报道的关于咖啡酸、阿魏酸和芥子酸等抑制由AAPH所致的脂质过氧化损伤的效应大小次序相同。
由SIN-1引发的ONOO-不同于羟自由基和过氧自由基之处是ONOO-具有氧化和硝化等复杂的反应特性。因此,在考察酚酸类化合物清除ONOO-的能力时,不能只考虑酚酸类化合物的抗氧化性,也需要考虑酚酸类化合物的抗硝化等性质。在受试的5种天然化合物中,芥子酸对ONOO-引起的DNA氧化损伤的抑制作用最强。由于原子的空间位阻和自由基的取向,芥子酸与ONOO-的反应并不发生在芳环上,而是通过单电子氧化在侧链发生二聚[11],这种二聚物的生成使得芥子酸清除ONOO-的能力增强。Kerry等[12]研究表明,阿魏酸和对香豆酸也能在不同程度上发生二聚。形成这种二聚物首先需要含有-CH=CHCOOH侧链基团,同时,为了使电子能转移到侧链上,最好在另一端含有给电子基团,如烷氧基,而避免含有吸电子基团,如羟基。因此,芥子酸清除ONOO-的能力强于阿魏酸,而阿魏酸又强于对香豆酸。没食子酸由于含有三联酚羟基结构,表现出了较强的清除ONOO-的能力,咖啡酸由于不能生成侧链二聚物,而表现出较弱的抗ONOO-氧化损伤DNA的能力。
5种中药酚酸类化合物均表现出抑制自由基引起的DNA损伤的作用,且优于Trolox。多羟基的酚酸类化合物具有较强的清除羟自由基和过氧自由基的能力,侧链含有-CH=CHCOOH且对位为供电子基团的酚酸类具有较强的清除过氧亚硝基阴离子的能力。在5种酚酸物中,没食子酸是兼具清除羟自由基、过氧自由基及ONOO-最好的化合物。本研究所采用的体外研究酚酸类化合物抑制自由基引起的DNA氧化损伤效应的方法简单易行,结果可靠,可用于抗癌中药的早期研发和筛选。
[1]Barnham KJ,Masters CL,Bush AI.Neurodegenerative diseases and oxidative stress[J].Nat Rev Drug Discov,2004,3(3):205-214.
[2]Orrenius S,Gogvadze V,Zhivotovsky B.Mitochondrial oxidative stress:implications for cell death[J].Annu Rev Pharmacol Toxicol,2007,47:143-183.
[3]Surh YJ.Cancer chemoprevention with dietary phytochemicals[J].Nat Rev Cancer,2003,3(10):768-780.
[4]Robbins RJ.Phenolic acids in foods:an overview of analytical methodology[J].Agric Food Chem,2003,51(10):2866-2887.
[5]Zhao GR,Xiang ZJ,Ye TX,Yuan YJ,Guo ZX.Antioxidant activities of Salvia miltiorrhiza and Panax notoginseng[J].Food Chem,2006,99(4):767-774.
[6]Zhao GR,Zhang HM,Ye TX,Xiang ZJ,Yuan YJ,Guo ZX,Zhao LB.Characterization of the radical scavenging and antioxidant activities of danshensu and salvianolic acid B[J].Food Chem Toxicol,2008,46(1):73-81.
[7]Zhao GR,Tian LL,Wang CS.Anticancer activity of Denshensu[J].Drug Evaluat Res(药物评价研究),2010,33(6):180-182.
[8]Perron NR,Hodges JN,Jenkins M,Brumaghim JL.Predicting how polyphenol antioxidants prevent DNA damage by binding to iron[J].Inorg Chem,2008,47(14):6153-6161.
[9]Anderson RF,Fisher LJ,Hara Y,Harris T,Mak WB,Melton LD,et al.Green tea catechins partially protect DNA from·OH radical-induced strand breaks and base damage through fast chemical repair of DNA radicals[J].Carcinogenesis,2001,22(8):1189-1193.
[10]Cheng JC,Dai F,Zhou B,Yang L,Liu ZL.Antioxidant activity of hydroxycinnamic acid derivatives in hu-man low density lipoprotein:mechanism and structureactivity relationship[J].Food Chem,2007,104(1):132-139.
[11]Niwa T,Doi U,Kato Y,Osawa T.Inhibitory mechanism of sinapinic acid against peroxynitrite-mediated tyrosine nitration of protein in vitro[J].FEBS Lett,1999,459(1):43-46.
[12]Kerry N,Rice-Evans C.Peroxynitrite oxidises catechols to o-quinones[J].FEBS Lett,1998,437(3):167-171.
Protective effect of five natural phenolic acids against DNA oxidative damage in vitro
WANG Chang-song1,TIAN Li-li1,ZHANG Jun-gang2,JI Xiang-wu2,ZHAO Guang-rong1
〔1.Key Laboratory of System Bioengineering(Ministry of Education),Department of Pharmaceutical Engineering,School of Chemical Engineering and Technology,Tianjin University,Tianjin300072;2.Department of Cardiology,Weifang People's Hospital,Weifang261041,China〕
OBJECTIVETo investigate the effect of natural phenolic acids compounds on free radicals induced DNA damage and to analyze the structure-activity relationship of these compounds.METHODSFive structurally relevant phenolic acids were selected:gallic acid,caffeic acid,sinapic acid,ferulic acid and p-coumaric acid.The synthetic antioxidant Trolox was used as positive control.The protective effect against hydroxyl radicals,peroxyl radicals and peroxynitriteinduced DNA damage were evaluated by agarose gel electrophoresis(AGE).The IC50of compounds was obtained by calculating the percentage of the nicked DNA based on densitometry analysis of AGE images.RESULTSAll the five natural phenolic acids protected DNA from oxidative damage in a concentration-dependent manner.The IC50against hydroxyl radicals was listed as follows:gallic acid(1.13±0.03)mmol·L-1≈caffeic acid(1.14±0.07)mmol·L-1<p-coumaric acid(1.41±0.06)mmol·L-1<sinapic acid(1.68±0.04)mmol·L-1<ferulic acid(1.80±0.04)mmol·L-1<Trolox(3.42±0.03)mmol·L-1.For peroxyl radicals,the IC50was listed as follows:gallic acid(0.12±0.02)mmol·L-1<caffeic acid(0.14±0.03)mmol·L-1<p-coumaric acid(0.17±0.08)mmol·L-1<sinapic acid(0.20±0.05)mmol·L-1<ferulic acid(0.26±0.07)mmol·L-1<Trolox(0.52±0.06)mmol·L-1.For peroxynitrites,the IC50was listed as follows:sinapic acid(0.81±0.01)mmol·L-1<gallic acid(0.90±0.01)mmol·L-1<ferulic acid(1.20±0.02)mmol·L-1<p-coumaric acid(1.62±0.02)mmol·L-1≈caffeic acid(1.71±0.03)mmol·L-1<Trolox(3.38±0.07)mmol·L-1.CONCLUSIONThe five natural phenolic acids can inhibit DNA damage induced by hydroxyl radicals,peroxyl radicals and peroxynitrites.The activities of scavenging hydroxyl radicals and peroxyl radicals increase with the number of adjacent hydroxyls while the side chain-CH=CHCOOH and electron-donating groups in para-position can strengthen the activity of scavenging peroxynitrites.
phenolic acids;hydroxyl radical;peroxyl radical;peroxynitrites;structure-activity relationship
The project supported by National Natural Science Foundation of China(30873400)
ZHAO Guang-rong,E-mail:grzhao@tju.edu.cn,Tel:(022)27405790
R282.5
A
1000-3002(2012)04-0529-05
10.3867/j.issn.1000-3002.2012.04.011
国家自然科学基金(30873400)
王长松(1988-),男,硕士研究生,主要从事天然产物制药研究;赵广荣(1966-),男,博士,教授,主要从事合成生物学与天然产物制药研究。
赵广荣,E-mail:grzhao@tju.edu.cn,Tel:(022)27405790
2011-11-18接受日期:2012-04-27)
(本文编辑:齐春会)

