脑缺血再灌注对海马神经MMP-9表达及ERK信号通路的影响
邓夏珩,高 丽,顾 昊,左国平,沈 伟,郭 军
(1南京医科大学基础医学实验教学中心,南京210029;2南京医科大学附属脑科医院)
基质金属蛋白酶(Matrix metalloproteinases,MMPs)是一组活性依赖钙离子和锌离子的中性蛋白酶基因家族,在各种组织中广泛表达,参与降解各种组织细胞外基质(ECM)[1]。现已识别20多种蛋白,其中MMP-9是MMPs家族的重要成员,其能破坏ECM降解的正常平衡,导致多种病理过程(如髓鞘脱失、血脑屏障损伤等)发生,在缺血性组织损伤的发生、发展中发挥重要的调节作用。胞外信号调节激酶(Extracellular signal-regulated kinase,ERK)是丝裂原活化蛋白激酶(Mitogen-actived protein kinase,MAPK)家族的首要成员,主要包括ERK1和ERK2,两者具有相似的结构和功能。钙信号能诱导ERK激活且伴随其自身磷酸化现象[2],激活的ERK信号通路能上调多种基因表达。2011年4月,我们对缺血再灌注后海马脑区ERK信号通路和MMP-9表达进行了检测,旨在探讨ERK钙依赖性激活对海马区MMP-9表达的影响及其可能的生物学效应。
1 材料与方法
1.1 材料 清洁级成年雄性SD大鼠50只(南京医科大学实验动物中心),体质量250 g左右,室温下饲养;ERK和磷酸化-ERK(p-ERK)抗体(Thr202 /Tyr204,Cell Signaling Technology公司);MMP-9(博奥森公司);N-甲基-D-天门冬氨酸(NMDA)受体偶联钙通道抑制剂氯胺酮(Sigma公司),ERK抑制剂U0216(Biomol公司)。
1.2 前脑缺血模型制备 取雄性SD大鼠20只随机分为模型组15只和假手术组5只,模型组采用四动脉阻断法建立前脑缺血模型[3]:水合氯醛(300 mg/kg)腹腔注射麻醉大鼠后俯卧位固定,暴露第2颈椎,电灼两侧椎动脉,造成永久性闭塞;腹侧颈正中切口并分离颈总动脉,丝线标记;电灼24 h后动脉夹夹闭双侧颈总动脉,使大鼠脑部供血完全阻断; 10 min后松开动脉夹,再灌注6、12和24 h。该过程要求大鼠在动脉充分阻断时须满足下列条件:脑电波完全平坦;瞳孔扩张;无角膜反射;直肠温度稳定在37℃左右。假手术组手术步骤同上,但不阻断动脉。
1.3 组织样本制备及蛋白表达检测 ①组织样本制备:将上述两组大鼠断头取脑,快速分离海马,并置于1∶10(W/V)的冰冷匀浆液(Hepes 50,pH 7.4, KCl 100 mmol/L,Na3VO41 mmol/L,NaF 50 mmol/ L,PMSF 1 mmol/L)中,匀浆器高速破碎组织;4℃低温800 g离心10 min取上清(为胞质和胞膜组分),置-80℃保存。Bradford法测定蛋白含量并将组织样本调整为等量蛋白浓度。②ERK、p-ERK、前酶原(pro)-MMP-9蛋白表达检测:采用电泳与免疫印迹分析法。取等量蛋白加入上样缓冲液100℃× 5 min制备组织蛋白变性样本。10%十二烷基磺酸钠(SDS)—聚丙烯酰胺凝胶(PAGE)分离蛋白,并转移至硝化纤维素(NC)膜,NC膜经3%牛血清白蛋白封闭2 h,室温下一抗孵育4 h或过夜;TBST洗膜3次,加入相应酶标二抗—辣根过氧化物酶(HRP)—偶联羊抗兔IgG(1∶10 000),兔抗鼠IgG (1∶10 000),室温反应2 h,TBST洗膜3次,暗室胶片曝光。每组实验均重复4次以上。取模型组p-ERK、pro-MMP-9蛋白表达最显著的再灌注时间点用于下述实验的模型制备。
1.4 氯胺酮及U0216对p-ERK、pro-MMP-9蛋白表达的影响 取30只SD大鼠随机分为氯胺酮组、U0126组、腹腔溶剂组、脑室溶剂组各5只和假手术组10只,前四组均采用上述方法建立前脑缺血模型,在动脉阻断前30 min氯胺酮组腹腔注射氯胺酮50 mg/kg;U0126组行乙醚麻醉,固定于脑立体定位仪上,使颅骨保持水平位置,用双氧水灼烧暴露前囟点,用直径1.5 mm的钻头于前囟后0.8 mm钻孔,旁开1.5 mm,深3.5 mm,用微量注射器通过单侧脑室注射U0126(0.5 μg/2 μL);腹腔溶剂组和脑室溶剂组分别经腹腔和脑室注射等量生理盐水;假手术组手术步骤同上,但不阻断动脉。各组处理完毕后均按照1.3方法进行组织样本制备及蛋白表达检测。
1.4 统计学方法 采用SPSS13.0软件进行统计学处理。计量数据以s表示,采用单因素方差分析(ANOVA)及Q检验(Newman-Keuls法),P≤0.05为差异有统计学意义。
2 结果
2.1 脑缺血/再灌注不同时间点海马脑区ERK、p-ERK和pro-MMP-9蛋白水平 前脑缺血10 min、再灌注后p-ERK和pro-MMP-9蛋白水平持续上调(P<0.05),且再灌注后24 h最高;而β-actin蛋白水平基本保持稳定,见图1。

图1 脑缺血诱导海马区pro-MMP-9蛋白和p-ERK活性
2.2 氯胺酮及U0216干预后p-ERK、pro-MMP-9蛋白表达变化 氯胺酮组p-ERK和pro-MMP-9蛋白水平显著高于腹腔溶剂组(P<0.05),见图2(Veh为溶剂、keta为氯胺酮)。U0126组及假手术组pro-MMP-9蛋白表达显著高于脑室溶剂组(P<0.05),见图3。
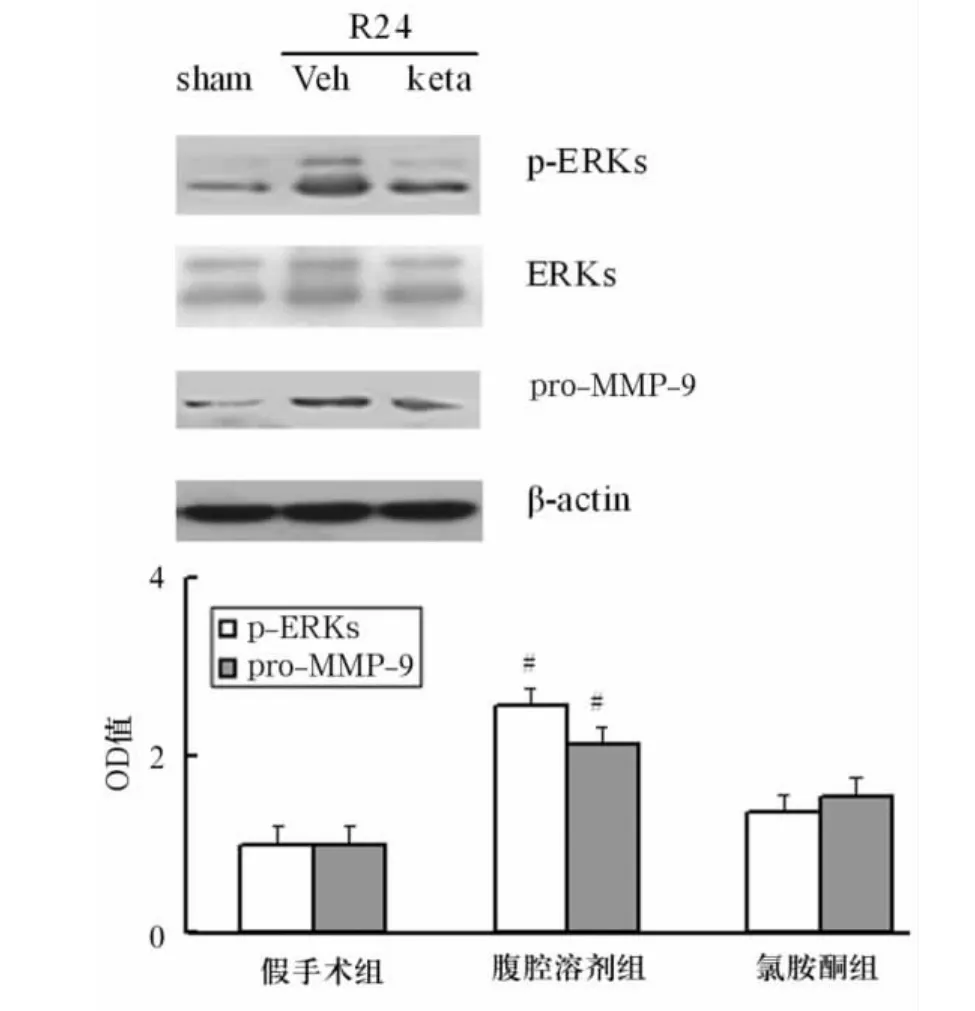
图2 氯胺酮对缺血后海马区MMP-9蛋白水平及ERK活性的影响
3 讨论
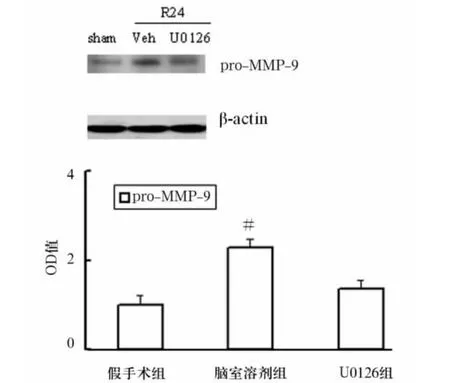
图3 ERK抑制剂U0126对缺血后海马区pro-MMP-9蛋白水平的影响
ERK是细胞内一类丝氨酸和(或)苏氨酸蛋白激酶,能将胞外的各种刺激信号通过一系列级联反应传至核内,在核内促进多种转录因子磷酸化,增强其转录活性。ERK信号通路参与多种生理功能和疾病的发病机制[4]。MMP-9是MMPs家族中相对分子质量最大的酶,越来越多的证据表明其能通过降解脑血管周围基膜主要成分Ⅳ、Ⅴ型明胶胶原及层粘连蛋白、纤维连接蛋白[5],触发缺血后继发性脑组织损伤。研究显示,MMP-9定位于神经元、血管内皮细胞及胶质细胞。脑缺血时MMP-9增加,其中内源性MMP-9主要来自星形胶质细胞和小胶质细胞,外源性MMP-9则来自内皮细胞、渗出的中性粒细胞和巨噬细胞。MMP-9活性一旦启动,即可通过降解细胞外基质成分破坏血脑屏障(Blood brain barrier,BBB)完整性[6,7]。另有研究显示,MMP-9表达越显著,BBB通透性越高、炎症反应越重,可导致脑组织广泛损伤,使神经功能损伤进一步恶化[8]。因此,MMP-9引起的这种脑组织继发损伤主要通过两个途径实现:①脑水肿形成。MMP-9表达或活性升高可通过降解细胞外基质使BBB受损,导致脑微血管通透性及BBB通透性增加,毛细血管内的水分与血浆蛋白外渗、细胞间隙内水分增多,引起血管源性脑组织水肿及神经细胞损伤。②诱发炎症反应。中性粒细胞、巨噬细胞均需借助于MMP-9游出血管外,BBB破坏则为炎性细胞侵入脑组织提供了通路。中性粒细胞本身可表达MMP-9,通过自身炎性破坏作用直接侵犯神经细胞;趋化因子释放可使中性粒细胞向微血管内皮细胞移动和黏附,致使中性粒细胞浸润,浸润、聚集的中性粒细胞可释放氧自由基、溶蛋白酶及细胞激动素等造成组织损伤、坏死,引起脑组织继发性损伤。因此,缺血诱导的MMP-9表达上调与缺血后继发性脑损伤有密切联系。
钙依赖性激活的ERK信号通路是缺血后MMP-9功能上调的重要因素,但ERK上调MMP-9转录功能的机制并不清楚。目前有研究表明,ERK信号级联能上调和激活Ets-1编码的蛋白,而MMP-9基因的启动子序列上存在4个Ets-1的结合原件[9]。故ERK通路很可能通过转录因子Ets-1启动了MMP-9的转录表达增加,促进了缺血后脑组织功能障碍。
氯胺酮是一种NMDA受体非竞争性阻断剂,可用于手术前麻醉诱导和手术中麻醉维持。U0126为ERK抑制剂,可预先抑制ERK通路活化。本研究显示,前脑缺血10 min、再灌注后 p-ERK和 pro-MMP-9蛋白水平持续上调,且24 h最高。提示前脑缺血/再灌注能诱导海马区p-ERK活性上调和pro-MMP-9蛋白水平升高,且两者可能存在密切联系。本研究还显示,氯胺酮组p-ERK和pro-MMP-9蛋白水平均显著高于腹腔溶剂组,U0126组MMP-9蛋白表达显著高于脑室溶剂组。提示脑缺血诱导的ERK激活和MMP-9表达上调与NMDA受体介导的钙信号密切相关,激活的 ERK级联可能参与了MMP-9表达调节;缺血诱导的 ERK激活参与了MMP-9基因表达的调控,是后者蛋白表达增加和功能上调的重要分子机制。
综上所述,脑缺血可诱导海马脑区pro-MMP-9基因表达和ERK活性上调,胞内NMDA受体介导的钙信号增强及其激活的ERK级联是其重要机制;此为缺血后脑损伤的临床治疗提供了新的思路。
[1]曾聪,白岚.肝癌组织基质金属蛋白酶9与肿瘤坏死因子受体1的关系[J].山东医药,2009,49(17):18-20.
[2]李萌,鲁宏标,邱天竹,等.缺血性脑中风钙依赖性激活Raf-1/ ERK级联机制研究[J].中国病理生理杂志,2009,25(9):1752-1755.
[3]Pulsinelli WA,Brierley JB.A new model of bilateral hemispheric ischemia in the unanesthetized rat[J].Stroke,1979,10(3):267-272.
[4]Cao Q,Qian M,Wang XF,et al.Negative feedback regulation of Raf/MEK/ERK cascade in a rat model of cerebral ischemic preconditioning[J].Neurochem Res,2011,36(1):153-162.
[5]Klohs J,Baeva N,Steinbrink J,et al.In vivo near-infrared fluorescence imaging of matrix metalloproteinase activity after cerebral ischemia[J].J Cereb Blood Flow Metab,2009,29(7):1284-1292.
[6]Lu L,Tonchev AB,Kaplamadzhiev DB,et al.Expression of matrix metalloproteinases in the neurogenic niche of the adult monkey hippocampus after ischemia[J].Hippocampus,2008,18(10):1074-1084.
[7]Vikman P,Ansar S,Henriksson M,et al.Cerebral ischemia induces transcription of inflammatory and extracellular-matrix-related genes in rat cerebral arteries[J].Exp Brain Res,2007,183(4): 499-510.
[8]del Zoppo GJ,Milner R,Mabuchi T,et al.Microglial activation and matrix protease generation during focal cerebral ischemia[J].Stroke,2007,38(2):646-651.
[9]Vikman P,Ansar S,Henriksson M,et al.Cerebral ischemia induces transcription of inflammatory and extracellular-matrix-related genes in rat cerebral arteries[J].Exp Brain Res,2007,183(4): 499-510.