益生菌对感染幽门螺杆菌的C57BL/6小鼠胃黏膜IL-8、IFN-γ 以及 IL-4、IL-10的调节效应
赵 东 徐桂芳 邹晓平
南京大学医学院附属鼓楼医院消化科(210008)
幽门螺杆菌(Helicobacter pylori,H.pylori)感染是慢性胃炎、消化性溃疡以及胃癌、胃黏膜淋巴样组织(MALT)淋巴瘤等疾病的重要致病因素。目前,临床采用口服质子泵抑制剂、两种抗生素的三联疗法作为根除H.pylori的一线疗法,根除率可达65%~80%,但该方案在治疗过程中常发生抗生素相关的胃肠道不良反应,如腹泻、腹痛、恶心、呕吐、便秘等,且随着耐药菌株的大量出现,治疗失败的情况逐渐增多。
近20年来微生态制剂的研制取得了较大进展,并广泛应用于临床。多项研究[1~3]发现,益生菌不但在体外可有效抑制H.pylori,而且在体内能明显降低H.pylori的感染密度,减轻炎症反应。临床研究[4,5]发现,益生菌联合传统三联疗法可明显提高H.pylori根除率,并降低不良反应的发生率,但其具体作用机制仍未阐明。本研究通过采用乳酸杆菌、双歧杆菌和肠球菌联合标准三联疗法治疗感染H.pylori的小鼠模型,并观察治疗后Th1细胞免疫诱导的致炎因子白细胞介素(IL)-8、干扰素(IFN)-γ以及Th2细胞应答产生抗炎因子IL-4、IL-10含量的变化,旨在初步探讨益生菌治疗H.pylori感染的作用机制。
材料与方法
一、实验动物、试剂和药品
4~6周龄SPF级C57BL/6小鼠32只,雌性,体质量18~25 g,购自上海斯莱克实验动物有限公司,于SPF级动物饲养环境下饲养。H.pylori标准株NCTC11673、益生菌(乳酸杆菌、双歧杆菌、肠球菌)均由上海信谊药业有限公司惠赠。脑心浸液琼脂粉(BD公司),无菌脱纤维羊血购自湘临检验中心,快速尿素酶试剂、小鼠ELISA试剂盒(联科生物科技有限公司)。阿莫西林胶囊(500 mg/粒)(珠海亿邦制药股份有限公司),克拉霉素片剂(125 mg/片)(扬子江药业集团),埃索美拉唑肠溶片(20 mg/片)(阿斯利康制药有限公司)。
二、方法
1.制备H.pylori培养基:①脑心浸液血平板:称取脑心浸液琼脂粉10.4 g加入250 mL蒸馏水溶解后,高压蒸汽灭菌20 min,冷却后加入10 mL无菌脱纤维羊血,混匀后浇注于无菌培养皿,4℃冷藏备用;②MRS固体培养基:蛋白胨5 g,牛肉粉5 g,酵母浸液2.5 g,葡萄糖10 g,K2HPO42.5 g,柠檬酸铵1 g,NaCl 2.5 g,MgSO40.25 g,MnSO40.1 g,Tween-800.5 g,以蒸馏水500 mL溶解后加琼脂粉10 g,高压蒸汽灭菌20 min,置于无菌培养皿,4℃保存备用。
2.H.pylori培养和菌液制备:①H.pylori培养传代:H.pylori复苏后取长势良好者密集接种于脑心浸液血平板,置于厌氧箱中微需氧环境(50 mL/L O2,850 mL/L N2,100 mL/L CO2)培养 48 h。②细菌悬液制备:无菌接种环从脑心浸液血平板上收集H.pylori菌落以无菌0.9%NaCl溶液制成混悬液,采用比浊管法调整菌悬液浓度为1×109CFU/mL。
3.益生菌悬液、药液的配制:无菌接种环收集MRS培养平板上的菌株,用0.9%NaCl溶液配成悬液,浓度调整为1×109CFU/mL。各种药物剂量按人与小鼠之间的用药剂量换算,埃索美拉唑(20 mg)采用0.9%NaCl溶液稀释成浓度为0.6 mg/mL的溶液,克拉霉素(125 mg)为 15.15 mg/mL,阿莫西林(500 mg)为30.3 mg/mL。
4.实验动物分组和干预:32只小鼠随机分为正常对照组、模型组、标准三联治疗组、联合治疗组,每组各8只。后三组小鼠禁食12 h,以H.pylori悬液0.2 mL隔天灌胃,连续2个月,以诱导 H.pylori感染模型。正常对照组小鼠以等体积无菌0.9%NaCl溶液灌胃。造模成功后,模型组小鼠每天给予0.9%NaCl溶液 0.6 mL,连续 14 d;标准三联治疗组小鼠每天予埃索美拉唑、克拉霉素和阿莫西林各0.2 mL灌胃后禁食4 h,连续7 d。联合治疗组在给予标准7 d三联治疗的基础上,先予2%NaHCO3溶液0.1 mL灌胃,再予1×109CFU/mL 乳酸杆菌、双歧杆菌、肠球菌悬液0.2 mL灌胃,连续14 d;正常对照组小鼠不予任何干预。治疗4周后,断颈法处死小鼠取胃,用于后续实验。
5.H.pylori感染的鉴定:采用快速尿素酶试验、Giemsa染色以及细菌培养检测H.pylori,三项检查中至少两项阳性判断为H.pylori感染。治疗结束4周后,再行快速尿素酶试验、Giemsa染色、细菌培养,3项均阴性为成功根除H.pylori。
6.组织病理学检查:各组小鼠处死后取胃体、胃窦组织用4%中性甲醛固定,常规HE染色,病理科医生双盲阅片。行胃黏膜慢性炎症评分[6]。
7.ELISA法:取小鼠胃黏膜组织500 mg,匀浆后离心取上清。采用ELISA法测定小鼠胃黏膜IL-8、IFN-γ以及IL-4、IL-10含量,具体步骤按说明书操作。
三、统计学分析
结 果
一、H.pylori根除率
联合治疗组小鼠的H.pylori根除率为87.8%(7/8),显著高于标准三联治疗组的62.5%(5/8)(P<0.05);模型组根除率为0,正常对照组无小鼠感染H.pylori(见图1)。
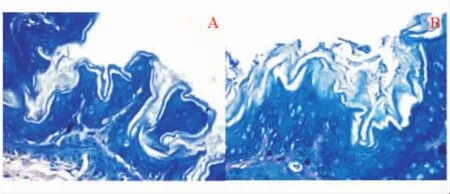
图1 治疗后联合治疗组和模型组Giemsa染色(×400)
二、胃黏膜慢性炎症评分
造模后,模型组小鼠胃黏膜慢性炎症评分显著高于正常对照组(2.33 ±0.45 对 0.11 ±0.04,P <0.05);标准三联治疗组(1.81 ±0.28)和联合治疗组(1.07±0.26)评分显著低于模型组(P <0.05),且联合治疗组又显著低于标准三联治疗组(P<0.05),但仍显著高于正常对照组(P <0.05)。
模型组小鼠胃黏膜下层和黏膜固有层可见大量中性粒细胞浸润,标准三联治疗组小鼠黏膜下层和黏膜固有层仍有中性粒细胞浸润,联合治疗组小鼠黏膜固有层中性粒细胞浸润明显减轻,正常对照组小鼠胃黏膜无中性粒细胞浸润(见图2)。
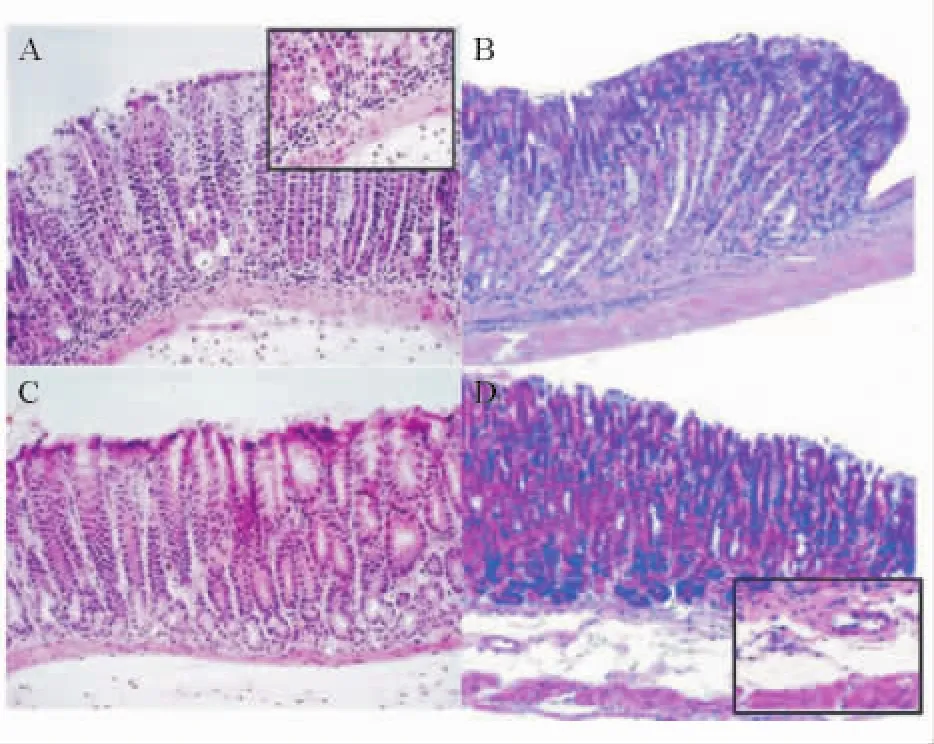
图2 各组小鼠胃黏膜组织病理学检查(HE染色,×200)
三、胃黏膜 IL-8、IFN-γ 以及 IL-4、IL-10 含量
联合治疗组小鼠胃黏膜IL-8、IFN-γ含量较标准三联治疗组和模型组显著下降[IL-8:(74.56±5.84)pg/mL 对(104.18 ±3.28)pg/mL 和(188.61 ±4.48)pg/mL,IFN-γ:(59.43 ± 2.07)pg/mL 对(107.32 ±3.06)pg/mL 和(169.82 ±3.81)pg/mL,P<0.05],但仍显著高于正常对照组[分别为(1.35 ±0.46)pg/mL、(1.46 ±0.56)pg/mL](P <0.05);标准三联治疗组小鼠胃黏膜 IL-8、IFN-γ 含量显著低于模型组(P<0.05),亦显著高于正常对照组(P <0.05)。
联合治疗组小鼠胃黏膜IL-4、IL-10含量与标准三联治疗组、模型组和正常对照组[IL-4:(43.46±3.62)pg/mL 对(4.63 ± 0.47)pg/mL、(3.37 ±0.33)pg/mL 和 (1.23 ± 0.27)pg/mL;IL-10:(74.21 ±2.27)pg/mL 对(5.24 ± 0.23)pg/mL、(4.51 ±0.42)pg/mL 和(4.73 ± 1.42)pg/mL]相比均显著升高(P<0.05),而后三组之间IL-4、IL-10含量无明显差异(P>0.05)(见图3)。

图3 各组小鼠胃黏膜IL-8、IFN-γ以及IL-4、IL-10含量
讨 论
微生态制剂为H.pylori感染的治疗提供了一种崭新的思路。国内外多项临床研究和荟萃分析[7~10]报道,在标准三联疗法的基础上加用益生菌可明显提高H.pylori根除率。益生菌抑制H.pylori的可能机制为竞争营养素、竞争性占位、抑制性产物(如乳酸盐、H2O2、短链脂肪酸和防御素)以及免疫调节作用。本实验通过成功建立H.pylori感染的小鼠模型,对益生菌在胃部的可能作用机制进行初步探讨。
H.pylori定植于胃黏膜,其抗原持续刺激可引起局部特异性免疫反应。人体和动物实验均证实H.pylori感染后胃黏膜发生以Th1型为主的免疫反应,对胃黏膜活检标本分离的T细胞行培养发现,Th1型细胞因子IFN-γ、IL-12分泌增多,而Th2型细胞因子 IL-4、IL-10 很少或缺乏[11,12]。但同时与正常人相比,H.pylori患者Th2免疫应答增强,Th1免疫应答受到抑制。这是机体抵御细菌感染而启动的自我保护机制。H.pylori抗原与H.pylori感染者外周淋巴细胞共同培养发现,T细胞增生反应降低,IFN-γ和IL-2水平低于非感染者,而H.pylori感染者外周血和胃组织淋巴细胞的Th2型细胞因子IL-4、IL-6、IL-10 水平高于对照组[13,14]。这种现象表明机体在抵御外来抗原与限制自身组织损伤过程中同时存在Th1、Th2反应与炎症反应自我平衡的过程,两种免疫反应相互制约,其结果将决定疾病的结局。
IL-8可引起中性粒细胞趋化和脱颗粒造成黏膜局部炎症,导致胃十二指肠溃疡的发生和发展,且IL-8 mRNA表达以及胃黏膜组织含量与中性粒细胞浸润程度相一致,根除H.pylori后胃黏膜IL-8水平明显降低,中性粒细胞浸润的平均密度亦显著降低[15,16]。胃黏膜局部IL-8主要来源于胃黏膜上皮细胞,同时作为抵御外来病原体接触机体的第一道屏障,一旦感染H.pylori便可诱发胃上皮细胞大量分泌IL-8,这可能是 H.pylori相关胃炎的始动因素。Th1应答分泌大量IFN-γ,增强各种炎症细胞如巨噬细胞、中性粒细胞的活性,并释放各种炎症递质、细胞因子、活性氧簇和活性氮簇等,造成胃上皮损伤。减少IFN-γ可减轻H.pylori感染引起的炎症。Smythies等[17]在体外用特异性抗体中和IFN-γ能明显减轻H.pylori引起的炎症,而IFN-γ-/-小鼠长期感染H.pylori后并未引起胃黏膜炎症。本实验发现,联合益生菌治疗可显著降低胃黏膜IL-8、IFN-γ含量,且组织学示小鼠胃黏膜炎性反应明显减轻,慢性炎症评分亦显著低于标准三联疗法。
IL-10是炎症抑制因子和免疫调节因子。Chen等[18]的研究发现IL-10-/-小鼠胃黏膜 H.pylori的定植量较 IL-10+/-小鼠下降了100倍,血清 H.pylori特异性IgA、IgG抗体明显增多,导致更严重的慢性胃炎,说明IL-10在保护组织免受损伤中起重要作用。Symthies等[17]系统研究了 H.pylori感染对不同免疫状态小鼠的影响,从患者体内分离的新鲜Ⅰ型H.pylori菌株(SPM326)感染 C57BL/6J野生型、SCID 以及 IFN-γ-/-、IL-4-/-、C57BL/10J、BALB/c 小鼠,结果显示IL-4-/-小鼠以及野生型小鼠发生Th1型免疫反应,C57BL/10J、BALB/c小鼠发生Th0型反应,IFN-γ-/-小鼠发生Th2型免疫反应,胃黏膜炎症依次减轻。用H.pylori尿素酶刺激各组小鼠培养的脾细胞悬液,分泌的细胞因子与H.pylori感染的胃黏膜一致。用H.pylori抗原刺激IFN-γ-/-小鼠,脾T细胞以分泌IL-4为主且胃黏膜炎症最轻,而以H.pylori抗原刺激IL-4-/-小鼠,脾T细胞IFN-γ水平最高且胃黏膜炎症最为严重。进一步说明IFN-γ与IL-4存在相互限制的作用。本研究中,联合益生菌治疗后,小鼠胃黏膜IFN-γ含量减少且 IL-4、IL-10含量明显增多,提示益生菌在促进T细胞向Th2细胞分化方面起重要作用,能抑制IFN-γ水平并下调Th1型免疫反应,从而减轻由H.pylori感染所致的炎症反应。
既往益生菌的研究多集中于肠道,本实验对其在胃部可能的作用机制作一探讨。考虑到胃部的高酸环境,小鼠灌胃益生菌前,先予2%NaHCO3溶液0.1 mL,以提高胃部pH值。本研究所用乳酸杆菌、双歧杆菌、肠球菌均可在酸性环境中存活。此外,除外活菌体,益生菌本身的死菌体及其代谢产物亦有竞争性占位、抑制炎症反应、免疫调节等作用。因此,益生菌可定植于胃内并发挥抗H.pylori的疗效。
总之,本实验通过H.pylori感染的C57BL/6小鼠模型探索益生菌根除H.pylori的免疫调节机制,发现联合益生菌治疗不仅可提高标准三联疗法的H.pylori根除率,同时还可减轻小鼠胃黏膜炎症反应,其机制可能是通过减少Th1细胞应答产生的IL-8、IFN-γ等致炎因子,并诱导Th2细胞应答产生的IL-4、IL-10等抗炎因子,从而减轻黏膜炎症,增强抗H.pylori的效果。但在治疗所用的乳酸杆菌、双歧杆菌、肠球菌这三种益生菌中,究竟是哪种益生菌发挥了主要功效,仍有待进一步研究证实。
1 Johnson-Henry KC,Mitchell DJ,Avitzur Y,et al.Probiotics reduce bacterial colonization and gastric inflammation in H.pylori-infected mice[J].Dig Dis Sci,2004,49(7-8):1095-1102.
2 Sgouras D,Maragkoudakis P,Petraki K,et al.In vitro and in vivo inhibition of Helicobacter pylori by Lactobacillus casei strain Shirota[J].Appl Environ Microbiol,2004,70(1):518-526.
3 Sgouras DN,Panayotopoulou EG,Martinez-Gonzalez B,et al.Lactobacillus johnsonii La1 attenuates Helicobacter pylori-associated gastritis and reduces levels of proinflammatory chemokines in C57BL/6 mice[J].Clin Diagn Lab Immunol,2005,12(12):1378-1386.
4 Sheu BS,Wu JJ,Lo CY,et al.Impact of supplement with Lactobacillus-and Bifidobacterium-containing yogurt on triple therapy for Helicobacter pylori eradication[J].Aliment Pharmacol Ther,2002,16(9):1669-1675.
5 Cremonini F,Di Caro S,Covino M,et al.Effect of different probiotic preparations on anti-helicobacter pylori therapy-related side effects:a parallel group,triple blind,placebo-controlled study[J].Am J Gastroenterol,2002,97(11):2744-2749.
6 Dixon MF,Genta RM,Yardley JH,et al.Classification and grading of gastritis.The updated Sydney System.International Workshop on the Histopathology of Gastritis,Houston 1994[J].Am J Surg Pathol,1996,20(10):1161-1181.
7 de Bortoli N,Leonardi G,Ciancia E,et al.Helicobacter pylori eradication:a randomized prospective study of triple therapy versus triple therapy plus lactoferrin and probiotics[J].Am J Gastroenterol,2007,102(5):951-956.
8 Tong JL,Ran ZH,Shen J,et al.Meta-analysis:the effect of supplementation with probiotics on eradication rates and adverse events during Helicobacter pylorieradication therapy[J].Aliment Pharmacol Ther,2007,25(2):155-168.
9 Sachdeva A,Nagpal J.Effect of fermented milk-based probiotic preparations on Helicobacter pylori eradication:a systematic review and meta-analysis ofrandomizedcontrolled trials[J].Eur J Gastroenterol Hepatol,2009,21(1):45-53.
10 Szajewska H,Horvath A,Piwowarczyk A.Meta-analysis:the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment[J].Aliment Pharmacol Ther,2010,32(9):1069-1079.
11 Luzza F,Parrello T,Sebkova L,et al.Expression of proinflammatory and Th1 butnotTh2 cytokines is enhanced in gastric mucosa of Helicobacter pylori infected children[J].Dig Liver Dis,2001,33(1):14-20.
12 Mattapallil JJ,Dandekar S,Canfield DR,et al.A predominant Th1 type of immune response is induced early during acute Helicobacterpyloriinfection in rhesus macaques[J].Gastroenterology,2000,118(2):307-315.
13 Crabtree JE,Shallcross TM,Heatley RV,et al.Mucosal tumour necrosis factor alpha and interleukin-6 in patients with Helicobacter pylori associated gastritis[J].Gut,1991,32(12):1473-1477.
14 Fan XG,Yakoob J,Fan XJ,et al.Effect of IL-4 on peripheral blood lymphocyte proliferation:implication in immunopathogenesis of H.pylori infection[J].Immunol Lett,1995,48(1):45-48.
15 Yamaoka Y,Kita M,Kodama T,et al.Chemokines in the gastric mucosa in Helicobacter pylori infection[J].Gut,1998,42(5):609-617.
16 Ando T,Kusugami K,Ohsuga M,et al.Interleukin-8 activity correlates with histological severity in Helicobacter pylori-associated antral gastritis[J].Am J Gastroenterol,1996,91(6):1150-1156.
17 Smythies LE,Waites KB,Lindsey JR,et al.Helicobacter pylori-induced mucosal inflammation is Th1 mediated and exacerbated in IL-4,but not IFN-gamma,gene-deficient mice[J].J Immunol,2000,165(2):1022-1029.
18 Chen W,Shu D,Chadwick VS.Helicobacter pylori infection:mechanism ofcolonization and functional dyspepsia Reduced colonization of gastric mucosa by Helicobacter pylori in mice deficient in interleukin-10[J].J Gastroenterol Hepatol,2001,16(4):377-383.

