一种评价甘蓝枯萎病菌转化子致病力的方法
李伶俐, 向红琼, 李兴红, 严 红, 杨腊英, 燕继晔
(1.贵州大学农学院,贵阳 550025;2.北京市农林科学院植物保护与环境保护研究所,北京 100097;3.中国热带农业科学院环境与植物保护研究所,儋州 571737)
由甘蓝枯萎病菌(Fusarium oxysporumf.sp.conglutinans)引起的甘蓝枯萎病是一种典型的土传病害[1],受害甘蓝在苗期即可发病,最初表现为叶脉变黄,随着病情的发展,整叶或全株变黄,进而植株变小而萎蔫,最后枯死,剖开植株的短缩茎可见维管束明显变褐。该病在大叶芥上的症状与甘蓝相似,也表现为萎蔫、黄化及枯死[2]。1895年,Smith在美国首次发现甘蓝枯萎病,该病害在美国东北部蔓延,随后在加拿大、日本等国家也相继报道[3-6],近年来,这种病害在我国北京、河北等地发生并蔓延迅速[7]。生产上除抗病品种选育外,至今没有其他的有效防治措施。
解析病原真菌的致病机理可以通过特定性状突变体筛选和鉴定特定性状基因功能来实现。通过突变体分离致病相关基因时,如何评价转化子的致病力是最关键的因素。快速、可靠、重复性强、高通量是评价转化子致病力测定的几个重要指标。国内外对甘蓝枯萎病菌致病机理的研究还比较匮乏,而建立一种快速评价甘蓝枯萎病菌转化子致病力的方法将有助于致病力变异突变体的筛选,为后期克隆控制甘蓝枯萎病菌致病力的功能基因、鉴定基因功能、解析甘蓝枯萎病菌致病机理提供帮助,也为甘蓝枯萎病的防治提供理论支持。本研究在综合考虑影响筛选致病力变异突变体的基础上经过探索和优化,最终建立了一个能够较好评价甘蓝枯萎病菌转化子致病力细微差异的体系。
1 材料与方法
1.1 试验材料
1.1.1 菌株
甘 蓝 枯 萎 病 菌 (Fusarium oxysporumf.sp.conglutinans)野生型菌株JZB310079,分离自北京市延庆县甘蓝产区,保存在北京市农林科学院植物保护与环境保护研究所植物病害综合防治研究室。
甘蓝枯萎病菌转化子共10个,是通过PEG介导将GFP基因转入甘蓝枯萎病菌JZB310079的原生质体后获得的随机转化子(结果未报道),编号为PDM01~PDM10,均以滤纸片保存于-20℃冰箱。
育苗基质(蛭石与土混合),购自北京市农林科学院蔬菜研究中心。
1.1.2 甘蓝品种
‘中甘21’和‘中甘15’,由中国农业科学院蔬菜花卉研究所提供。
1.2 方法
1.2.1 甘蓝苗种植
将大约5g甘蓝种子放入100mL烧杯,加入约70mL 60~65℃的热水,用玻璃棒不停地搅拌,至水温降至37℃以下时停止搅拌,继续浸泡种子15min,将其均匀地撒在用水浸湿的滤纸上,放入28℃培养箱,过夜萌发。将育苗基质倒入干净苗盘中,用灭菌牙签将萌发出芽的种子播种到育苗盘,轻轻铺上一层基质后浇少量的水,放入温室培养(25~28℃),每隔24h浇水1次,直至幼苗生长到合适叶龄。
1.2.2 接种体制备
用无菌棉棒将PDA培养基(9cm)上培养3~5d的甘蓝枯萎病菌野生型及转化子的菌丝轻轻刮下,用2~3mL无菌水反复冲洗并打断菌丝,吸取菌丝装至150mL液体CM培养基的摇瓶中摇培36h(120r/min,28℃),用无菌纱布滤去菌丝,滤液离心(4 000r/min,10min)后,用无菌水将沉淀的孢子稀释到合适浓度备用。
PDA培养基:马铃薯200g/L,葡萄糖20g/L,琼脂粉1.6%。
液体CM培养基:0.6%酵母提取物,0.3%酶水解干酪素,0.3%酸水解干酪素,1%蔗糖。
1.2.3 接种方法
蘸根法:苗盘中生长到合适苗龄的幼苗放入接种体中浸泡15~20min,植入育苗杯,温室培养(25~28℃),接种14d后进行病情观察。
灌根法:稀释到一定浓度的接种体直接浇灌幼苗的根系部,植入育苗杯中,温室培养(25~28℃),接种14d后进行病情观察。
伤根法:用无菌刀片切下幼苗根部约2~5mm的根系部分,稀释好的接种体浸泡幼苗受伤的根系15min后,植入育苗杯,接种14d后进行病情观察。
以上3种接种方法都以同样条件用清水浸泡处理幼苗作为对照,接种14d后进行病情观察,并且在接种后24h内禁止浇水,此后每隔24h浇水1次。
1.2.4 幼苗接种的时期
分别采用苗龄为三叶期和五叶期的甘蓝幼苗进行接种,三叶期指第1、2片叶完全展开,第3片叶抽出并刚展开的时期。五叶期指第1~4片叶完全展开,第5片叶抽出并刚展开的时期。
1.2.5 病情指数
对生长到合适叶龄的甘蓝植株接种14d后进行观察。每个植株按如下标准进行分级:0级,无病;1级,仅子叶变黄,真叶无症状;2级,子叶枯死,下部真叶变黄;3级,有1、2片真叶枯死,但心叶无症状;4级,整株枯死[8]。病情指数(DI)计算公式如下:
甘蓝品种按以下标准进行抗、感病分类:0<DI≤10,高抗(HR);10<DI≤30,抗病(R);30<DI≤50,中抗(MR);50<DI≤70,感病(S);70<DI,高感(HS)。
1.2.6 甘蓝枯萎病菌转化子致病力差异评价
根据优化的最佳方法(合适菌龄、合适苗龄、接种浓度、接种方法等)评价10株甘蓝枯萎病菌随机转化子和甘蓝枯萎病野生型菌株的致病力差异,转化子菌株和野生型菌株做一组对照,每个转化子菌株接种5株幼苗,野生型菌株接种10株幼苗,同样条件下,用清水接种5株幼苗作为空白对照。
2 结果与分析
2.1 不同接种浓度对甘蓝枯萎病发病的影响
采用蘸根法分别用孢子浓度为1×106个/mL和1×104个/mL的接种体接种三叶期幼苗后,前者的感病数量要多于后者(见图1),因此在进行甘蓝枯萎病菌转化子致病力评价时采用孢子浓度为1×106个/mL的接种体。
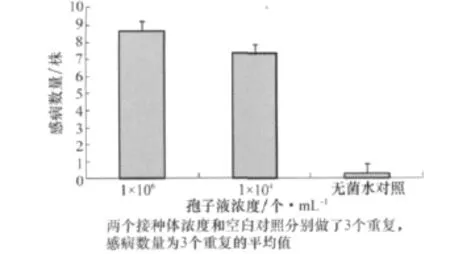
图1 不同接种浓度对发病的影响
2.2 不同接种方法对甘蓝枯萎病发病的影响
用蘸根法和伤根法接种,植株感病数量相当(图2),发病率均为90%,而灌根法接种后的感病效果明显没有蘸根法和伤根法的效果好,发病率为67%。这可能是因为蘸根法和伤根法接种体的孢子直接与植株根系接触,孢子直接侵染接种植株,导致植株感病快。从操作来看,蘸根法更容易操作,故以后的致病力评价试验优先选择蘸根法。

图2 不同接种方法对发病的影响
2.3 不同时期接种对甘蓝枯萎病发病的影响
蘸根法接种三叶期植株后的感病数量要多于用五叶期植株接种(见图3)。作者推测可能是因为三叶期的植株较幼嫩,抗病能力不强,容易感病。同时,培养甘蓝生长至三叶期时间较短,故在进行转化子致病力评价时采用三叶期的甘蓝幼苗。
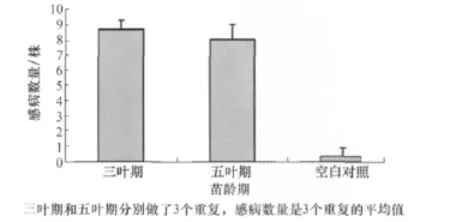
图3 不同时期接种对发病的影响
2.4 转化子致病力的差异分析
甘蓝枯萎病菌10个转化子和野生型菌株接种甘蓝(品种为‘中甘21’)幼苗后(感病植株见图4),可以观察到接种的甘蓝幼苗表现不同的发病程度,见表1。
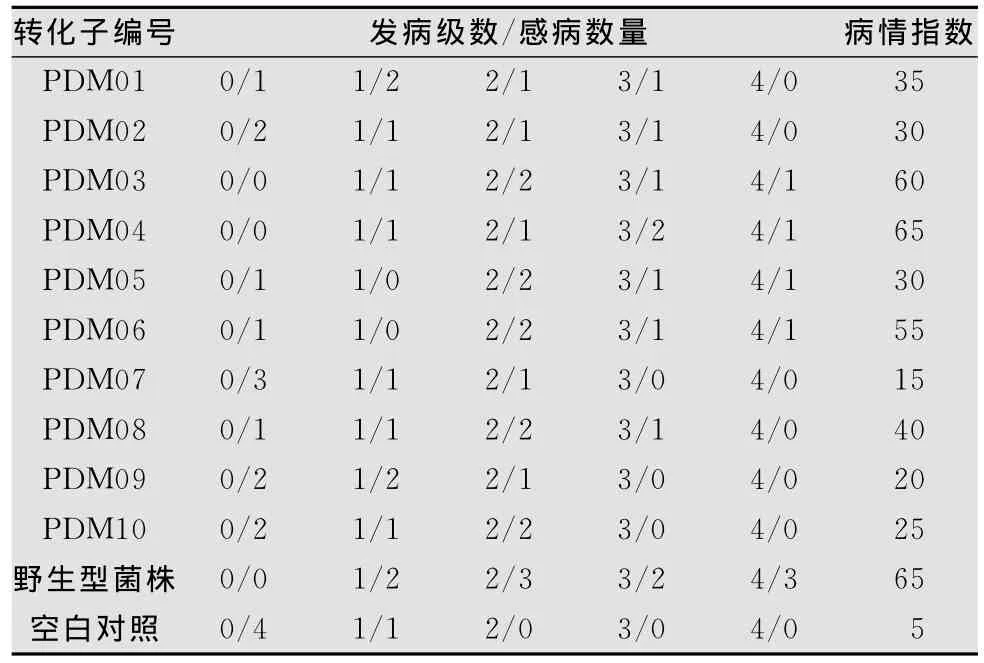
表1 甘蓝接种不同转化子后的病情指数1)
试验结果表明,用蘸根法接种可以比较合理地评价甘蓝枯萎病菌转化子的致病力差异,用此方法可以筛选到致病力衰弱或者增强的转化子。
2.5 甘蓝品种的抗性
野生型菌株接种三叶期的‘中甘21’,14d后的病情指数为65(表1),按照前述方法中的甘蓝品种抗病性鉴定标准,‘中甘21’对野生型菌株JZB310079而言属于感病(S)品种。
野生型菌株接种三叶期‘中甘15’,14d后的病情指数DI为47.5,按照前述方法中的甘蓝品种抗病性鉴定标准,‘中甘15’对野生型菌株JZB310079而言属于中抗(MR)品种。

图4 转化子和野生型菌株接种结果的比较
因此,适合甘蓝枯萎病菌JZB310079菌株转化子致病力评价的品种为‘中甘21’。
3 结论与讨论
本研究主要从接种方法、不同苗龄、接种体浓度3方面进行探索,研究结果表明,使用蘸根法或伤根法,接种苗龄为三叶期,接种体孢子浓度为1×106个/mL时,甘蓝幼苗的感病数量较多,与甘蓝黑腐病抗性材料筛选[9]的结果相似。蘸根法或伤根法比灌根法接种幼苗感病数量更多,可能是由于蘸根法和伤根法中的孢子直接接触幼苗根部,使其较易发病;三叶期接种比五叶期接种发病数量更多,可能是三叶期植株较幼嫩,抗病性较弱;孢子浓度为1×106个/mL蘸根后的发病率要高于浓度为1×104个/mL接种的发病率,可能是接种体的浓度越高植株越易发病。
试验过程中应注意以下问题:种子浸泡在热水中时要不停地搅拌种子,以免种子被烫死;把幼苗由苗盘转到育苗杯中时要轻轻拔起,以免幼苗根部被拔断;接种过程中在做对照时要避免育苗基质被杂菌污染,影响试验结果。试验结果表明:在相同条件下,用野生型菌株和转化子分别接种甘蓝幼苗,虽然接种后甘蓝幼苗都表现出不同程度的发病症状,但是用转化子的孢子悬浮液接种植株后发病率要低于用野生型菌株接种的发病率,有可能是因为所使用的绿色荧光蛋白载体是随机插入甘蓝枯萎病菌的染色体,不排除这个载体刚好插入到致病相关基因,也不排除在PEG介导的同源重组过程中染色体发生了缺失、颠换等现象,导致了控制甘蓝枯萎病菌致病力的基因发生突变,表现出菌株致病力下降。但转化子接种甘蓝幼苗后植株表现出致病力差异,可以初步表明该接种方法可以用来筛选转化子的致病力变化突变体,该方法为下一步尖孢镰刀菌转化子增强或衰弱突变体的筛选提供了基础,也为鉴定克隆甘蓝枯萎病菌致病力相关基因奠定了基础。
[1]耿丽华,迟胜起,康俊根,等.北京延庆县甘蓝枯萎病病原菌的分离及其生物学特性的研究[J].中国蔬菜,2009(2):34-37.
[2]李明远.十字花科枯萎病的识别与防治[J].中国蔬菜,2004(2):60.
[3]Farnham M W,Keinath A P,Smith J P.Characterization of Fusariumyellows resistance in collard[J].Plant Disease,2001,85(8):890-894.
[4]Morrison R H,Mengistu A,Williams P H.First report of race 2of cabbage yellows caused by Fusarium oxysporumf.sp.conglutinans in Texas[J].Plant Disease,1994,78:641.
[5]Ramirez-Villupadua J,Endo M,Bosland P,et al.A new race of Fusarium oxysporumf.sp.conglutinans that attacks cabbage with type A resistance[J].Plant Disease,1985,69:612-613.
[6]Nomura Y,Kato K,Takeuchi.Studies on the method of early selection of the resistance of cabbage to the yellows disease(in Japan)[J].Japanese Center Agriculture Experimentation Report,1976,24:141-182.
[7]李明远,张涛涛,李兴红.十字花科蔬菜枯萎病及其病原鉴定[J].植物保护,2003,29(3):44-45.
[8]田任鹏,康俊根,耿丽华,等.甘蓝枯萎病抗性鉴定方法研究[J].中国农学通报,2009,25(4):39-42.
[9]龚静,朱玉英,吴晓光.甘蓝黑腐病抗性材料筛选及接种方法的研究[J].上海农业科技,2001(4):87.

