具有除草活性的小麦根腐病菌发酵条件优化
魏松红, 张丽莹, 王 黎, 张景远, 李 斐
(沈阳农业大学植物保护学院,沈阳 110866)
化学除草剂的大量使用,对环境和人类的健康产生严重威胁[1],因此寻求更为安全有效的除草剂已成为除草剂产业今后的发展方向。近年来微生物源除草剂得到了较大的发展,从植物病原真菌中筛选具有除草活性的菌株是微生物源除草剂研究的一个很重要的方面[2]。
研究报道最多的产生除草活性毒素的植物病原真菌主要来自链格孢菌属(Alternaria)、镰刀菌属(Fusarium)、炭疽菌属(Colletotrichum)等。强胜等[3]对百日草链格孢菌(Alternaria alternata)孢子大规模生产以及该菌产生的毒素进行了提纯和生测,该菌株产生的毒素对紫茎泽兰(Eupatorium adenophorum)有致病作用。张金林等[4]研究发现葱叶枯病菌(Stemphylium botryosum)毒素对稗草(Echinochloa crusgalli)和马唐(Digitaria sanguinalis)等杂草种子的萌发和幼苗生长有较强的抑制作用。董金皋等[5]从灰葡萄孢BC7-3菌株的代谢产物中得到了一个纯度达99.38%对马唐具有较强杀除活性的纯组分。
本试验利用筛选到的对马唐种子萌发具有抑制作用的小麦根腐病菌菌株,对该菌株摇瓶发酵条件进行优化,为该菌株进行发酵工业生产提供依据,并为进一步利用该菌株产生的除草活性物质开发创制新农药奠定基础。
1 材料与方法
1.1 供试杂草、菌株和培养基
马唐(Digitaria sanguinalis)采自沈阳农业大学实验基地。
小麦根腐病菌(Bipolaris sorokiniana)由沈阳农业大学农药科学实验室提供,对马唐种子萌发抑制率达到81.67%。
PDA培养基、PSA培养基、Peberdy培养基、Richard培养基、察氏培养基。
1.2 菌株培养滤液制备
将小麦根腐病菌菌株扩繁,用直径0.5cm的打孔器打取菌片,接种于250mL三角瓶中,每瓶装有150mL PD培养液,每瓶接种3片,置于恒温培养箱中28℃、130r/min振荡培养,7d后,用4层纱布过滤去掉菌丝体,再用定性滤纸(中速)过滤,得到无菌培养滤液。
1.3 供试菌株培养滤液除草活性测定
采用种子萌发法测定菌株的除草活性。将滤纸放入培养皿中,165℃干热灭菌30min。在皿中放入待测杂草种子20粒,加入无菌培养滤液3mL,以清水做对照,重复3次,在28℃恒温培养箱中黑暗培养,对照发芽率达到80%及以上时,记录种子发芽数,并计算校正抑制率,用DPS数据处理系统Duncan新复级差法分析5%差异显著性。

1.4 初始发酵培养基的筛选
供试培养基选择PDA、PSK、Peberdy培养基、Richard培养基、察氏培养基。将筛选出的小麦根腐病菌分别接种于不同培养液中,28℃、130r/min振荡培养5d后过滤,进行除草活性测定。
1.5 发酵培养基成分优化
1.5.1 单因素试验
(1)碳源筛选:以筛选出的培养液作为基础培养液,1 000mL培养液中分别加入20g葡萄糖、麦芽糖、蔗糖、木糖、可溶性淀粉、乳糖作碳源,取代培养液中的碳源,每处理3次重复,以不加碳源的培养滤液为对照,28℃、130r/min振荡培养5d,过滤。(2)氮源筛选:在1 000mL基础培养液中,分别加入2.5g氯化铵、硝酸钠、硝酸钾、酵母膏、硝酸铵、蛋白胨作为氮源,每处理3次重复,以不加氮源的培养滤液作为对照,28℃、130r/min振荡培养5d,过滤。(3)添加不同无机盐:在1 000mL基础培养液中,分别加入 KCl 0.5g,K2HPO41.0g,MgSO4·7H2O 0.5g,FeSO40.01g,CuSO40.5g,MnCl20.5g,Zn-SO40.5g,每处理3次重复,以不加无机盐的基础培养液作为对照,28℃、130r/min振荡培养5d,过滤。
1.5.2 多因素正交试验
以筛选出的最佳碳源、氮源、无机盐为变异因素,采用L18(37)正交表进行培养基基本组成配比优化试验,从中选出发酵液的最佳培养基组合。
1.6 菌株发酵条件的优化
对小麦根腐病菌从初始pH、转速、温度、发酵时间、装液量和接种量等方面进行发酵条件的优化:(1)将发酵液初始pH 分别调至3.0、4.0、5.0、6.0、7.0、8.0、9.0、9.5、10.0、11.0,28 ℃、130r/min振荡培养5d,过滤。(2)将小麦根腐病菌接种于察氏培养 液 中,分 别 放 在 静 置、100、130、150、180、210r/min的条件下,28℃,培养5d,过滤。(3)将发酵培养液分别放置在20、24、28、32、36、40℃的摇床中,130r/min振荡培养5d,过滤。(4)将小麦根腐病菌接种于察氏培养液中,28℃、130r/min振荡培养,分别发酵1、2、3、4、5、6、7、8、9、10d后过滤。(5)在250mL的三角瓶中分别装入40、80、100、120、140、160、180mL发酵培养液,28℃、130r/min振荡培养5d,过滤。(6)取10mL无菌水冲洗平板上的小麦根腐病菌孢子,分别按培养液的0.5%、1%、2%、4%、6%、8%、10%接入到发酵培养基中,28℃、130r/min振荡培养5d,过滤。
1.7 小麦根腐病菌菌株发酵产物理化性质研究
对小麦根腐病菌发酵产物的理化性质主要从以下方面进行研究:
(1)热稳定性测定
试验设两组处理,将培养滤液分别于30、50、70、90、121℃处理30min;将培养滤液在高压灭菌条件下处理30、60、90min。待培养滤液自然冷却后,用种子萌发法检测除草活性。
(2)酸碱稳定性测定
用1.0mol/L HCl和1.0mol/L NaOH 分别将培养滤液 pH 调为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0、14.0,常温下 放置24h后,将pH调回原值,用种子萌发法检测除草活性。
(3)光照稳定性测定
将培养滤液置开盖培养皿内,分别在自然光和40W日光灯(距光源50cm)下照射3、6、12h后以种子萌发法检测活性。
(4)紫外线稳定性
将培养滤液置于15W紫外灯下照射15、30、45、60min后用种子萌发法检测其活性。
2 结果与分析
2.1 初始发酵培养基的筛选
小麦根腐病菌在5种培养液中的培养滤液对马唐种子均有抑制作用(图1),其中小麦根腐病菌在察氏培养液中产生的活性物质对马唐种子的校正抑制率最高,达到86.67%。小麦根腐病菌在其他4种培养液中的培养滤液对马唐种子的校正抑制率都低于80%,并且和察氏培养液具有显著差异,所以察氏培养基是最适合小麦根腐病菌产生活性物质的培养基。
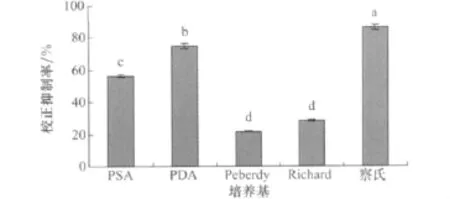
图1 不同培养基对小麦根腐病菌发酵液除草活性的影响
2.2 发酵培养基成分优化
2.2.1 不同碳源、氮源、无机盐对小麦根腐病菌除草活性的影响
添加不同的碳源对小麦根腐病菌除草活性物质的产生有一定的影响(图2),以葡萄糖为碳源时校正抑制率最高,为86.67%。所以葡萄糖为适合小麦根腐病菌产生活性物质的碳源。
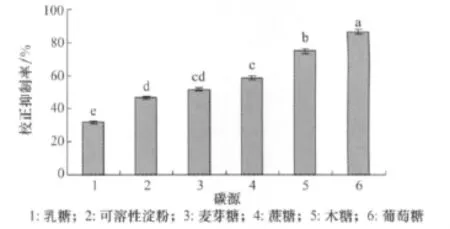
图2 不同碳源对小麦根腐病菌发酵液除草活性的影响
由图3可知,当培养液中添加的氮源为氯化铵时,小麦根腐病菌的发酵液对马唐的校正抑制率达到88.33%,以硝酸铵为氮源时,校正抑制率达到83.33%,处理间差异不显著。
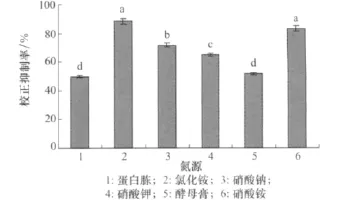
图3 不同氮源对小麦根腐病菌发酵液除草活性的影响
由图4可知添加不同无机盐的培养滤液均具有一定的除草活性,其中培养基中添加KCl、K2HPO4、MgSO4·7H2O、FeSO4校正抑制率分别达到91.67%、90.00%、90.00%、90.00%,处理间差异不显著。
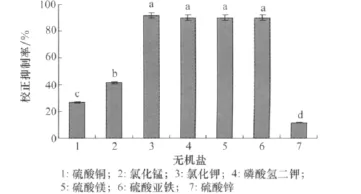
图4 不同无机盐对小麦根腐病菌菌株除草活性的影响
2.2.2 多因素正交试验
以葡萄糖、氯化铵、氯化钾、硫酸镁、磷酸氢二钾和硫酸亚铁为变量,按L18(37)设计7因素3水平正交试验。极差分析结果表明(表1、2、3),不同成分含量影响程度的R值:A>C>F>G>E>B>D,最佳水平组合为A2B2C2D3E3F1G1;方差分析结果表明因素A高度显著,因素C显著,因素B、D、E、F、G不显著,从经济方面考虑,选B1、D1、E1、F1、G1,所以最优水平组合为A2B1C2D1E1F1G1。
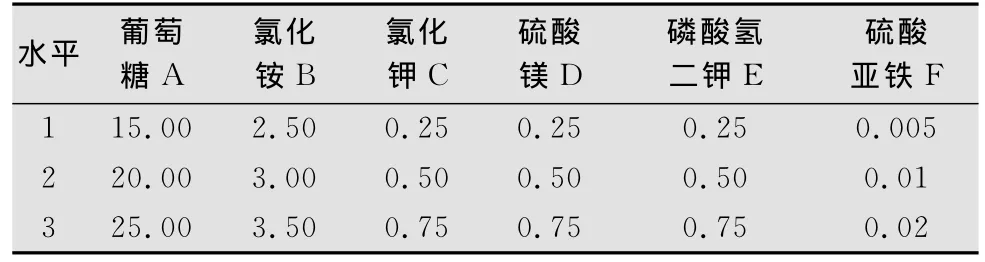
表1 培养基中各营养成分的正交试验因素与水平
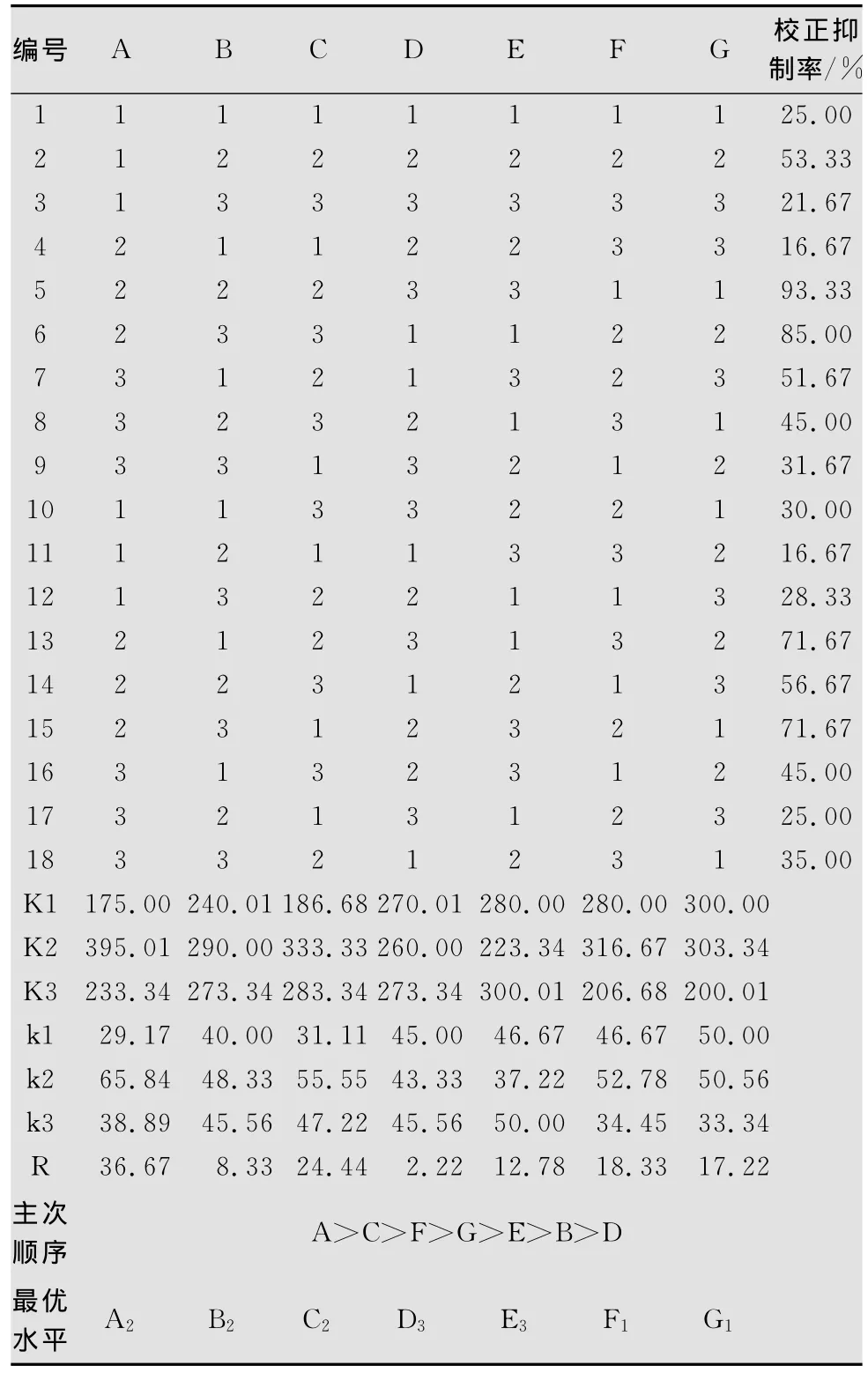
表2 培养基中各营养成分的正交试验结果1)
2.3 不同发酵条件对小麦根腐病菌菌株发酵产物除草活性的影响
由图5可知,小麦根腐病菌在强酸强碱环境下产生除草活性物质的量很少,对马唐种子萌发的校正抑制率低。pH由强酸强碱性向中性变化时,校正抑制率逐渐提高,当初始培养液pH为7时,校正抑制率达到最高为93.33%。

表3 培养基中各营养成分的方差分析结果1)
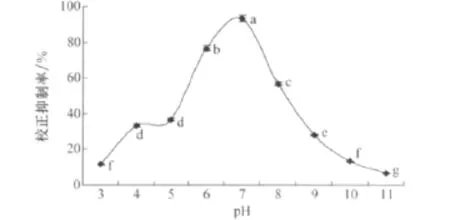
图5 不同初始pH对小麦根腐病菌发酵液除草活性的影响
小麦根腐病菌在静置条件下的发酵液对马唐的校正抑制率最低,在动态培养条件下,随着转速的提高,校正抑制率有所提升,当转速达到130r/min时,校正抑制率最高为93.33%,转速高于130r/min时,校正抑制率下降(图6)。
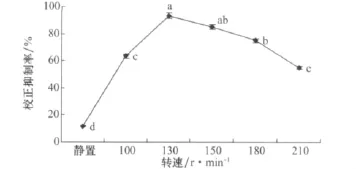
图6 不同转速对小麦根腐病菌发酵液除草活性的影响
由图7可知,随着温度的升高,小麦根腐病菌菌株除草活性物质产量不断增加,28℃时其发酵液对马唐种子萌发的校正抑制率达到95%,当温度高于28℃时,菌丝的生长速度明显下降。
由图8可知,随着培养时间的延长,小麦根腐病菌除草活性物质产量逐渐增加,5d时产量达到高峰,发酵液对马唐种子萌发的校正抑制率达到96.67%,当培养时间超过5d时,菌株的除草活性下降。
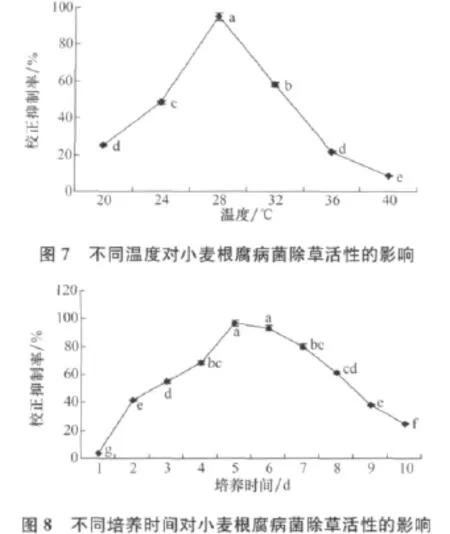
不同装液量对小麦根腐病菌除草活性有一定的影响(图9),装液量为120mL/250mL时,校正抑制率达到最高为93.33%,装液量再增加时,校正抑制率反而下降。
由图10可知,接种量对小麦根腐病菌除草活性物质的产量有一定的影响,随着接种量的增加,培养滤液活性逐渐增强,当接种量为6%时,校正抑制率达到95.00%。
2.4 小麦根腐病菌菌株发酵产物理化性质研究
(1)热稳定性测定
将培养滤液分别于30、50、70、90、121℃处理30min后,培养滤液对马唐种子萌发的抑制率分别为93.33%、95%、93.33%、96.67%、93.33%,但在121℃下处理60、90min后,培养滤液的抑制率下降到80%和68.33%(表4),说明培养滤液中的活性物质对温度有一定的稳定性,但长时间的高温处理,会破坏培养滤液中的活性物质。

表4 小麦根腐病菌菌株培养滤液的热稳定性1)
(2)酸碱稳定性测定
培养滤液在pH5~7的范围内变化时,其对马唐种子的抑制率在90%以上,各处理和对照差异不显著,pH为碱性时,抑制率有所下降,可见培养滤液在弱酸性和中性条件下稳定,在碱性条件下不稳定(图11)。
(3)光照稳定性测定
小麦根腐病菌培养滤液在自然光和日光灯下分别照射,由图12可知不同光照下菌株除草活性没有显著差异,说明该病菌的培养滤液具有很好的光照稳定性。
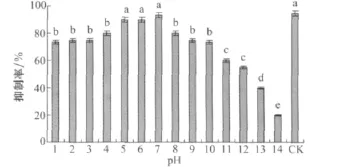
图11 小麦根腐病菌菌株培养滤液的酸碱稳定性
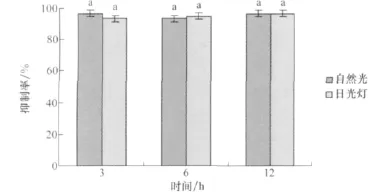
图12 小麦根腐病菌菌株培养滤液的光照稳定性
(4)紫外线稳定性
培养滤液放在紫外灯下分别照射15、30min时,其对马唐种子萌发的抑制率和对照差异不显著,照射45、60min时抑制率下降到80%和78.33%,所以培养滤液在储藏过程中要避免紫外照射(图13)。
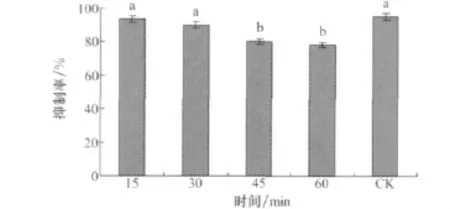
图13 小麦根腐病菌菌株培养滤液的紫外稳定性
3 讨论
微生物能产生很多代谢产物,这些产物中含有杀草活性物质,利用微生物所产生的对植物具有毒性的代谢产物进行杂草防除的除草剂称为微生物源除草剂[7]。第一个开发成功的微生物源除草剂为双丙氨膦,广泛用于防除一年生和多年生禾本科杂草及阔叶杂草。姜述君[8]等从狭卵链格孢菌株AAEC0523中分离到一淡黄色的油状毒素,对稗草的种子萌发和幼苗生长都有较强的抑制作用。谷祖敏[9]等从草茎点霉SYAU-06菌株中提取的毒素对鸭跖草胚根和芽的伸长有较强的抑制作用。
发酵是抗生素产业化的基础,若缺乏合理的发酵工艺,也不能将其潜力充分发挥,抗生素发酵除受营养因素的限制以外,合适的发酵条件也是不可忽视的重要因素[10-11]。为了提高小麦根腐病菌发酵液活性物质的产量,本研究通过单因子试验和正交试验,对其发酵培养基成分及摇床发酵条件进行研究,以期得到最利于产生除草活性物质的发酵条件。本试验得出的最佳碳源为葡萄糖,最适初始pH 7.0。康绍兰等[12]的研究表明,最适合小麦根腐病菌菌株产生活性物质的碳源是淀粉,最适pH为4.0,这可能是因为微生物的次级代谢产物具有菌株特异性,且不同的发酵培养基配方或条件诱导不同的次级代谢产物的产生[13]。本试验对于培养基配方对菌株活性物质产量的影响采用正交设计试验,提高了工作效率和试验结果的可靠性,后续试验可对发酵滤液中的活性物质进行提取,以达到更好的效果。
[1]Li Y Q,Sun Z L,Zhuang X F,et al.Research progress on microbial herbicides[J].Crop Protection,2003,22(2):247-252.
[2]Charudattan R,Dinoor A.Biological control of weeds using plant pathogens:accomplishments and limitations[J].Crop Protection,2000,19(8-10):691-695.
[3]强胜,郭爱民,李扬汉.大批量生产百日草链格孢菌孢子的技术[J].中国生物防治,1997,13(4):169-172.
[4]张金林,董金皋,樊慕贞,等.葱叶枯病菌Stemphylium botryosum 毒素的分离与除草活性研究[J].农药学学报,2001,3(2):60-66.
[5]郑蒙,徐扩,董金皋.灰葡萄孢BC7-3菌株除草活性组分的纯化与结构鉴定[J].微生物学报,2008,48(10):1362-1366.
[6]Zhang J L,Zhang L H,Liu Y C,et al.The herbicidal activity of mutant isolates from Botrytis cinerea[J].Agricultural Sciences in China,2006,5(8):622-628.
[7]孙巍,张蕾,吴迪,等.微生物除草剂的研究进展与展望[J].微生物学杂志,2006,26(2):88-91.
[8]姜述君,范文艳,鞠世杰,等.狭卵链格孢菌株AAEC0523及毒素对稗草的致病性[J].植物保护学报,2007,34(3):283-288.
[9]谷祖敏,纪明山,张杨,等.草茎点酶粗毒素的除草活性和杀草谱研究[J].沈阳农业大学学报,2009,40(4):431-434.
[10]魏松红,付丹妮,逄若霖,等.除草活性放线菌DN5发酵条件及发酵产物理化性质的研究[J].中国生物防治学报,2011,27(2):246-253.
[11]Saudagar P S,Singhal R S.Optimization of nutritional requirements and feeding strategies for clavulanic acid production by Streptomyces clavuligerus[J].Bioresource Technology,2006,98(10):2010-2017.
[12]康绍兰,刘国胜,董金皋,等.几种植物病原真菌致病毒素的初步研究(I)[J].河北农业大学学报,1995,18(4):105-111.
[13]王智文,刘训理,何亮,等.Cp-S316菌株发酵培养基的优化及其对烟草赤星病菌的抑制作用[J].农业环境科学学报,2007,26(2):723-728.

