柠檬苗期一种新病害的病原鉴定及防治药剂的室内筛选
王自然, 郭 俊, 周东果, 李进学, 李 晶, 杨石早, 高俊燕
(云南省农业科学院热带亚热带经济作物研究所,德宏 678600)
柠檬[Citruslimon(Linn.)Burm.f.]为芸香科柑橘属枸橼类常绿果树。柠檬栽培主要分布在热带和亚热带国家和地区。中国是柠檬栽培的起源地之一,栽培历史已有1 000余年[1],分布在中国台湾、四川、云南、重庆、广东、广西、福建、浙江等地。柠檬营养丰富,富含维生素C、维生素H、维生素E和K、P、Ca、Mg等多种矿物质及微量元素,鲜果可直接沏水饮用,又可用于加工柠檬汁、柠檬油以及橙皮苷、果胶等[2]。近年来,随着人民生活水平的提高以及对柠檬的逐步认识,柠檬已成为深受消费者欢迎的果品,鲜果和加工品供不应求。
2010年,云南瑞丽柠檬产区柠檬苗出现了一种新的病害,严重影响了柠檬种苗的健康生产。该病害主要危害柠檬苗的嫩叶、嫩茎和嫩梢,有时也危害已老熟的叶片和枝梢。主要表现为茎腐、叶斑及枝梢枯等,生产上易误认为急性炭疽病和苗木茎枯病。据调查发现,高温高湿的气候条件非常有利于该病的发生和扩散,并且该病的发生和危害给云南瑞丽柠檬苗的繁育工作造成了较大的损失。笔者采集柠檬苗病株,进行病原菌的分离和鉴定工作,并进行室内杀菌剂的筛选,以期明确引起该病害的病原菌,为该病害的防治提供科学依据。
1 材料和方法
1.1 材料
1.1.1 病原菌分离鉴定材料
2010年6月从瑞丽市柠檬育苗基地采集带病的叶片和茎秆作为病原菌分离鉴定材料。病原菌的分离鉴定,以及室内杀菌剂筛选均在云南农业大学植物病理重点实验室进行。
1.1.2 供试药剂
共7种杀菌剂:64%噁霜·锰锌可湿性粉剂(先正达投资有限公司上海分公司)、72%锰锌·霜脲可湿性粉剂(美国杜邦公司)、68%精甲霜·锰锌水分散粒剂(先正达投资有限公司上海分公司)、50%烯酰吗啉可湿性粉剂(德国巴斯夫)、68.75%氟吡菌胺·霜霉威悬浮剂(德国拜耳作物科学公司)、80%代森锰锌可湿性粉剂(南通德斯益农化有限公司)、77%硫酸铜可湿性粉剂(西班牙艾克威化学有限公司)。
1.2 方法
1.2.1 育苗地环境条件及柠檬苗疫病的田间症状观察
发病的柠檬育种基地处于德宏州瑞丽市帮孔,瑞丽市属典型的南亚热带气候类型,海拔980m,年平均气温20.5℃,日照时数2 326h,有效积温7 291℃,全年降雨量1 400mm左右。该基地地势低洼,在多雨季节易出现积水。2010年6月,分3次对柠檬苗地的发病情况观察,记录发病症状,发病率。
1.2.2 病原菌的分离和培养
用自来水冲洗罹病组织后,将病组织表面的水分晾干,从病健交界处切取约5mm×5mm的小块(分别取病叶和茎),经75%乙醇、升汞依次消毒,再用灭菌水漂洗多次后,移入加抗生素的燕麦培养基上,分别放入18℃和28℃黑暗培养箱中培养。从新长出菌落边缘挑取菌丝移入新制备的培养基中进行纯培养。
1.2.3 不同营养条件的培养基筛选
黑麦-番茄汁培养基、燕麦培养基和水琼脂培养基的制备,参见杨艳丽等[3]培养基的制备方法。
柠檬叶-琼脂培养基制备:采集健康无污染、无农药残留的柠檬叶片,将叶片剪成长5mm左右的方形小块,放在70℃的干燥箱中1~2h,直至叶片烘脆,再用紫外线灭菌法灭菌30min。把灭菌的叶片放在灭菌的培养皿中,然后倒入灭菌并冷却至50℃的琼脂培养基,制成柠檬叶-琼脂培养基。
1.2.4 致病性测定
取健康的柠檬苗叶片,用清水洗净,并用75%乙醇消毒表面后,分别进行刺伤与无刺伤2种接种处理,将供试菌株配成孢子囊浓度为4×103个/mL的孢子囊悬浮液,取25μL分别接种于叶背和叶片正面,以接种灭菌水的叶片为对照。在室温(28~32℃)下保湿培养4d,记录发病情况。
1.2.5 病原菌鉴定
观察菌落生长情况,显微镜检查孢囊梗、孢子囊的形态,测定孢子囊大小,乳突大小,观察孢子囊脱落特征等特性,依据有关文献[4-7]描述的形态特征及寄主范围,对分离纯化得到的菌株进行鉴定。
1.2.6 杀菌剂室内毒力筛选
采用菌丝生长速率法测定。在无菌操作条件下,将供试的7种药剂分别设置4个稀释浓度。稀释倍数分别设为600、800、1 000倍液和1 500倍液。用灭菌水将供试药剂稀释成试验所需浓度的母液,分别取200μL加到燕麦培养基中摊平。用无菌接种针将菌丝挑到含药培养基中央。设加灭菌水的燕麦培养基为空白对照。7种药剂和空白对照共29个处理,每个处理设3个重复。放于28℃下培养3d,用“十字交叉法”测量供试菌株在含不同药剂的培养基上的菌落直径,与对照进行比较,计算药剂处理的菌丝扩展的生长抑制率:
生长抑制率(%)=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100;
用抑制生长百分率换算成几率值,浓度转换成浓度对数。以浓度对数为自变量x,以几率值为变量y,并通过求出浓度与抑菌率间回归系数b,相关系数R和常数项a,建立毒力回归方程y=a+bx,从毒力回归方程分别求出每个药剂的抑制中浓度EC50。
2 结果与分析
2.1 症状描述
柠檬苗期疫病主要发生在柠檬苗的嫩叶、嫩茎和嫩梢,有时危害老熟的叶片和枝梢。主要表现为叶斑和枝梢枯。柠檬苗疫病大部分是从顶梢或茎中部先感染发病,后由上往下扩展或从叶尖、叶缘向内发展,也有部分叶片在中间产生病斑,向周围扩展。叶片受害初期时出现水渍状病斑,随后迅速扩展成近圆形或不规则形病斑,如开水烫伤状,颜色也迅速转变为浅褐色至褐色。阴雨潮湿时,病斑扩展极快,病斑面积占叶片面积的20%~80%,2~4d植株的感病叶片全部落光。病斑可扩展至嫩梢基部,使整个新梢或整株幼苗变深褐色枯死,气候湿润时茎腐烂。柠檬苗圃的发病率一般为5%~20%,有的达40%~60%,气候适宜时甚至高达90%以上,见图1。

图1 柠檬植株、叶片发病症状
2.2 培养基筛选结果
黑麦-番茄汁培养基、燕麦培养基、水琼脂培养基和柠檬叶片-琼脂培养基等4种培养方式中,燕麦培养基上的气生菌丝长度中等,无孢子囊和厚垣孢子产生;黑麦-番茄汁培养基上的菌丝较长,有少量孢子囊和厚垣孢子产生;柠檬叶片-琼脂培养基上菌丝生长稍慢,有孢子囊和厚垣孢子生成;水琼脂培养基上则菌丝生长较慢或几乎不生长。在4种培养基上菌丝的生长速度依次为:燕麦培养基>黑麦-番茄汁培养基>柠檬叶片-琼脂培养基>水琼脂培养基。
2.3 病原菌的培养性状及孢子形态特征
从采集的柠檬苗上分离得到23个菌株,其中,叶片上分离得到13个,茎上分离得到10个,这23个菌株的菌落形态和菌丝较一致。在燕麦培养基上,病菌的菌落呈放射状,气生菌丝较少或中等,边缘明显。显微镜下观察,病菌的菌丝无色,无隔膜,菌丝形态简单,单轴分枝或不分枝,菌丝较细,少数菌丝成不规则膨大。菌丝生长最低温度为16℃,18℃培养菌丝生长较缓慢,24℃~28℃为最适温度,28℃下培养菌丝第5天就可以长满直径为90mm的培养皿,菌丝生长最高温度可达30℃。
挑取在燕麦培养基上培养的菌丝,用灭菌水漂洗4次,再用浅水培养,第3天在显微镜下观察(见图2)。孢囊梗简单合轴分枝或不分枝,孢子囊无色,单孢。孢子囊变异很大,球形、卵形、椭圆形、倒梨形或不规则形,倒梨形孢子囊形态较多。乳突明显,常为单乳突,有时为双乳突,乳突高2.9~6.6μm;孢子囊基部圆形,长×宽为24.6~49.7μm×17.6~33.8μm,平均33.6×23.9μm,长宽比为1.1~1.7;孢子囊脱落,具短柄,孢子囊萌发产生芽管,或产生游动孢子,游动孢子较活跃。厚垣孢子大量产生,球形,顶生或间生。使用上述4种培养基以及菌丝体浅水培养,均未见藏卵器产生。
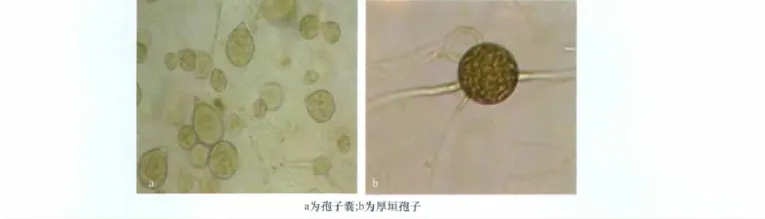
图2 孢子形态特征
2.4 病原菌鉴定结果
根据病原菌的菌落生长特征和形态特征、孢囊梗、孢子囊形状和大小、厚垣孢子以及寄主范围,参照有关病原菌分类文献[4-7],鉴定该病原菌为鞭毛菌亚门,卵菌纲,霜霉目,疫霉科,疫霉属,棕榈疫霉[Phytophthorapalmivora(Butler)Butler]。
2.5 致病性测定结果
结果显示,柠檬嫩叶刺伤和无刺伤2种处理发病率均达100%;成熟叶片刺伤发病,无刺伤不发病,症状表现和田间发病植株相一致,而对照不发病。从接种发病的组织中重新分离的病原菌,与接种的病原菌完全一致,表明分离获得的病菌为该病的病原菌。
2.6 防治药剂的筛选
用生长速率法测定结果(见表1)表明,50%烯酰吗啉可湿性粉剂、68.75%氟吡菌胺·霜霉威悬浮剂和68%精甲霜·锰锌水分散粒剂这3种药剂对菌丝生长抑制效果最好。3种药剂间差异不显著,而与其他几种药剂则存在显著性差异。50%烯酰吗啉可湿性粉剂和68.75%氟吡菌胺·霜霉威悬浮剂600、800倍液,68%精甲霜·锰锌水分散粒剂600倍液抑菌效果较好,抑菌率均达到90%以上;50%烯酰吗啉可湿性粉剂和68.75%氟吡菌胺·霜霉威悬浮剂1 000、1 500倍液,68%精甲霜·锰锌水分散粒剂800、1 000倍液抑菌率达到80%以上。64%噁霜·锰锌可湿性粉剂和80%代森锰锌可湿性粉剂抑菌效果次之,72%锰锌·霜脲可湿性粉剂抑菌效果较差,77%硫酸铜可湿性粉剂则几乎没有抑菌作用。
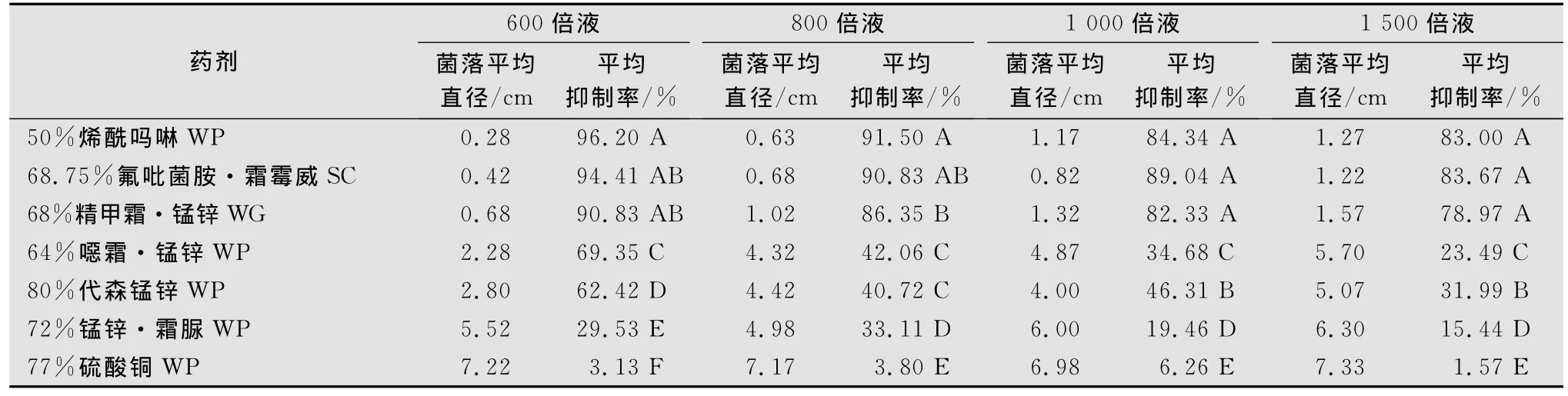
表1 不同药剂对棕榈疫霉菌菌丝的抑制作用1)
2.7 4种药剂的毒力及EC50
室内毒力测定结果(表2)表明,68%精甲霜·锰锌水分散粒剂、68.75%氟吡菌胺·霜霉威悬浮剂、50%烯酰吗啉可湿性粉剂和64%噁霜·锰锌可湿性粉剂的有效中浓度(EC50)分别为121.372、133.392、133.833mg/L和814.071mg/L,其中68%精甲霜·锰锌水分散粒剂有效中浓度最低,相对抑制效果最好;68.75%氟吡菌胺·霜霉威悬浮剂和50%烯酰吗啉可湿性粉剂次之;64%噁霜·锰锌可湿性粉剂最差。4种药剂的相关系数均在0.92以上,表明药剂浓度与抑制作用呈现较高的相关性。

表2 毒力回归方程及EC50
3 讨论
3.1 病原菌的分离和鉴定
本研究从柠檬苗病叶和病茎组织上获得菌落形态特征较为一致的菌株,经过对病原菌培养形状、孢囊梗形态及孢子囊大小、厚垣孢子着生情况,以及寄主范围等,鉴定该病原菌为棕榈疫霉(P.palmivora),是引起柠檬苗发病的主要病原。该病菌大量产生厚垣孢子,厚垣孢子是许多植物疫病的重要初侵染源,在合适的条件下萌发侵入寄主[8]。据报道,全世界柑橘疫霉病约12种[9],但不同国家,不同地区,不同寄主,疫霉种不同[10-16]。广东省柑橘上发现疫霉病菌有6种[17],有柑橘褐腐疫霉(Phytophthora citrophthora)、烟草疫霉(P.nicotianae)、棕榈疫霉(P.palmivora)、辣椒疫霉(P.capsici)、掘氏疫霉(P.drechsleri)和柑橘生疫霉(P.citricola)。目前,柑橘苗期疫病已报道的有柑橘褐腐疫霉和烟草疫霉[18]。瑞丽市柚子果疫病为柑橘褐腐疫病[19]。南美洲智利等国家报道[20]在柠檬和甜橙上分离到柑橘褐腐疫霉、寄生疫霉(P.parasitica)和P.inundata等3种疫病病原菌。柑橘褐腐疫霉主要发生在果实上,表现为果实褐腐。美国佛罗里达报道了柠檬上有烟草疫霉和柑橘褐腐疫霉的存在[21]。而柠檬棕榈疫霉尚未见报道。所以柠檬上的棕榈疫霉菌应该得到广泛的重视。
3.2 苗地的选择及管理
棕榈疫霉的寄主范围较广[9],主要寄主为凤梨、韭、木瓜、咖啡、橡胶树、胡椒、芋、番木瓜、柑橘、枇杷、无花果、短筒倒挂金钟、芒果、泡桐属、鳄梨、蝶兰属、洋蒲桃、酸枣以及土壤等。棕榈疫霉危害植物后残留在土壤的病残体或者周边植株,在气候适宜时对柠檬的种植带来危害。因此,在选择柠檬育苗基地时,应尽量避免周围种植有棕榈疫霉菌的寄主植物,防止该菌的侵染对柠檬产业带来严重危害。根据调查发现,柠檬上棕榈疫霉病多发生在用土杂肥覆盖的苗圃中,从发病时间看,苗疫病主要发生在夏梢抽发期,6-8月高温高湿,雨水多的天气发病重,冬秋干旱季节未见发病。育苗地应选择地势较高,排灌方便,土质疏松的地段,避免在地势低洼易积水的地方育苗。若用温床育苗,苗床最好在播种前用土壤消毒剂进行消毒。
3.3 药剂防治研究
目前,市场上防治疫病的杀菌剂主要针对马铃薯晚疫病、番茄疫病、辣椒疫病和烟草黑胫病等,疫霉病病菌适应性强,许多药剂使用后很快产生抗药性。因此,有必要筛选针对棕榈疫霉的有效防治药剂,提出正确的使用方法和防治适期,进行病害的有效控制。本研究选用7种防治疫病的选择性杀菌剂和广谱性杀菌剂进行室内抑菌试验。室内筛选结果表明,不同药剂间抑菌作用有明显差异。68%精甲霜·锰锌水分散粒剂、50%烯酰吗啉可湿性粉剂和68.75%氟吡菌胺·霜霉威悬浮剂对棕榈疫霉菌菌丝的生长有较强的抑制作用,其次为64%噁霜·锰锌可湿性粉剂和80%代森锰锌可湿性粉剂,77%硫酸铜可湿性粉剂几乎没抑制作用。68%精甲霜·锰锌水分散粒剂、50%烯酰吗啉可湿性粉剂和68.75%氟吡菌胺·霜霉威悬浮剂3种杀菌剂可以轮换使用来防治棕榈疫霉,以避免抗药性的产生。本试验的室内药剂筛选结果为田间药剂防治提供了理论依据。在用于大田防治过程中还有待于进一步田间试验。
[1]岳建强,杨恩聪.优质柠檬早结丰产栽培新技术[M].昆明:云南科技出版社,2009:1-7.
[2]周齐铭,彭长江,计长远.柠檬栽培技术[M].成都:四川科学技术出版社,2005:5-18.
[3]杨绪旺,罗文富,杨艳丽.马铃薯晚疫病菌卵孢子菌系的繁育及生物学特 性 研 究 [J].云 南 农 业 大 学 学 报,2005,20(4):500-504.
[4]余永年.中国真菌志霜霉目[M].北京:科学出版社,1998:139-191.
[5]Newhook F J,Waterhouse G M,Stamps D J.Tabular key to the species ofPhytophthorade Bary[J].Mycological Papers,1978(143):1-20.
[6]Ho H H.Synoptic keys to the species ofPhytophthora[J].Mycologia,1981,73(4):705-714.
[7]Ho H H,Ann P J,Chang H S.The genusPhytophthorain Taiwan[M].Taipei:Institute of Botany,Academia Sinica,1995:1-70.
[8]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997:22-29.
[9]余永年,庄文颖,李金亮.柑橘疫霉[J].真菌学报,1986(S1):31-39.
[10]戴芳澜.中国真菌总汇[M].北京:科学出版社,1979:34-39.
[11]姜子德,戚佩坤,陈永强,等.柑橘生疫霉引起的月季疫病的研究[J].植物病理学报,2005,30(2):181-185.
[12]Ann P J.Species,mating types and pathogenicity ofPhytophthoradistributed in citrus orchards in Taiwan[J].Tree Br Mycol,1984,82:631-634.
[13]张镜,黄治远,欧阳秩.四川柑橘根腐病病原菌真菌种类研究[J].植物病理学报,1993,24(3):259-263.
[14]先宗良,邓大林,兰庆渝.柑橘脚腐病病原菌的分离与鉴定[J].植物保护学报,1992,19(2):186-192.
[15]张开明,黎乙东,郑服丛.海南湛江柑橘疫霉种的鉴定及交配型研究[J].植物病理学报,1993,23(2):179-184.
[16]刘景晶,殷恭毅.江苏吴县东方红橘3种疫病病菌的生物学研究[J].南京农业大学学报,1994,17(1):121-123.
[17]成家壮,韦小燕,范怀忠.广东柑橘疫病研究[J].华南农业大学学报(自然科学版),2004,25(2):31-33.
[18]成家壮,韦小燕,黄玉梅.广州地区柑桔苗疫病的发生及药剂防治试验[J].中国柑桔,1989,18(1):37-38.
[19]张培花,高俊燕,岳建强,等.瑞丽市柚子果疫病的发生及其病原鉴定[J].云南农业大学学报,2009,24(3):465-469.
[20]Vial A,Latorre B A,Ortúzar J.Characterization ofPhytophthoracitrophthoraandP.inundataassociated tofoot and root rot of citrus trees in Chile[J].Cien Inv Agr,2006,33(3):173-184.
[21]GrahaMJ H,Timmer L W.Phytophthoradiseases of citrus[R].University of Florida,SL 127.1994:1-11.

