广东地区鱼源大肠埃希菌ESBLs和PMQR流行分布调查
汤 电,张小华,付晓平,王丽华,郭玉芳,李 健,纪雪薇,蒋红霞
(华南农业大学兽医学院,广东省兽药研制与安全评价重点实验室,广东广州510642)
大肠埃希菌Escherichia coli是人类和动物最常 见的条件性致病菌和肠道共生菌,在耐药性传播过程中,充当重要的抗生素耐药基因储存库.耐药菌株的耐药基因可在不同种属细菌间传播,导致细菌耐药性扩散[1],影响临床使用抗菌药的疗效.食品动物大肠埃希菌可以通过食物链将耐药基因传播给人类[2].β-内酰胺类和氟喹诺酮类是临床上最常用的2类重要抗菌药物,目前无论兽医临床还是医院分离的大肠埃希菌对这两类抗菌药的耐药性非常严重,而且耐药机制也发展变化很快.
近几年来肠杆菌科细菌对超广谱头孢菌素类的耐药性迅速增加,主要是产生了由质粒介导的、能水解这类药物的β-内酰胺环的灭活酶,这些酶中,动物源细菌中最常检出的是超广谱β-内酰胺酶(extended spectrum β-lactamases,ESBLs)和 AmpC 型 β-内酰胺酶,其中 ESBLs中最常见的是 CTX-M型酶[3-4].自1998年首次鉴定出质粒介导的、可以水平传播的喹诺酮类药物耐药基因qnr[5]以来,质粒介导喹诺酮类耐药(Plasmid mediated quinolone resistance,PMQR)成为细菌耐药机制研究的热点.PMQR是质粒介导的喹诺酮类药物低水平耐药基因,但当存在喹诺酮类压力时能促使细菌产生高水平耐药性.此类耐药基因包括 qnrA、qnrB、qnrS、qepA、qnrD、qnrC和aac(6')-Ib-cr,其流行分布因地区而异,但总体而言以qnrA、qnrB和aac(6')-Ib-cr最为多见.这些基因常与ESBLs基因同时位于接合质粒上[6-7].
动物的胃肠道被看作是产ESBLs、AmpC酶细菌和PMQR携带菌的重要储库,是人类细菌捕获这些耐药基因的潜在来源.这些耐药菌可以经水平传播方式或者随食物链传递给人类病原体,对公共卫生和人类健康造成威胁[8-9].目前国内外大量研究报道了产ESBLs和AmpC酶大肠埃希菌在动物中频繁被检出,包括食品动物、宠物及野生动物[10],也有关于食品动物PMQR的报道[11],仅有少数关于养殖水环境中革兰阴性菌和鱼源大肠埃希菌耐药基因的报道[12-13].广东省是我国水产养殖大省,目前水产养殖业病原菌耐药状况尚不清楚.本研究调查了广东地区鱼源大肠埃希菌耐药状况、ESBLs和PMQR流行分布以及相关耐药基因的水平传播机制,为阐明我国水体菌群和水生动物源细菌耐药状况、评价水产养殖中使用抗生素风险提供理论依据.
1 材料与方法
1.1 菌株
2010年5—8月从广州城区及周边县市15个农贸市场或超市采集各类食用鱼肠道样本,所采集鱼的种类包括草鱼、罗非鱼、鲫鱼、鲢鱼、鲶鱼,在同一农贸市场每种鱼采集1~2个样品,共收集样品297份.在无菌条件下取肠道内容物(食糜、粪便或粘液)接种于麦康凯琼脂培养基,37℃过夜培养.每份样品挑取1个具有大肠埃希菌典型形态的单菌落接种至LB液体培养基进行纯培养,用肠杆菌科生化鉴定试剂盒进行鉴定,共分离鉴定出218株大肠埃希菌.药敏试验质控菌株为大肠埃希菌ATCC25922,CTX-M-G1、-G2、-G8、-G9、-G25 产酶 菌株 (阳性 对照)由英国伯明翰大学 Peter Hawkey教授惠赠,qnrB、qnrD、qnrS、qepA 和 aac(6')-Ib-cr阳性株和接合转移试验受体菌大肠埃希菌C600为广东省兽药研制与安全评价重点实验室保存菌株.
1.2 药敏试验
参照CLSI(2010版)指导原则和执行标准,用琼脂二倍稀释法,测定218株大肠埃希菌对17种常用抗菌药物的敏感性.测定的药物包括:氨苄西林、头孢噻呋、头孢噻肟、庆大霉素、卡那霉素、大观霉素、氯霉素、氟苯尼考、四环素、多西环素、磺胺甲恶唑/甲氧苄啶、萘啶酸、左氧氟沙星、环丙沙星、恩诺沙星、乙酰甲喹和喹乙醇,均购自中国药品生物制品检定所.用二倍稀释法把各种药物稀释到所需各个浓度梯度,分别定量加入高压灭菌过的MH琼脂在平皿中混合均匀,冷却凝固,制成含所需药物浓度的琼脂平板.把稀释至含菌量约为1.0×106CFU/mL的菌液用微量多点接种仪接种到MH琼脂平板上,37℃倒置培养16~18 h后观察结果.以完全不见细菌生长的最低药物浓度为该药物对细菌的最小抑菌浓度(Minimal inhibitory concentration,MIC).
1.3 ESBLs及PMQR基因的检测
根据MIC结果挑选耐氨苄西林(MIC≥32 μg·mL-1)菌 株,分 别 扩 增 blaCTX-M-G1、blaCTX-M-G2、blaCTX-M-G8、blaCTX-M-G9、blaCTX-M-G25、blaTEM、blaSHV和 blaOXA基因 . 对于CTX-M型ESBLs基因的检测,先用通用引物扩增,再挑选CTX-M阳性菌株用特异性引物分别扩增blaCTX-M-G1、blaCTX-M-G2、blaCTX-M-G8、blaCTX-M-G9和 blaCTX-M-G25.挑选耐环丙沙星(MIC≥4 μg·mL-1)菌株用于扩增PMQR 基因 qnrB、qnrD、qnrS、qepA 和 aac(6')-Ib-cr,PCR所用引物和反应条件见表1.
1.4 PCR产物的测序和分析
将PCR产物与 pMD18-T载体连接,转化至DH5α感受态细胞,用含氨苄西林的LB琼脂培养基筛选阳性克隆,送上海英骏生物技术有限公司测序,测序结果提交NCBI进行比对分析确认,并分析其基因亚型.
1.5 接合转移试验
根据PCR检测结果,挑选10株β-内酰胺酶(包括ESBLs)和/或PMQR阳性菌株(供体菌)作为代表,大肠埃希菌C600为受体菌,采用肉汤接合法进行接合转移试验.具体步骤:将供体菌和受体菌接种于麦康凯琼脂培养基37℃过夜培养,挑取单菌落接种于LB液体培养基37℃恒温震荡培养至生长对数期(菌液浓度达到约108CFU·mL-1).将二者按照供体菌∶受体菌=1∶4的体积比混合静置培养4~6 h,均匀涂布于含一定浓度链霉素/头孢噻肟的联合药物平板37℃过夜培养.挑取疑似接合子菌落进行ESBLs和PMQR基因PCR鉴定,并用肠杆菌染色体基因间重复共有序列PCR(ERIC-PCR)进行确认,同时对接合子进行药物敏感性测定.

表1 PCR引物序列及反应条件Tab.1 Primers and reaction parameters used in PCR
2 结果
2.1 218株鱼源大肠埃希菌耐药状况
药敏试验结果显示,218株鱼源大肠埃希菌对不同药物的耐药性存在较大的差异.其中对氟苯尼考耐药最严重,耐药率达72.5%,其次为氨苄西林,耐药率为51.4%;对喹诺酮类药物耐药率在31.7%~41.7%之间;对复方新诺明和四环素的耐药率为40%左右;对喹恶晽类药物喹乙醇和乙酰甲喹也呈现一定的耐药性,耐药率分别为32.6%和19.7%;大部分菌株对头孢噻呋和头孢噻肟都比较敏感,所有菌株对二者的耐药率分别为4.6%和0.5%(图1).

图1 218株鱼源大肠埃希菌对17种抗菌药物的耐药率Fig.1 Resistent rates of 218 fish origin E.coli to 17 antibiotics
2.2 ESBLs和PMQR耐药基因检测
筛选的112株耐氨苄西林菌株,经PCR扩增,有17株为β-内酰胺酶基因阳性.其中2株为CTX-M型,经基因分型分别确定为CTX-M-79和CTX-M-14;10株为 TEM型,其中3株为 TEM-1,其他7株均为 TEM-1b,TEM-1和 TEM-1b编码基因序列仅有3个核苷酸的差异,二者都是广谱β-内酰胺酶,但不属于ESBLs;5株为SHV型,包括2株 SHV-11,SHV-1、SHV-26、SHV-27 各 1 株.另有2株用blaSHV引物扩增得到阳性片段,但经序列比对分析,分别确定为LEN-4和LEN-17.筛选的80株环丙沙星耐药菌株中,PMQR基因阳性菌有59株,检出率为73.8%.其中包括33株(15.1%)qnrB,5株(2.3%)qnrD,21 株(9.6%)qnrS,6 株(2.8%)aac(6')-Ib-cr,没有检测到 qnrA、qnrC 和qepA(表2).在17株β-内酰胺酶基因阳性菌株中,共检测出2株大肠埃希菌携带ESBLs,其中1株同时携带ESBLs和PMQR基因.有5株大肠埃希菌同时携带β-内酰胺酶基因和PMQR基因(表3).

表2 218株鱼源大肠埃希菌中β-内酰胺酶和PMQR的流行调查Tab.2 Prevalence of β -lactamases and PMQR encoding genes among 218 fish origin E.coli

表3 供体菌及接合子基因表型与耐药表型1)Tab.3 Genotype and phenotype of donors and transconjugants
2.3 接合转移试验结果
在10株受试菌中,有6株成功获得接合子(表3). 分别用 blaCTX-M-G1、blaCTX-M-G9、blaSHV、blaTEM、qnrB、qnrD、qnrS和aac(6')-Ib-cr基因引物对接合子进行扩增,2株blaCTX-M型、5株blaTEM型、2株 qnrS型基因菌株均得到目的片段大小条带(图2),经ERIC-PCR鉴定,均与受体菌电泳图谱相似(图3).接合子MIC结果显示,其中有2株(F161和F203)发生了头孢类耐药表型转移,2株(F68和F161)喹诺酮类耐药表型转移(表3).

图2 6 株接合子中 blaCTX-M-79、blaCTX-M-14、blaTEM-1/1b及 qnrS 基因的PCR产物电泳图Fig.2 Agarose gelelectrophoresis ofPCR productsof blaCTX-M-79,blaCTX-M-14,blaTEM-1/1band qnrS among 6 transconjugants
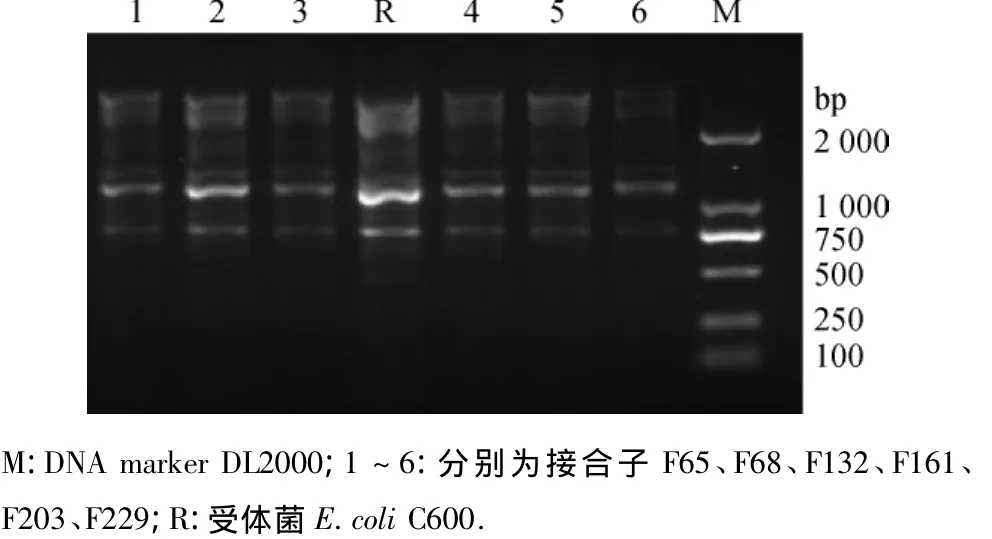
图3 6株接合子及受体菌C600的ERIC-PCR产物电泳图Fig.3 Agarose gel electrophoresis of ERIC-PCR among 6 transconjugants and the recipient C600
3 讨论
据联合国粮农组织(FAO)数据显示,近10年来我国水产养殖量占全球的2/3左右,产值占全球水产养殖产值的1/2以上,我国是世界上最大的水产养殖国.然而国内外很少有关于鱼源大肠埃希菌耐药状况及ESBLs和PMQR的相关研究.本研究从广州15个鱼市或超市收集的鱼肠中分离了218株大肠埃希菌,调查对17中常用抗菌药物的敏感性,结果表明218株大肠埃希菌对氨苄西林、氟苯尼考、磺胺类等抗菌药物的耐药性比较严重,对喹诺酮类耐药率也比较高.我国生产的渔药多达500多种,在水产养殖中常用的抗菌药包括天然抗生素和磺胺类、喹诺酮类等人工合成抗菌药,常以拌料投喂、泼洒等方法来预防或治疗鱼类细菌性疾病[14].本研究结果表明,水产养殖过程中长期大量用药与高水平耐药性密切相关.
ESBLs和PMQR耐药编码基因可随食品动物源大肠埃希菌经食物链传播给人,对人类健康造成威胁[15],目前世界各地关于畜禽(包括猪、牛、禽类和宠物)源大肠埃希菌产ESBLs的报道很多,并且近年来以CTX-M型流行分布最为广泛[16].CTX-M型ESBLs在世界各地的流行分布存在差异,欧洲国家主要流行CTX-M-15,南美地区主要类型为CTX-M-2和CTX-M-9[17],韩国以 CTX-M-14 型和 CTX-M-15 型分布最为广泛[18].有研究报道CTX-M-14是我国和日本流行的主要类型[19-21].本研究在2株鱼源大肠埃希菌中也分别检测出CTX-M-14和CTX-M-79产酶株.说明CTX-M-14已在人群、动物及水环境中传播扩散.CTX-M-79由Tian等[22]在中国首次报道从病人分离到的大肠埃希菌中检测到,随后Thomas等[23]在美国牛源大肠埃希菌中也检测到了blaCTX-M-79.我们于2009年从猪、鸡、鸭、宠物分离的大肠埃希菌中也检测出blaCTX-M-79(数据未发表),说明该基因已在动物源大肠埃希菌中普遍流行.Chang等[24]在2001年首次报道了从医院分离的肺炎克雷伯菌中检测到SHV-26,2009年有人从动物产品奶酪分离的肠杆菌中检测到了 SHV-26[25],其由 SHV-1发生了187Ala→Thr取代突变而来,该突变与SHV-26对克拉维酸的水解活性有关.SHV-27是由巴西 Corkil等[26]在2001年从医院临床分离的肺炎克雷伯菌中发现的一种SHV型酶.本研究调查中也发现了产SHV-26和产SHV-27菌株各1株.关于LEN型β-内酰胺酶,过去只在肺炎克雷伯菌中检测到blaLEN,而且认为该基因存在于染色体上,但随后发现一株肺炎克雷伯菌的质粒上携带LEN-5.而且Sheng等[27]从病人分离的葡萄球菌检测到了LEN-17,说明LEN的宿主在不断扩大,并且也可以由质粒编码.本研究在2株鱼源大肠埃希菌中也检测到 blaLEN基因,分别为blaLEN-4和blaLEN-17,其他相关研究还在进行中.
国内外关于检测食品动物(包括禽、猪)和宠物源大肠埃希菌PMQR基因的报道也较多,其中常见的有 qnrB、qnrD、qnrS 和 aac(6')-Ib-cr[28-29]. 德国和土耳其分别报道从鸡分离到沙门菌中检测到qnrS[30-31],日本和韩国分别从动物园动物和医院分离到的革兰阴性菌中检测到了 qnrB、qnrS和 aac(6')-Ib-cr[32-33]. 本研究中 qnrB、qnrD、qnrS、aac(6')-Ib-cr 4种基因的检出率分别为15.1%、2.3%、9.6%、2.8%,与动物源大肠埃希菌相关报道结果相似,qnrB和qnrS是较普遍流行的基因型.2008年首次在病人分离的沙门菌中鉴定出qnrD[34],还很少在大肠埃希菌中检出,而本研究结果显示鱼源大肠埃希菌中有2.3%携带qnrD.7株鱼源大肠埃希菌同时携带2种以上PMQR编码基因,其中2株携带qnrB+qnrD,2 株 qnrB+aac(6')-Ib-cr,1 株 qnrS+qnrD,1株qnrS+aac(6')-Ib-cr.qnr基因往往介导细菌对喹诺酮类低水平耐药,但当环境中存在该类抗生素压力时,会促进细菌对喹诺酮类产生高水平耐药性.
本研究发现1株鱼源大肠埃希菌同时携带ESBLs和PMQR编码基因.ESBLs和PMQR基因常位于较大的可接合性质粒上,以垂直传播和质粒的水平转移为主要传播方式.接合转移试验结果显示,blaCTX-M-79、blaCTX-M-14、blaTEM-1/1b、qnrS 成功从供体菌转移至受体菌,而blaSHV-27、qnrB、qnrD 和aac(6')-Ib-cr没有发生转移.其中blaCTX-M-79和qnrS位于同一质粒上发生共同转移,blaCTX-M-79、blaTEM、qnrS 3种基因也发生了连锁转移,说明3种基因位于一个质粒上发生转移.所有接合子的ERIC-PCR图谱和供体菌相似,提示鱼源大肠埃希菌ESBLs基因和PMQR基因、β-内酰胺酶基因和PMQR基因、几种PMQR基因都能够同时存在于一个质粒上,在细菌间进行水平传播.这些基因的水平传播机制可以造成ESBLs基因和PMQR基因蔓延,从而导致鱼类菌群和水体菌群耐药性的扩散,鱼类病原体耐药基因甚至可以通过水平传播方式转移给人类病原体[8],危及人类健康.
由于畜禽养殖中大量使用甚至不规范使用抗菌药物,引起畜禽和环境中大肠埃希菌耐药性日趋严重.一些地方水禽和食用鱼的立体式混合饲养,或养殖场废水不合理流放至水产养殖环境中,也导致耐药大肠埃希菌在鱼类和畜禽之间传播.因此,水产养殖和畜禽养殖中,应该规范合理地使用抗菌药物,避免滥用抗菌药物.渔业管理部门应该加强对渔药生产和渔药市场的监督和管理,使之走向规范化;对水产养殖用药情况和鱼类病原体耐药性进行定期监测;适时组织水产养殖户进行培训,推广药理知识,增强广大养殖户合理用药意识,使渔业生产在不危及人类健康的基础上稳步发展.
[1]KAREN B.Alarming β -lactamase-mediated resistance in multidrug-resistant Enterobacteriaceae[J].Current Opinion in Microbiology,2010,13(5):558-564.
[2]HENRIQUES I S,FONSECA F,ALVES A,et al.Occurrence and diversity of integrons and beta-lactamase genes among ampicillin-resistant isolates from estuarine waters[J].Res Microbiol,2006,157(10):938-947.
[3]DIERIKX C,ESSEN-ZANDBERGEN A,VELDMAN K,et al.Increased detection of extended spectrum beta-lactamase producing Salmonella enterica and Escherichia coli isolates from poultry[J].Vet Microbiol,2010,145(3/4):273-278.
[4]ROSSOLINI G M,ANDREA M M D,MUGNAIOLI C.The spread of CTX-M-type extended-spectrum β-lactamases[J].Clinical Microbiology and Infection,2008,14(1):33-41.
[5]MARTINEZ M L,PASCUAL A,JACOBY G A.Quinolone resistance from a transferable plasmid[J].Lancet,1998,351:797-799.
[6]HAN Chen-xi,YANG Yong-hong,WANG Ming-gui.The prevalence of plasmid-mediated quinolone resistance determinants among clinical isolates of ESBL or AmpC-producing Escherichia coli from Chinese pediatric patients[J].Microbiology and Immunology,2010,54(3):123-128.
[7]SEO M R,PARK Y S,PAI H.Characteristics of plasmidmediated quinolone resistance genes in extended-spectrum cephalosporin-resistant isolates of Klebsiella pneumoniae and Escherichia coli in Korea[J].Chemotherapy,2010,56:46-53.
[8]OLE E,HILDE K,KARI G,et al.Human health consequences of use of antimicrobial agents in aquaculture[J].Clinical Infectious Diseases,2009,49:1248-1253.
[9]FELPE C.Heavy use of prophylactic antibiotics in aquaculture:A growing problem for human and animal health and for the environment[J].Environmental Microbiology,2006,8(7):1137-1144.
[10]SMET A,MARTEL A,PERSOONS D,et al.Broad-spectrum β-lactamases among Enterobacteriaceae of animal origin:Molecular aspects,mobility and impact on public health[J].Federation of European Microbiological Societie,2010,34:295-316.
[11]ZHAO Jing-jing,CHEN Zhang-liu,CHEN Shen,et al.Prevalence and dissemination of oqxAB in Escherichia coli isolates from animals,farmworkers,and the environment[J].Antimicrob Agents Chemother,2010,54(10):4219-4224.
[12]YOJIRO I,ASHRAF M,NADIA B,et al.Molecular analy-sis of antimicrobial resistance in gram-negative bacteria isolated from fish farms in Egypt[J].J Vet Med Sci,2010,72(6):727-734.
[13]KOO H J,WOO G J.Distribution and transferability of tetracycline resistance determinantsin Escherichia coli isolated from meat and meat products[J].International Journal of Food Microbiology,2011,145:407-413.
[14]杨先乐,郑宗林.我国渔药使用现状、存在的问题及对策[J].上海水产大学学报,2007,16(4):374-380.
[15]COSTA L,RADHOUANI H,GOMES C,et al.High prevalence of extended-spectrum β-lactamases Escherichia coli and vancomycin-resistant enterococci isolates from chicken products:A problem of public health[J].Journal of Food Safety,2010,30(1):141-153.
[16]CARATTOLI A.Animal reservoirs for extended spectrum β -lactamase producers[J].Clin Microbiol Infect,2008,14(1):117-123.
[17]CANTON R,COQUE T M.The CTX-M beta-lactamase pandemic[J].Curr Opin Microbiol,2006,9(5):466-475.
[18]SONG W,LEE H,LEE K,et al.CTX-M-14 and CTX-M-15 enzymes are the dominant type of extended-spectrum β-lactamase in clinical isolates of Escherichia coli from Korea[J].Journal of Medical Microbiology,2009,58:261-266.
[19]HAWKEY P M.Prevalence and clonality of extendedspectrum β -lactamases in Asia[J].Clin Microbiol Infect,2008,14(1):159-165.
[20]YU Yun-song,JI Shu-juan,CHEN Ya-gang,et al.Resistance of strains producing extended-spectrum β-lactamases and genotype distribution in China[J].Journal of Infection,2007,54:53-57.
[21]SUZUKIL S,SHIBATA N,YAMANEL K.Change in the prevalence of extended-spectrum β-lactamase-producing Escherichia coli in Japan by clonal spread[J].J Antimicrob Chemother,2008,63(1):72-79.
[22]TIAN Su-fei,CHEN Bai-yi,CHU Yun-zhuo,et al.Prevalence of rectal carriage of extended-spectrum β-lactamaseproducing Escherichia coli among elderly people in community settings in China[J].Canadian Journal of Microbiology,2008,54(9):781-785.
[23]WITTUM T E,MOLLENKOPF D F,DANIELS J B,et al.CTX-M-type extended-spectrum β-Lactamases present in Escherichia coli from the feces of cattle in Ohio,United States[J].Foodborne Pathogens and Disease,2010,7(12):1575-1579.
[24]CHANG F Y,SIU L K,FUNG C P,et al.Diversity of SHV and TEM beta-lactamase in Klebsiella pneumoniae:gene evolution in Northern Taiwan and novel beta-lactamase,SHV-25 and SHV-26[J].Antimicrobial Agents and Chemotherapy,2001,45(9):2407-2413.
[25]HAMMAD A M,ISHIDA Y,SHIMAMOTO T.Prevalence and molecular characterization of ampicillin-resistant Enterobacteriaceae isolated from traditional Egyptian Domiati cheese[J].J Food Prot,2009,72(3):624-630.
[26]CORKILL J E,CUEVAS L E,GURGEL R Q,et al.SHV-27,a novel cefotaxime-hydrolysing beta-lactamase,identified in Klebsiella pneumoniae isolates from a Brazilian hospital[J].J Antimicrob Chemother,2001,47(4):463.
[27]SHENG Hai-hui,QU Yi,WU Xue-mei,et al.A new blaLEN-17 gene in a clinical isolate of Staphylococcus epidermidis in Shanghai,China[J].Chinese Medical Journal,2008,121(3):272-275.
[28]MA Jun-ying,ZENG Zhen-ling,CHEN Zhang-liu,et al.High prevalence of plasmid-mediated quinolone resistance determinants qnr,aac(6')-Ib-cr,and qepA among ceftiofur-resistant Enterobacteriaceae isolates from companion and food-producing animals[J].Antimicrobial Agents and Chemotherapy,2009,53(2):519-524.
[29]MARINA C,AURORA G F,MARIA G,et al.First report ofplasmid-mediated quinolone resistance determinant qnrS1 in an Escherichia coli strain of animal origin in Italy[J].Antimicrobial Agents and Chemotherapy,2009,53(7):3112-3114.
[30]KEHRENBERG C,FRIEDERICHS S,DE JONG A,et al.Identification of the plasmid-brone quinolone resistance gene qnrS in Salmonella enterica serovar infantis[J].J Antimicrob Chemother,2006,58(1):18-22.
[31]AVSAROGLU M D,HELMUTH R,JUNKER E,et al.Plasmid-mediated quinolone resistance conferred by qnrs1 in Salmonella enterica serovar virchow isolated from Turkish food of avian origin[J].J Antimicrob Chemother,2007,60(5):1146-1150.
[32]AHMED A M,MOTOI Y,SATO M,et al.Zoo animal as reservoirs of gram-negative bacteria harbouring integrons and antimicrobial resistance genes[J].Appl Environ Microbial,2007,73(20):1054-1067.
[33]KIM H B,PARK C H,KIM C J,et al.,Prevalence of plasmid-mediated quinolone resistance determinants over a 9-year period[J].Antimicrob Agents Chemother,2009,53(2):639-645.
[34]CAVACO L M,HASMAN H,XIA S,et al.qnrD,a novel gene conferring transferable quinolone resistance in Salmonella enterica serovarKentucky and Bovismorbificans strains of human origin[J].Antimicrobial Agents and Chemotherapy,2009,53(2):603-608.

