蛇床组织培养及无性系的建立
赵丹琦,黄光霁,高弘扬,徐 娜,姜长阳
(辽宁师范大学生命科学学院,辽宁大连 116081)
蛇床(Cnidium monnieri)属于伞形科蛇床属一年生草本植物,生长于原野、河边、路旁湿地和山坡草地,分布于我国的很多地区[1-2]。蛇床籽含环葑烯、月桂烯、异龙脑等成分[3],作为中药用,具有温肾壮阳、燥湿杀虫、祛风止痒等功效,能治男子阳痿、女子宫寒不孕、湿痹腰疼、寒湿带下、阴囊湿痒、风湿痹疼、湿疮、疥癣等疾病[3]。由于其具有重要的药用价值,市场上出售价格很高。为此,多年来辽宁南部地区的人们一直在大量采收蛇床以药用或出售,使野生蛇床的繁殖遭到严重破坏,导致近年来辽南地区难以见到这种植物(接近濒危的状态)。有人试图对其进行栽培,但本来就很有限的种子,其发芽率又很低,使其难以实现人工栽培。目前已有植物组织培养研究的报道[4-6]以及蛇床愈伤组织研究的初步报道[7-8],但迄今未见蛇床组织培养及无性系建立的报道。
为了保护这种野生植物,实现人工栽培,本试验对蛇床进行了愈伤组织培养及无性系建立的研究。
1 材料和方法
1.1 材料及灭菌
2007年6月上旬把生长于大连市甘井子区山坡湿地上的蛇床植株采回实验室,作为试验材料。其嫩茎灭菌参照高迎秋等[9]的方法进行。
1.2 培养条件
MS,1/2 MS,1/4 MS,B5,N6,LS 和 White 为次基本培养基,附加不同种类及质量浓度的细胞分裂素和生长素;愈伤组织诱导和不定芽分化培养基含蔗糖30 g/L,生根培养基为15 g/L;pH值为5.8~6.0;培养温度25℃左右;固体培养基的胨力强度为200 g/L;芽和根的诱导培养均于光照条件下进行,光照时间为10~12 h/d,光照强度为3 000 lx 左右[9]。
1.3 方法
1.3.1 愈伤组织诱导 将嫩茎、嫩根和嫩叶柄分别切成长0.3 cm左右的茎段、根段和叶柄段,将叶片切成边长为0.3 cm左右的块状后,分别平放接种到 MS+6-BA0.2 mg/L+2,4-D1.5 mg/L+NAA 0.5 mg/L的培养基上,进行不同材料对愈伤组织诱导培养的试验。试验重复3次,每种处理接种200个材料。
1.3.2 愈伤组织的分化 把在培养基MS+6-BA 0.2 mg/L+2,4-D 1.5 mg/L+NAA 0.5 mg/L培养基上继代培养的愈伤组织切成直径0.3 cm左右、由4~9个颗粒组成的愈伤组织块后,接种到分别以 MS,1/2 MS,1/4 MS,B5,N6,LS 和 White 为基本培养基,附加AgNO31.2 mg/L+6-BA0.8 mg/L+NAA 0.1 mg/L+GA30.5 mg/L培养基上,进行不同基本培养基对愈伤组织分化培养影响的试验。试验重复3次,每处理接种100个材料。
1.3.3 不定芽生根培养 将1.3.2继代分化培养的不定芽从基部剪下,接种到以White+IBA 0.1 mg/L和1/3 MS+IBA 0.1 mg/L为基本培养基,附加不同浓度IAA,NAA的生根培养基上进行生根培养。生根培养试验重复2次,每种培养基接种100个不定芽。
1.3.4 试管苗移栽与定植 打开培养着生根试管苗培养瓶瓶塞,置于温室的光照下炼苗2 d,将试管苗取出,洗净根部培养基后,移栽到上半部为干净河沙、下半部为肥沃园土的营养钵中。试管苗移栽试验重复2次,每次移栽600株。
把营养钵中移栽成活的试管苗于2009年5月中旬定植到大连郊区的草地上。试验重复2次,每次定植550株。
2 结果与分析
2.1 不同材料对愈伤组织诱导培养的影响
接种培养50 d后进行观察统计,结果列于表1。由表1可知,叶片和根不能诱导形成愈伤组织,叶柄和嫩茎能诱导形成愈伤组织。其中,嫩茎的诱导效果好于叶柄,不仅诱导率为83.0%,而且诱导的愈伤组织长势好。观察表明,以嫩茎为培养材料,接种10 d时可见部分材料切口膨大,开始形成愈伤组织。之后,随着形成愈伤组织嫩茎段的数量增加,形成的愈伤组织也不断生长,有的在嫩茎一端生长为半球形,有的两端同时生长,形成哑铃状。初期形成的愈伤组织为淡黄色且表面光滑,后期生长为嫩绿色,表面为颗粒状,一般认为,这样的愈伤组织为具有分化能力的愈伤组织[10-11]。以嫩茎为培养材料,另外2次重复试验诱导培养的愈伤组织也长势旺盛,其愈伤组织的诱导率分别为85.5%和82.0%。

表1 不同材料对愈伤组织诱导的影响
把以上由嫩茎诱导培养的愈伤组织切割成直径0.3 cm左右、由4~9个颗粒组成的愈伤组织块后,接种到相同的培养基上,进行愈伤组织的继代增殖培养,每次重复试验继代培养5代。结果表明,经过40 d的培养,就又会培养生长出一代生长旺盛、颜色嫩绿、表面由许多颗粒组成、具有分化能力、平均增殖系数为7.6的愈伤组织。结果得出,MS+6-BA 0.2 mg/L+2,4-D 1.5 mg/L+NAA 0.5 mg/L的培养基是蛇床嫩茎愈伤组织诱导培养和继代培养的理想培养基。
2.2 不同培养基对愈伤组织分化培养的影响
接种培养50 d观察统计结果(表2)表明,在以MS,1/2 MS和White为基本培养基的3种培养基上,愈伤组织能分化。其中,在以1/2 MS为基本培养基的培养基上统计观察的4项指标效果最好。观察表明,在以1/2 MS为基本培养基的培养基上,培养到8 d时,可见愈伤组织块的上部开始分化生长出绿色不定芽点。之后,伴随着不定芽点的生长,在其下部周围又会分化生长出多个芽点。培养到50 d时,就又能分化生长出一个不定芽丛。3次重复试验的结果基本相同。把由愈伤组织分化培养的不定芽从基部切下,接种到与愈伤组织分化培养相同的培养基上,进行不定芽的分化继代增殖培养。3次重复试验,每次分化继代培养5代结果表明,经过40 d的培养,就会分化生长出一代长势几乎与由愈伤组织分化培养完全相同的试管苗,平均每代的繁殖系数为4.6。按照这个速度,每年能繁殖出4.69个不定芽(约为92万个不定芽)。除掉各种不利因素的影响,1 a能保证繁殖50万个不定芽。结果得出,1/2 MS+AgNO31.2 mg/L+6-BA 0.8 mg/L+NAA 0.1 mg/L+GA30.5 mg/L为蛇床愈伤组织进行分化培养和不定芽分化继代增殖培养的理想培养基。
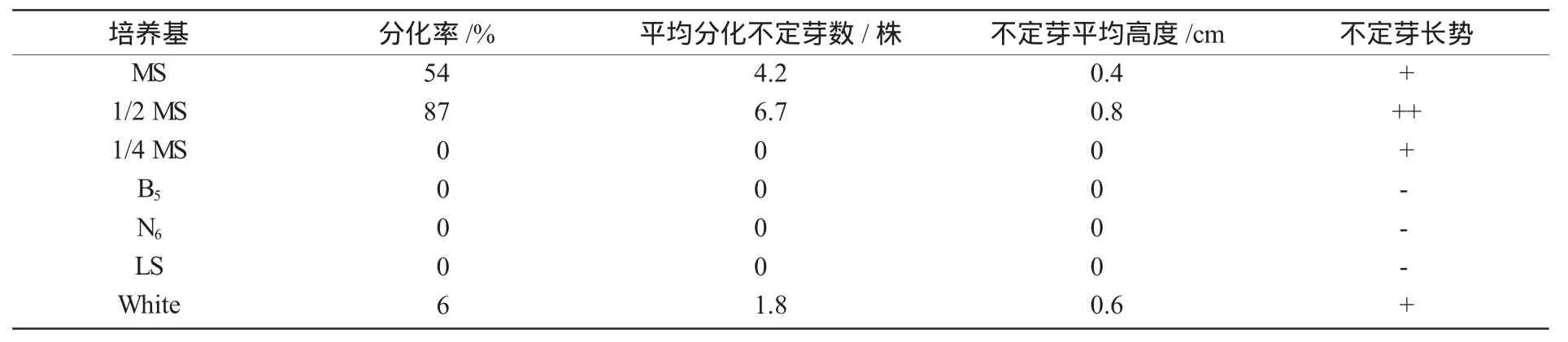
表2 不同基本培养基对愈伤组织分化培养的影响
2.3 不同质量浓度的NAA,IAA对不定芽生根的影响
培养26 d时观察进行统计结果(表3)表明,不定芽在附加不同质量浓度IAA和NAA的生根培养基中均能诱导生根,其中,附加IAA好于NAA。在附加IAA为0.2 mg/L的培养基上生根效果最好,不仅生根率为94%,而且试管苗生长旺盛。观察表明,把不定芽接种到附加质量浓度为0.2 mg/LIAA的培养基上,培养4 d可生长出根原基。之后,伴随着根的伸长生长,根数也不断增加。培养到26 d时,就会培养生长出株高4 cm左右、约有5个叶片、外观上生长旺盛的试管苗。2次生根培养重复试验的结果基本相同。结果得出,White+IBA 0.1 mg/L+IAA 0.2 mg/L为蛇床不定芽生根培养的理想培养基。

表3 不同质量浓度NAA,IAA对不定芽生根培养的影响
2.4 试管苗移栽与定植
移栽和定植后30 d统计表明,2次移栽的平均成活率为95.3%。在日光温室中试管苗易移栽成活。2次定植的平均成活率为99.3%。在营养钵中移栽成活的试管苗极易定植成活。观察表明,定植后50 d左右,成活的试管苗开始旺盛生长。定植90 d后的试管苗与野生蛇床相比,特点为:群体生长整齐,叶色浓绿,根系发达,花期延长20 d左右,保持了野生蛇床的所有植物学性状。
3 讨论
采用不定芽分化继代增殖培养的方法,1 a能保证繁殖出50万株试管苗,这个繁殖速度能满足人们栽培对蛇床种苗的需求。而定植后的试管苗保持了野生蛇床所有植物学性状的结果,又进一步证明了该研究所建立的蛇床无性系,为野生蛇床的保护和满足人们对种苗的需求奠定了技术基础。
在本研究的愈伤组织诱导培养阶段,培养周期为50 d,而在愈伤组织的继代培养阶段,培养周期为40 d,后者比前者缩短了10 d。产生这种现象是由几个方面的原因引起的:一是前者采用的是经过灭菌的外植体,这种材料在灭菌过程中受到了灭菌剂的伤害,在进行愈伤组织的诱导培养中,要经过一个恢复培养阶段,因此,培养时间延长。二是前者所使用的嫩茎是已经分化的植物组织,脱分化过程需要一定的时间,而后者是即将脱分化并处在旺盛生长中的组织,不需要脱分化的时间。三是前者是外植体,接种到培养基上后,必然出现一个适应过程,而后者是直接来自培养基上的材料,不需要这个适应过程。
[1]中国科学院植物研究所.中国高等植物图鉴:第二册[M].北京:科学出版社,1972:1082.
[2]韩全忠,王正兴.大连地区植物志:中册[M].大连:大连理工大学出版社,1993:550-551.
[3]南京中医药大学.中药大辞典:中册[M].上海:上海科学技术出版社,2006:3004-3007.
[4]韩义,许飞雁,陈林晶,等.文冠果组织培养的玻璃化控制研究[J].山西农业科学,2011,39(4):304-306.
[5]李力艺,侯志钢.菊花组织培养技术初探[J].山西农业科学,2004,32(2):50-52.
[6]宋云,王诗粤,赵雪,等.诸葛菜变异植株无性系建立与快速繁殖的研究[J].天津农业科学,2011,17(5):53-55.
[7]郝建平,周小梅,李宝平,等.蛇床幼茎离体培养中体细胞胚胎形成观察[J].武汉植物学研究,1994,12(3):247-250.
[8]郝建平,张江涛,陈柔如,等.蛇床愈伤组织的形态发生及植株再生[J].山西大学学报:自然科学版,1994,17(1):72-76.
[9]高迎秋,孔祥慧,李肖依,等.东方蓼组织培养及无性系的建立[J].山西农业科学,2009,37(1):15-18.
[10]安利佳,姜长阳.植物组织培养导论[M].大连:辽宁师范大学出版社,1996:70-72.
[11]李俊明,朱登云.植物组织培养教程[M].北京:中国农业出版社,2008:47-49.

