Balb/c小鼠花生过敏模型的建立及发病机理
刘志刚,杨成彬,2,闫 浩,2,刘晓宇,2,夏立新,李 荔,2
1)深圳大学医学院过敏反应与免疫学研究所,深圳518060;2)深圳大学生命科学学院,深圳518060
食物过敏反应是一种速发型变态反应,由过敏原特异性IgE抗体介导,当其作用于肥大细胞时,可引起肥大细胞脱颗粒释放活性介质组胺、花生四烯酸和5-羟色胺等;当其作用于体内其他免疫细胞和靶器官时,可引起身体出现过敏反应症状[1].在食物过敏人群中,约30%的人对花生致敏[2],李宏等[3]对北京协和医院就诊的过敏患者的调查表明,约有4%的病人对花生过敏,花生过敏在严重情况下可能危及患者生命.李秀敏等[4-7]曾成功建立了花生过敏模型并进行了治疗性的研究,但采用的过敏原只是单一的过敏原分子,不能全面反应人花生过敏的真实途径.目前,国内尚未有建立花生过敏模型的报道,为此,本研究采用灌胃花生粗蛋白方法对Balb/c小鼠进行致敏,探讨小鼠花生过敏的发病机理,为后续研究及开发治疗花生过敏药物提供良好的动物模型.
1 材料与方法
1.1 材料
5~6周龄雌性Balb/c小鼠 (SPF级)购于中山大学动物实验中心;辣根过氧化物酶偶联二抗IgE抗体 (HRP-IgE)和HRP-IgG2a购于美国SouthBiot公司;组胺检测试剂盒购自美国R&D公司;刘氏染液和伊文思蓝购于珠海贝索生物技术有限公司;IL-4、IL-6、IL-10和IFN-γ细胞因子检测试剂盒购于美国Biolegend公司;其他试剂均为国产分析纯.
1.2 花生粗提蛋白的制备
1.3 小鼠的致敏和激发
16只Balb/c小鼠分为PBS对照组和花生致敏模型组 (简称模型组),每组8只.致敏方式:模型皮下注射致敏两次,间隔3周,每次注射100 μg花生粗蛋白 (crude peanut extract protein,CPE)和1 mg氢氧化铝佐剂;第2次免疫一周后,皮下注射200 μg CPE进行激发.PBS对照组用相同体积溶液的PBS溶液代替花生粗蛋白,其他与模型组相同.
1.4 小鼠尾静脉注射伊文思蓝
小鼠激发前,对照及实验组分别随机取出2只小鼠,尾静脉注射质量浓度为5 g/L的伊文思蓝100 μL,然后立即皮下注射200 μg CPE进行激发,30~40 min后观察小鼠足部颜色变化.
1.5 眼球取血与腹腔灌洗
鼠眼球取血处死,血液滴入体积分数为2%肝素处理的抗凝管中,3 000 r/min离心10 min,取血清;固定小鼠于解剖板上,剪开皮肤露出腹膜,从腹腔一侧注入3 mL的D-hanks液,轻轻按摩约2 min;在腹腔正中剪开一小口,从小口插入玻璃管反复冲洗肠系膜,用注射器吸取灌洗液于离心管中,取200 μL进行细胞计数;剩余部分 1 000 r/min离心10 min,取上清液于另一新的离心管,-20℃保存备用.用3 mL PBS重悬剩余细胞,取200 μL涂于色甘酸钠预处理的载玻片上,自然风干,刘氏染色 (A液15 s,B液30 s),显微镜下进行细胞分类统计,观察肥大细胞形态变化.
1.6 空肠组织H&E切片
取小鼠空肠,剪成0.5 cm小段,用体积分数为10%中性甲醛固定,石蜡包埋,常规切片,H&E染色.光学显微镜下观察肠道炎症细胞浸润和病理变化情况.
1.7 透射电镜观察肠道组织超微结构病理变化
将空肠组织切成1 mm×1 mm×1 mm大小组织块,经体积分数为3%的戊二醛和体积分数为1%的四氯化锇进行双固定,常规环氧树脂包埋,超薄切片,醋酸铀和枸橼酸铅染色,超薄切片,透射电镜观察并拍照.
1.8 血清中IgE、IgG2a、组胺及细胞因子的测定
将1 μg/mL花生蛋白抗原加入到96孔酶标板中,100 μL每孔,4℃包被过夜.PBST洗板5次,加入封闭液,37℃孵育2 h;PBST洗板5次,加入用体积分数为5%的小牛血清PBS稀释液,每孔100 μL,37℃孵育2 h;PBST洗板5次,每孔加入100 μL已稀释的羊抗鼠HRP-IgE(1∶2 000)或羊抗鼠HRP-IgG2a(1∶5 000),37℃孵育2 h;PBST洗板5次,加入TMB底物,37℃避光显色15 min,加入终止液终止反应,测OD450值.
参照组胺及细胞因子检测试剂盒说明书,酶联免疫吸附法分别测定血清的细胞因子和组胺含量.
1.9 统计学分析
实验组动物与对照组之间比较采用t检验进行数据统计分析.设n为各组样本数,P为t检验概率值,则P<0.05代表差异显著.
2 实验结果
2.1 花生粗蛋白SDS-PAGE分析
提取的花生粗蛋白进行SDS-PAGE,结果见图1.由图1可知,在55~70 kDa(1 Da=1 u)之间蛋白量最多,花生蛋白中最主要过敏原Ara h1(相对分子质量63.5 kDa)位于这个区间内.BCA法测定花生粗蛋白浓度,定量5 mg/mL分装,用于动物致敏.
(一)对于“新闻阅读”专题和“新诗研究”专题,由于文本内容理解难度不大,可以用1—2节课的时间,直接开展教学。依照先阅读,后分析的原则,由学生首先带着问题进行阅读,而后进行小组讨论研究,最后小组汇报的形式,完成专题研究的过程。
2.2 激发后小鼠体征观察
激发后,模型组小鼠相对于PBS对照组,模型组小鼠出现烦躁不安,腹泻,精神萎靡,挠头搔耳,呼吸急促等症状.

图1 SDS-PAGE鉴定花生粗蛋白成分Fig.1 SDS-PAGE of peanut crud protein
2.3 小鼠血管通透性的变化
PBS组和花生致敏模型组小鼠尾静脉注射伊文思蓝,接着皮下注射花生粗蛋白30 min后,观察小鼠足部颜色的变化,花生过敏组小鼠的足部出现明显的蓝色,且足部组织充血水肿,而对照组未见明显变化,表明花生过敏模型组小鼠血管通透性明显增强 (图2).

图2 PBS组与花生致敏模型组血管通透性观察Fig.2 Blood vessel permeation observation of PBS group and model group
2.4 腹腔灌洗液炎症细胞计数
用细胞计数板对两组Balb/c小鼠腹腔灌洗液的细胞进行细胞总数统计,并用刘氏染液染色,根据细胞核大小及细胞核分叶数等特征区分各种炎症细胞,分类统计数据表明模型组中炎症细胞总数明显升高,其中肥大细胞、淋巴细胞、嗜酸性粒细胞都呈现显著升高(P<0.01),而中性粒细胞、巨噬细胞无明显的变化(P>0.05)(图3和图4).花生过敏组腹腔灌洗液中肥大细胞明显增大,数目明显增多,细胞膜出现褶皱状,在致敏组活化的肥大细胞周围有明显的颗粒状物质存在,表明肥大细胞已出现脱颗粒.

图3 腹腔灌洗液刘氏染色 (↑指示肥大细胞,×100)Fig.3 Irrigating solution abdominal cavity were stained by Liu'staining solution(↑:mast cell,manification ×100)

图4 腹腔细胞分类与计数Fig.4 Classification and count of the cells of abdominal cavity were classified and counted
2.5 小鼠空肠组织病理变化
空肠下端H&E切片显示,PBS组肠黏膜结果清晰,肠绒毛排列整齐,绒毛无明显损伤,无炎症细胞浸润;而模型组与PBS对照组相比,花生过敏模型组肠黏膜出现轻度糜烂,排列不整,肠绒毛损伤,呈现以嗜酸性粒细胞为主的炎症细胞浸润现象.表明花生过敏原引起了模型组出现肠道黏膜病变 (图5).通过透射电镜观察发现,对照组微绒毛排列整齐,结构完整,肠紧密连接结构清晰,肠上皮细胞可见大量线粒体,粗面内质网等细胞器,而过敏模型组肠微绒毛绒毛已严重受损,排列紊乱、断裂、缺失,肠上皮细胞结构不清晰,细胞间紧密连接扩大,可见肥大细胞、嗜酸性粒细胞和巨噬细胞浸润 (图6).
2.6 血清中特异性的IgE和IgG2a水平的改变

图5 空肠下端病理切片 (H&E染色,×40)Fig.5 The pathological section of ileum(H&E staining,manification ×40)

图6 透射电镜观察空肠下端病理切片 (TEM,×23 000)Fig.6 Observation of the pathological section of ileum by TEM(TEM,×23 000)
酶联免疫吸附法检测血清中的花生过敏原特异性IgE和IgG2a的水平,模型组 (0.56±0.22,n=8)相对于对照组 (0.17±0.03,n=8),血清中IgE明显上升 (P<0.01),IgG2a水平模型组(0.23±0.03,n=8)较对照组 (0.56±0.02,n=8)明显下降(P<0.01)(图7).说明花生过敏原引起体内特异性IgE升高,而IgE是活化肥大细胞介导速发型过敏反应前提.IgG2a的下调表明过敏原引起小鼠体内免疫系统偏向于Th2型反应.
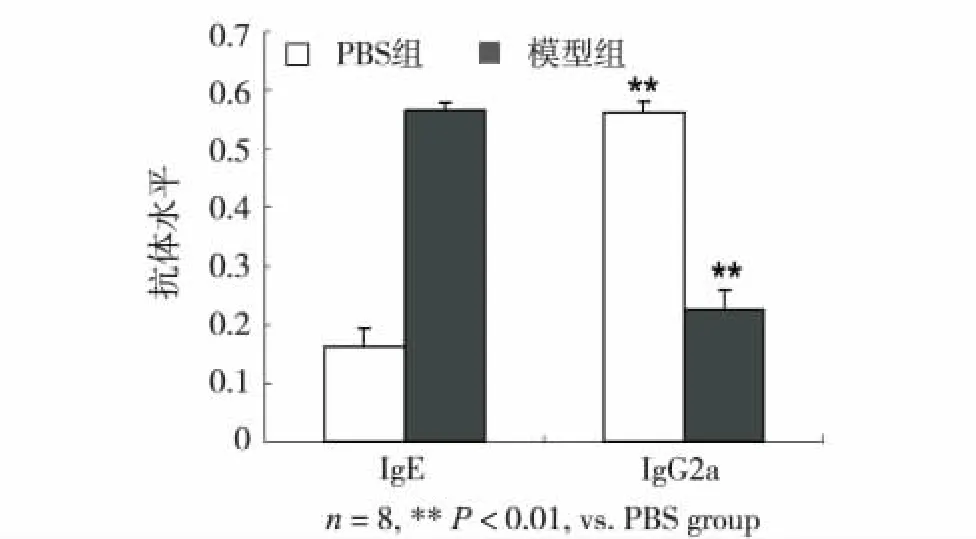
图7 血清中IgE与IgG2a抗体水平Fig.7 The levels of IgE and IgG2a in blood serum
2.7 血清组胺和细胞因子的变化
模型组血清中的 Th2型的细胞因子 (IL-4,16.9±1.34,P <0.01;IL-5,16±3.51,P <0.05;IL-6,121.7±11.84;n=6)较PBS对照组 (IL-4,9.1±1.42;IL-5,8.3±1.15;IL-6,37.4±4.84,P<0.01;n=6)出现明显上升.Th1型的血清细胞因子模型组 (IFN-γ,133.8±5.45,P <0.01;n=6)较PBS组 (IFN-γ,185.4±13.63;n=6)出现显著下调,表明花生过敏原通过调节细胞因子的表达,引起偏向于Th2的过敏反应 (图8).在模型组中血清组胺含量 (27.7±4.29,P<0.01;n=6)都明显高于对照组(13.4±2.11;n=6),说明模型组体内的肥大细胞的活化,引起了脱颗粒,并释放组胺,引起速发型过敏反应.

图8 血清中细胞因子水平Fig.8 The levels of cytokine in blood serum
3 讨论
花生过敏是速发型超敏反应,可以影响全身许多脏器,如口腔、消化道、心血管和皮肤等,引起临床各种变态反应症状[8].花生过敏反应是IgE介导的I型超敏反应,花生总蛋白中含有多种过敏原蛋白成分,包括主要致敏蛋白组分Ara h1和Ara h2,次要致敏蛋白组分Ara h4、Ara h5、Ara h6、Ara h7和Ara h8,它们都可以与特异性IgE结合并诱导人体过敏反应,不同的过敏患者可能对不同的花生过敏原蛋白成分产生过敏反应[9-10].Balb/c小鼠常用于建立食物过敏模型,相对Ganeshan K等报道的花生过敏模型的建立方法,本实验采用去除脂肪和多糖类物质中的花生粗蛋白 (CPE)对小鼠进行致敏,其致敏性强,更能反映花生作为食品引起的过敏反应[11],全面表现花生过敏的真实情况,且Balb/c小鼠相对易得,便于实验研究.
Mosmann T R等[12]发现按照细胞产生细胞因子的种类和量的不同,提出了Th1/Th2平衡理论,可将细胞因子的产生分为Th1型和Th2型.Th1型是介导炎症反应和迟发型的变态反应,主要包括IL-2、IFN-γ和TNF-α等,Th2型主要介导的是速发型过敏反应及I型超敏反应,主要包括IL-4、IL-5、IL-6、IL-9和IL-13等.本实验测定了血清中的细胞因子,发现花生粗蛋白引起了Balb/c小鼠血清中IL-4、IL-5和IL-6含量明显上升,IFN-γ出现下降,表明花生粗蛋白上调了Th2细胞因子水平,抑制了Th1因子的水平,导致小鼠体内Th1/Th2失衡.
肥大细胞是过敏反应中的核心细胞,在I型超敏反应中是最重要的效应细胞,当摄入的过敏原进入机体后,抗原会诱导B淋巴细胞产生特异性的抗体IgE、sIgE与肥大细胞表面的Fc受体相结合,从而使肥大细胞处于致敏状态,当机体再次接触到抗原时,肥大细胞表面的Fc受体发生募集反应,激活肥大细胞的内部传导信号,较短时间内导致肥大细胞脱颗粒,释放组胺、白三烯和肝素等炎性介质,进而引起平滑肌收缩、毛细血管扩张等一些过敏反应症状,造成皮肤、消化道和呼吸道过敏反应,甚至全身性过敏反应[13-15].
本实验对血清中的组胺和花生特异性IgE进行了检测,发现花生致敏组中两者含量都明显上升,这是小鼠发生过敏反应的重要指标之一,对应用小鼠动物模型检测花生过敏原有重要意义.在对小鼠血管通透性检测中,模型组的血管通透性明显增强,提示肥大细胞释放的组胺等介质引起了小鼠血管壁的扩张,从而引起通透性明显增强.通过光学显微镜和电子显微镜观察肠道病理切片,发现模型组出现肠黏膜水肿、肠上皮损伤、肠绒毛断裂等一系列肠道病理变化,说明花生过敏会降低肠道的吸收能力和增强其通透性.向军俭等[16]报道脱颗粒肥大细胞的体积较正常肥大细胞大,胞内有很多致密小颗粒,正常肥大细胞呈圆球形,轮廓清楚完整;脱颗粒细胞形态变的不规则,表面出现一些空洞,轮廓模糊不清.本实验中对腹腔灌洗液中的肥大细胞进行刘氏染色,结果显示,在花生过敏组的腹腔肥大细胞出现明显增大,细胞周围分泌物明显增多,显示肥大细胞呈活化状态.综上研究可知,本实验提供了一种花生过敏建模的方法,并对花生过敏的发病机理及病理特征进行了研究,为花生过敏的预防和治疗奠定了理论基础.
/References:
[1]Sampson H A.Food allergy.When mucosal immunity goes wrong[J].Journal of Allergy and Clinical Immunology,2005,115(1):139-141.
[2]Nowak-wegrzyn A,Sampson H A.Future therapies for food allergies[J].Journal of Allergy and Clinical Immunology,2011,127(3):558-573.
[3]LI Hong,ZHANG Hong-yu.Analysis of sensitizing components for peanut allergen[J].Chinese Journal of Microbiology and Immunology,2001,4(21):12-15.(in Chinese) 李 宏,张宏誉.花生过敏原致敏组分分析[J].中华微生物和免疫学,2001,4(21):12-15.
[4]Li X M,Srivastava K,Grishin A,et al.Persistent protective effect of heat-killed Escherichia coli producing engineered,allergy[J].Journal of Allergy and Clinical Immunology,2003,112(1):159-67.
[5]Ganeshan K,Neilsen C V,Hadsaitong A,et al.Impairing oral tolerance promotes allergy and anaphylaxis:a new murine food allergy model[J].Journal of Allergy and Clinical Immunology,2009,123(1):231-138.
[6]Bol-Schoenmakers M,Bleumink R,Marcondes Rezende M,et al.Diclofenac enhances allergic responses in a mouse peanut allergy model[J].Clinical& Experimental Allergy,2011(41):424-433.
[7]Hughes J L,Brown T,Edgar J D.Peanut allergy and allergic airways inflammation[J].Pedlatr Allergy Immumunol,2010,21(8):1107-13.
[8]ZHANG Ying-kun,CHEN Hong-bing.The research development in major peanut allergens[J].Science and Technology of Food Industry,2006,27(3):197-199.(in Chinese)张英坤,陈红兵.花生中主要过敏原的研究进展[J].食品工业科技,2006,27(3):197-199.
[9]XIA Lixin,YAN Hao,TANG Mu-jin,et al.Bioinformatics comparison of peanut allergen Ara h2 and Ara h6[J].Journal of Shenzhen University Science and Engineering,2010,27(2):241-246.(in Chinese)夏立新,闫 浩,汤慕瑾,等.花生过敏原Ara h2与Ara h6的生物信息学比较研究[J].深圳大学学报理工版,2010,27(2):241-246.
[10]YAN Hao,LIU Zhi-gang,LI Li,et al.Cloning,expression and characterization of peanut allergen Ara h6[J].Science and Technology of Food Industry,2010,31(10):173-181.(in Chinese)闫 浩,刘志刚,李 荔,等.花生Ara h6基因的克隆、表达以及免疫活性鉴定[J].食品工业科技,2010,31(10):173-181.
[11]Mondoulet L,Dioszeghy V,Ligouis M,et al.Epicutaneous immunotherapy on intact skin using a new delivery system in a murine model of allergy[J].Clinical and Experimental Allergy,2010,40(4):659-667.
[12]Mosmann T R,Coffman RL.TH1 and TH2 cells:different patterns of lymphokine secretion lead to different functional properties[J].Annual Review Immunology,1989,7:145-173.
[13]Ito A,Hagiyama M.Oonuma J.Nerve-mast cell and smooth muscle-mast cell interaction mediated by cell adhesion molicule-1,CADM1[J].Journal of Smooth Nuscle Research,2008,44(2):83-93.
[14]Janet K,Stephen J G.New developments in mast cell biology[J].Nature Immunology,2008,9:1215-1223.
[15]Sho Yamasaki,Takashi Saito.Progress in allergy signal research on mast cells:signal regulation of multiple mast cell responses through FcεRI[J].Journal of Pharmacological Sciences,2008,106:336-340.
[16]XIANG Jun-jian,ZHANG Zai-jun,MAO Lu-tian,et al.Histamine releasing from sensitized Mast cells from mouse model stimu la ted by food allergen in vitro[J].Guangdong Medical Journal.2005,26(5):593-595.(in Chinese)向军俭,张在军,毛露甜,等.食品过敏原体外激发小鼠致敏肥大细胞组胺释放[J].广东医学,2005,26(5):593-595.

