重组白细胞抑制因子和水蛭肽嵌合蛋白异构体鉴定
刘 巍,范 开
(重庆理工大学药学与生物工程学院,重庆 400054)
重组白细胞抑制因子和水蛭肽嵌合蛋白(简称TNHH)系由大肠杆菌重组表达,经纯化精制而得的具有国内外创新性研究成果的注射药物。应用该工艺制备的TNHH理论氨基酸数为283个,理论相对分子质量为31525.5 D,理论等电点(PI)为4.57。由TNHH的氨基酸序列可知,在其结构中含有10个半胱氨酸,形成5对二硫键,因此,在制备工艺中存在因二硫键错配而形成的异构体。为了进一步去除异构体,本研究采用适宜的质控方法(RP-HPLC法、等电聚焦、非还原型SDS-PAGE凝胶电泳法、非变性PAGE法、活性分析、阴离子交换HPLC分析异构体)对异构体鉴定和含量比例进行控制。首先制备TNHH异构体并进行分析鉴定,在此基础建立一种质控方法分析并测定本品中异构体的最低限量,以达到TNHH中异构体含量不高于5.0%的国家生物药物异构体质量控制标准。
1 仪器和材料
1.1 仪器
Amersham Bioscience纯化仪(美国GE);Waters 600-2487系统液相色谱仪(美国Waters);Bio-Rad Universal电泳仪(美国Bio-Rad);Source 30Q预装柱(美国 GE);PL-SAX 1000A,8 μm,150 ×4.6 mm(美国Polymer Laboratories);SourceTM15Q,10×50 mm,15 μm(美国 Pharmacia);TU-1810 紫外可见分光光度计(北京普析);Spectra Max190酶标仪(美国MD);HHS-4S型电子恒温水浴锅(上海南阳);冷冻干燥机(Labconco);PHS-3C型PH计(上海大普);透析袋(Green Bird)。
1.2 材料
磷酸氢二钠(AR,上海生工);磷酸二氢钠(AR,上海生工);硫酸铵(AR,上海生工);乙酸钠(AR,上海生工);冰乙酸(AR,广东光华);乙腈(AR,广东光华);三氟已酸(AR,广东光华);蛋白Marker(北京天恩);凝血酶标准品(中国药品生物制品检定所);纤维蛋白原纯品(美国Sigma)。
2 方法
2.1 TNHH异构体的制备
采用原液制备工艺路线中Source 30Q层析分离TNHH不同异构体。试剂配制:A液为20 mM PB,0.2M(NH4)2SO4,pH 值为 8.0;B 液为 20 mM PB,0.4M(NH4)2SO4,pH 值为 8.0。设备:Amersham Bioscience纯化仪、Source 30Q预装柱。经复性和初纯化的样品,用A液平衡Source 30Q预装柱,样品电导稀释至25.0 mS/cm后上样,上完样后用A液平衡至基线;先用25%的B液洗脱TNHH,再用35%的B液洗脱异构体。将异构体组分对20倍体积的超纯水透析过夜,再用HPLC法测体积百分含量,按1.0 mg/支分装,冻干。
2.2 异构体的分析鉴定
2.2.1 RP-HPLC 法
具体操作按2005年版中国药典三部附录ⅢB“高效液相色谱法”[1]。仪器:Waters 600-2487 系统。色谱柱:WATERS symmetry 300TMC45μm,4.6×250 mm;色谱条件:流动相的A液为 5%乙腈+0.1%三氟已酸,B液为95%乙腈+0.1%三氟已酸;梯度为线性梯度30 min,B从0~100%;流速为1.0 mL/min;检测波长为214 nm;柱温为30℃;进样量为 20 μL。将 1.0 mg/mL 的 TNHH对照品、异构体以及两者混合样品进行RP-HPLC分析[2]。
2.2.2 等电聚焦分析
具体操作按2005年版中国药典三部附录IV D“等电聚焦电泳法”进行[1]。仪器:Bio-Rad Universal。电泳仪样品制备:TNHH对照品和异构体冻干粉用超纯水溶解至1.0 mg/mL。等电点标准品:取1支标准品用0.1 mL超纯水溶解,分别取20 μL 上样[3]。
2.2.3 非还原型SDS-PAGE凝胶电泳法
具体操作依照中国药典(2005年版三部)附录IV C“SDS-聚丙烯酰胺凝胶电泳法”测定[1]。样品处理:取TNHH原液和TNHH异构体样品用超纯水稀释至浓度为1.0 mg/mL,按体积3:1的比例加入非还原型样品缓冲溶液,混匀,100℃水浴5 min,上样 10 μL[4]。
2.2.4 非变性PAGE电泳
具体操作依照中国药典(2005年版三部)附录 IV C“SDS-聚丙烯酰胺凝胶电泳法”[1]。不同之处:电泳凝胶、电极缓冲液、样品缓冲液都不带SDS,即为非变性 PAGE 电泳[5]。样品处理:取TNHH对照品和异构体用超纯水分别稀释至浓度为1.0 mg/mL,取 100 μL 加入 25 μL 的 5 × 非变性样品缓冲液,混匀后直接取10 μL上样。
2.2.5 活性分析
1)抗凝血酶凝固活性测定法
依照中国药典(2005年版三部)附录Ⅹ F“抗凝血酶凝固活性测定方法”进行“TNHH抗凝血酶凝固活性测定方法”[1,6]。取TNHH 和异构体各一支配成相同浓度(0 ~ 32.0 μg/mL),测定抗2.0 Iu/mL凝血酶的纤维蛋白原凝固时间。
2)抑制白细胞粘附活性测定(细胞法)
依照中国药典(2005年版三部)附录Ⅹ F“抑制白细胞粘附活性测定(细胞法)”进行“TNHH抑制白细胞活性测定方法”[1,6]。取TNHH 对照和异构体各 1 支(1 mg/支)配成 5.0、2.5、1.25、0.625、0.312、0.156、0.078、0.038 μg/mL 和空白对照,测定抑制人外周血白细胞粘附活性。
2.3 TNNH原液中异构体定量检测
采用RP-HPLC法、等电聚焦、非还原型SDSPAGE凝胶电泳法、非变性PAGE法、活性分析等鉴定方法只能对TNNH异构体进行定性或半定量检测[3]。根据TNHH异构体与TNHH的等电点差异,结合相关文献,采用阴离子HPLC来研究和建立本品TNHH中异构体的百分含量[7]。
2.3.1 色谱方法用不同pH值的分离效果
1)样品制备
取TNHH对照品和异构体各一支用DDW溶解成1.0 mg/mL,等体积混合后分进样20 μL。主要试验条件:仪器为Waters 600-2487系统;色谱柱为 PL-SAX 1000A,8 μm,150 ×4.6 mm;试剂为磷酸二氢钠、磷酸氢二钠、乙酸钠、冰醋酸、氯化钠。
2)试验方法
方法1 流动相A液:20 mM乙酸钠,pH值为6.0,0.2M 氯化钠;流动相 B 液:20 mM 乙酸钠,pH值为6.0,0.6 M氯化钠。梯度:20 min线性梯度,B液从0~100%。检测波长为214 nm,柱温为室温。
方法2 流动相A液:20 mM PB,pH值为8.0,0.2M 氯化钠;流动相 B 液:20mM PB,pH 值为8.0,0.6M 氯化钠。梯度:20 min线性梯度,B液从0~100%。检测波长为 214 nm,柱温为室温。
2.3.2 色谱方法用不同盐离子的分离效果(基于不同pH值的分离效果)
1)样品制备
取TNHH对照品和异构体各1支用DDW溶解成1.0 mg/mL,等体积混合后分进样20 μL。主要试验条件:仪器WEI Waters 600-2487系统;色谱柱 WEI PL-SAX 1000A,8 μm,150 ×4.6 mm;试剂为磷酸二氢钠、磷酸氢二钠、乙酸钠 、冰醋酸、氯化钠。
2)试验方法
方法3 流动相A液:20 mM乙酸钠,pH值为6.0,0.1 M 硫酸铵;流动相 B 液:20 mM 乙酸钠,pH值为6.0;0.5 M硫酸铵。梯度为20 min线性梯度,B液从0~100%。检测波长为214 nm,柱温为室温。
2.3.3 色谱方法用不同色谱柱分析(基于不同盐离子的分离效果)
1)样品制备
取TNHH对照品和异构体各1支用双蒸水溶解成1.0 mg/mL,等体积混合后分进样20 μL。分别用2根不同的色谱柱试验[8]。仪器为 Waters 600-2487系统。色谱柱 A为 PL-SAX 1000A,8 μm,150×4.6 mm。色谱柱 B为 SourceTM15Q(Pharmacia产品),10 ×50 mm,15 μm。试剂为磷酸二氢钠、磷酸氢二钠、乙酸钠、冰醋酸、氯化钠。
2)试验方法
流动相 A液:20 mM乙酸钠,pH值为6.0,0.1M硫酸铵;流动相B液:20 mM乙酸钠,pH值为6.0,0.4 M 硫酸铵。梯度为20 min线性梯度,B液从0~100%。检测波长为 214 nm,柱温为室温。
2.3.4 TNHH异构体检出限分析(基于不同色谱柱分析)
1)TNHH异构体检出限分析样品的配制
取1.0 mg/mL的异构体,按5.0%的质量比加入1.0 mg/mL的TNHH对照品中,即含异构体的量为5.0%。进样20 μl,记录色谱图。结果计算:用峰面积归一化法计算异构体占总面积的百分率。色谱柱为 PL-SAX 1000A,8 μm,150 ×4.6 mm。仪器为Waters 600-2487系统。试剂为磷酸二氢钠、磷酸氢二钠、乙酸钠、冰醋酸、氯化钠。
2)试验方法
流动相A 液:20 mM 乙酸钠,pH 值为6.0,0.1 M硫酸铵;流动相B液:20 mM乙酸钠,pH值为6.0,0.4 M硫酸铵。梯度为20 min线性梯度,B液从0~100%。检测波长为 214 nm,柱温为室温。
3 结果与讨论
3.1 RP-HPLC 法
从图1~3可看出,在 RP-HPLC色谱图上TNHH与其异构体不能分离,保留时间一致。

图1 TNHH对照品

图2 TNHH异构体

图3 TNHH对照品+异构体
3.2 等电聚焦分析
从图4等电点测定结果得知异构体比TNHH等电点低0.5左右,二者能有效分离。

图4 TNHH和异构体样品等电聚焦电泳结果
3.3 非还原型SDS-PAGE凝胶电泳法
从图5结果得知TNHH和异构体二者在非还原SDS-PAGE上的迁移率一致,该方法不能鉴别样品中是否含有异构体。

图5 TNHH和异构体样品非还原型SDS-PAGE电泳结果
3.4 非变性PAGE电泳
由于本品属于酸性蛋白,可应用不含SDS的非变性电泳进行分析。从图6电泳结果可知,TNNH与异构体均呈单一条带,TNHH迁移率约慢于异构体。异构体在非变性PAGE电泳中的迁移率不同于TNHH,与其二、三级构象有关[4]。
3.5 活性分析
3.5.1 抗凝血酶凝固活性测定法
根据表1、2的数据,通过活性计算公式得到异构体抗凝血酶凝固活性为142 ATU/mg,TNHH对照品抗凝血酶凝固活性为465 ATU/mg,异构体比TNHH活性低70%。该方法不能鉴定TNHH和其异构体。

图6 TNHH和异构体样品非变性PAGE电泳结果

表1 凝血酶标准品纤维蛋白原凝固时间 s
3.5.2 抑制白细胞粘附活性测定(细胞法)
根据表3的数据,由IC50计算公式可知TNHH活性抑制白细胞活性IC50为156 ng/mL,异构体抑制白细胞活性IC50为370 ng/mL。TNHH异构体活性比TNHH活性约低50%。

表2 TNHH对照品和异构体抗凝血酶凝固时间 s
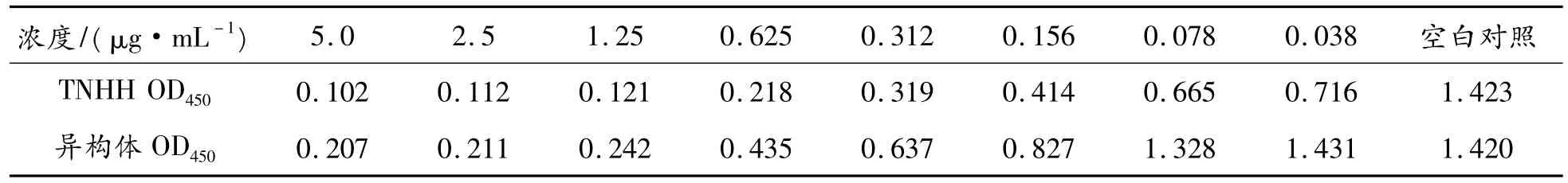
表3 TNHH和TNHH异构体抑制白细胞粘附活性吸光度
3.6 TNNH原液中异构体定量检测
3.6.1 不同pH值的分离效果
试验结果见图7、8和表4。从表4可知,流动相在pH值为6.0(即方法1)时,分离度略好于pH值为8.0(即方法2)时。
3.6.2 不同盐离子的分离效果
试验结果见图9和表5。从表5可知,硫酸铵(即方法3)的分离结果优于氯化钠(方法1)。因此,在方法3的基础上,用不同的色谱柱做进一步分析。

图7 方法1(低pH值)色谱图

图8 方法2(高pH值)色谱图

表4 不同pH值的分离效果结果分析

图9 方法3的色谱图

表5 不同盐离子的分离效果结果分析
3.6.3 不同色谱柱的分析效果
试验结果见图10、11和表6。从表6可知,通过降低B液中盐浓度(0.4 M硫酸胺),异构体与TNHH的分离度提至大于1.5。在相同条件下PLSAX的分离度略优于 SourceTM15Q。经以上研究证明,在pH值为6.0的乙酸-乙酸钠和含不同梯度硫酸胺的流动相中两者分离度较理想。在色谱柱的选用上,PLX-SAX的分离度略优于SourceTM15Q,故选择PLA-SAX柱。

图10 PL-SA色谱图

图11 SourceTM15Q色谱图

表6 不同色谱柱的分析效果结果分析
3.6.4 TNHH异构体检出限分析
试验结果见图12及表7。从图7数据可知,经方法验证,应用该方法和色谱条件能有效检测出本品中含有5.0%以下的异构体。

图12 PL-SAX色谱图

表7 PL-SAX色谱图分析结果
4 结束语
从实验结果可以得出,在RP-HPLC法、等电聚焦、非还原型SDS-PAGE凝胶电泳法、非变性PAGE法、活性分析等方法中,只有等电聚焦和非还原型SDS-PAGE凝胶电泳法能分辨TNHH和异构体,可作为检定方法进行定性鉴定。而采用阴离子HPLC(PL-SAX色谱柱)法能对TNHH异构体进行百分含量定量鉴定,可作为检定方法进行定量鉴定。以上指标均达到《中华人民共和国药典》2005年版三部和《人用重组DNA制品质量控制技术指导原则》的要求,可对产品进行有效和可靠的质量控制,确保产品安全,并用于TNHH产品异构体检定。
[1]国家药典委委员.中国人民共和国药典:三部[S].北京:化学工业出版社,2005.
[2]Zhao Rui,Ji JianGuo,Yuan HongSheng,et al.Separation of Rabbit Liver Metallothio NeinSub-isoforms by RPHPLC with MALDI-TOF-MS Detection[J].Chemical Journal of Chinese Universities,2002,23(6):1086-1090.
[3]何忠效,张树政.生物化学实验技术丛书:电泳[M].北京:科学出版社,1999.
[4]钱小红,贺初福.蛋白质组学:理论与方法[M].北京:科学出版社,2002.
[5]张津辉,蒋中华,陈惠鹏.制备电泳中蛋白区带定位与染色方法的比较[J].军事医学,1997(2):159-160.
[6]辛中帅,李克坚,杨化新,等.重组白细胞抑制因子和水蛭肽嵌合蛋白质量标准研究[J].中国新药研究杂志,2008,17(21):1865 -1868.
[7]Cirilli R,La Torre F.Stereoselective analysis of benazepril and its stereoisomersby reversed-phase high-performance liquid chromatography on a chiral AGP column[J].Chromatogr A,1998,818(1):53 -60.
[8]刘钦伟,马仕珉,杨小明,等.HPLC法检查酒石酸布托啡诺原料药中右旋异构体[J].药学进展,2008(10):460.

