蓝圆肌肉组织蛋白酶B的纯化与性质分析
钟 婵,沈建东,蔡秋凤,翁武银,曹敏杰
(集美大学生物工程学院,福建厦门 361021)
钟 婵,沈建东,蔡秋凤,翁武银,曹敏杰*
(集美大学生物工程学院,福建厦门 361021)
在鱼糜制品生产过程中,凝胶劣化现象是引起鱼糜品质下降的重要原因。研究表明,溶酶体中的内源性组织蛋白酶B会促进肌原纤维蛋白的降解,进而导致鱼糜凝胶劣化。迄今为止,多种鱼体肌肉中的组织蛋白酶B已有研究,但海水经济低值鱼蓝圆鲹中该酶的情况却尚未报道。本研究采用硫酸铵沉淀和柱层析相结合的方法,从蓝圆鲹肌肉中分离纯化得到分子量约为27ku的组织蛋白酶B。酶学性质结果显示,该酶最适温度和最适pH分别为55℃和5.5,半胱氨酸蛋白酶抑制剂E-64能有效抑制其活性。对肌原纤维蛋白的降解实验表明,在最适条件下,蓝圆鲹组织蛋白酶B对肌原纤维蛋白有一定的降解作用。因此,组织蛋白酶B参与肌原纤维蛋白的降解,更可能参与在低pH条件下鱼糜凝胶劣化。
蓝圆鲹,组织蛋白酶B,性质,肌原纤维蛋白
鱼糜制品因口感和风味良好受到国内外消费者的欢迎,2009年我国鱼糜制品的总产量为84.7万t,占总水产加工品总量的5.7%[1]。鱼糜制品在生产过程中常在55~60℃的温度带内产生因肌肉结构蛋白分解,导致的凝胶形成能力明显下降的现象(凝胶劣化)。凝胶劣化不仅影响鱼糜制品的弹性,更影响其商品价值。目前研究表明,酸性半胱氨酸蛋白酶[2-3]和碱性肌原纤维结合型丝氨酸蛋白酶[4-5]是导致鱼糜劣化的主要内源性蛋白酶。其中半胱氨酸蛋白酶主要指存在于肌肉细胞溶酶体中的组织蛋白酶L、B和H,在鱼糜凝胶劣化中起着一定的作用。李树红[6]等人认为,鲢鱼(Hypophthalmichthys molitrix)鱼肉经漂洗后仍残留组织蛋白酶L、B和H的活性,其中组织蛋白酶L的残留率为25.79%,组织蛋白酶B为11.46%,而组织蛋白酶 H只有 6.86%。Jiang等人[2,7]的研究表明,组织蛋白酶 B与 L对鲭鱼(Scomber australasicus)的肌原纤维蛋白有着明显的降解作用。Liu等人[8]发现组织蛋白酶B和L能够破坏鲢鱼鱼糜凝胶的网状结构,进而引起凝胶劣化现象。蓝圆鲹作为一种重要的经济海水鱼类,据统计,2009年的总量为54.0万t[1]。由于海洋鱼类资源的持续减少,海水红色肉鱼已成为有较高经济价值的鱼种。但因其肌肉中红色肉含量多,脂肪含量高,蛋白酶活性强,鲜度下降快等问题,红色肉鱼类的资源一直没有得到合理的利用。因此,研究该鱼类肌肉中的组织蛋白酶,尤其是探讨导致鱼体肌肉软化的组织蛋白酶的性质及其与肌原纤维蛋白降解的关系,可为解决鱼糜生产过程中凝胶劣化问题提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
新鲜蓝圆鲹(Decapterus maruadsi)、罗非鱼(Oreochromis niloticus) 福建省厦门市集美菜市场; SP-Sepharose、Sephacryl S-200 HR层析树脂 瑞典Amersham Biosciences公司;Z-Phe-Arg-MCA、Z-Arg-Arg-MCA等荧光底物 日本Peptide Institute公司;反-环氧丁二酰基-L-亮氨酰胺基(4-胍基)(E-64)
美国Amresco公司;Chymostatin、Leupeptin 德国Roche公司;乙二胺四乙酸(EDTA)、苯甲基磺酰氟(PMSF)、N,N,N',N'-四甲基乙二胺(TEMED)、溴酚兰 美国Sigma公司;标准蛋白 立陶宛Fermentas公司;十二烷基硫酸钠(SDS,电泳纯)、二硫叔糖醇(DTT)、丙烯酰胺 美国Bio-Rad公司;其他试剂
均为国产分析纯。
Avanti JA-25大型高速冷冻离心机 美国Beckman公司;BioPhotometer紫外分光光度计 德国Eppendorf公司;FP-6200荧光分光光度计 日本Jasco公司;G:BOX凝胶成像仪 英国Syngene公司; WB-14恒温水浴锅 德国Memmert公司。
1.2 实验方法
1.2.1 组织蛋白酶B的分离纯化 蓝圆鲹肌肉中组织蛋白酶B的分离纯化主要参考Jiang等人[9]的方法,纯化过程中的溶液均含有5mmol/L L-半胱氨酸。取新鲜的蓝圆鲹骨骼肌加入4倍鱼肉重量的50mmol/L乙酸钠缓冲液(pH4.5)(缓冲液A)进行组织捣碎,在8,000×g离心30min,用四层绢布过滤取其上清液。上清液经过30%~70%硫酸铵盐析后,沉淀用少量的缓冲液A溶解,在相同的缓冲液中充分透析脱盐。将透析后的样品上样于事先用缓冲液A平衡的SP-Sepharose阳离子交换层析柱(2.5cm× 15cm),缓冲液A流洗去除未吸附的蛋白,再用含0~1mol/L NaCl盐浓度的缓冲液A进行线性洗脱,收集活性峰,用10ku截留膜超滤浓缩。将浓缩后的样品上样于用含有0.15mol/L NaCl的20mmol/L Tris-HCl缓冲液(pH7.0)(缓冲液 B)平衡的 Sephacryl S-200 HR凝胶过滤层析柱,收集活性峰,检测纯度及酶活力。
1.2.2 组织蛋白酶B活力的测定 组织蛋白酶活力测定主要参考Barrett等人[10]的方法。组织蛋白酶B以Z-Phe-Arg-MCA和Z-Arg-Arg-MCA为荧光底物,在0.1mol/L的乙酸钠缓冲液(pH5.5)中进行酶活测定,反应缓冲液中含1mmol/L EDTA和2mmol/L DTT。
具体步骤如下:在 900μL反应缓冲液中,将50μL酶液与50μL浓度为10μmol/L的荧光底物充分混合,在55℃水浴反应10min后立刻用1.5mL终止液终止反应。反应释放出的7-氨基-4-甲基香豆素(7-amino-4-methycoumarin,AMC)用荧光分光光度计在激发光波长为380nm和发射光波长为450nm下进行测定。对照组的反应条件一致,除用缓冲液代替荧光底物。酶活力单位(Units)定义为每分钟释放1nmol AMC所需要的酶量。
1.2.3 组织蛋白酶B的性质分析
1.2.3.1 温度对酶活力的影响 温度对酶活力的影响是在0.1mol/L的乙酸钠缓冲液(pH5.5)中,将组织蛋白酶B在不同温度(20~70℃)下反应10min后,测定其酶活力。以反应温度为横坐标,组织蛋白酶B的相对酶活力为纵坐标作图。
1.2.3.2 pH对酶活力的影响 pH对酶活力的影响是在0.1mol/L不同pH缓冲液(pH3.0~8.0)中,组织蛋白酶B在55℃下反应10min,测定其酶活力。以反应pH为横坐标,组织蛋白酶B相对酶活力为纵坐标作图。其中所用不同pH缓冲液为:0.1mol/L乙酸钠缓冲液(pH3.0~5.5)、0.1mol/L磷酸盐缓冲液(pH6.0~7.0)和0.1mol/L Tris-HCl缓冲液(pH8.0)。
1.2.3.3 底物特异性研究 底物特异性是在0.1mol/L的乙酸钠缓冲液(pH5.5)中,组织蛋白酶 B与10μmol/L的不同类型的荧光底物混合均匀,按酶活测定方法测定其对不同类型底物的水解程度。以水解Z-Phe-Arg-MCA荧光底物为对照。所用荧光底物有:Z-Phe-Arg-MCA,Z-Arg-Arg-MCA,Arg-MCA,Boc-Phe-Ser-Arg-MCA,Boc-Gln-Arg-Arg-MC,Boc-Leu-Arg-Arg-MCA,Suc-Ala-Ala-Pro-Phe-MCA,Suc-Leu-Leu-Val-Tyr-MCA。
1.2.3.4 不同抑制剂对酶活力的影响 抑制剂对酶活力的影响是在0.1mol/L的乙酸钠缓冲液(pH5.5)中,组织蛋白酶B与不同类型的抑制剂混合均匀,在4℃下孵育30min后,测定其剩余的酶活力。对照样品的反应条件一致,但不加任何抑制剂。所用抑制剂有:E-64、Chymostatin、Leupeptin、EDTA和PMSF。
1.2.4 组织蛋白酶B对肌原纤维蛋白的作用
1.2.4.1 肌原纤维蛋白的制备 由于蓝圆鲹肌肉肌原纤维蛋白(myofibrillar protein,MF)在55℃下,其自身会发生明显的降解[11],因此,选择自身降解较慢的罗非鱼肌原纤维为蛋白降解底物更为合理。肌原纤维的制备主要参照Yanagihara等人[12]的方法。具体如下:新鲜蓝圆鲹取其背部肌肉,加入4倍鱼肉重量的20mmol/L Tris-HCl缓冲液(pH7.0)进行组织捣碎。在8,000×g离心10min,取沉淀部分重复上述步骤 4次后,沉淀部分用含 0.5mol/L NaCl的20mmol/L Tris-HCl缓冲液(pH7.0)充分溶解,悬浊液在12,000×g离心20min,用绢布过滤,取上清部分,即为肌原纤维蛋白。
1.2.4.2 组织蛋白酶 B对肌原纤维蛋白降解的影响 在含有0.5mol/L NaCl和5mmol/L L-半胱氨酸的0.1mol/L乙酸钠缓冲液(pH5.5)中,将50μL浓度为6mg/mL的蓝圆鲹 MF与30μL酶活力单位为20U/mg的组织蛋白酶B充分混合,在55℃下反应不同时间。时间梯度为:0、15、30、60、120、180、240、300min。孵育不同时间后,样品与上样缓冲液和5%巯基乙醇充分混合,于95℃加热10min。样品进行SDS-PAGE电泳分析,观察肌原纤维蛋白的降解情况。
2 结果与讨论
2.1 组织蛋白酶B的分离纯化
样品经过预处理和硫酸铵盐析后,上样于SPSepharose阳离子交换层析柱。由图1(A)可知,目的蛋白吸附于SP-Sepharose层析柱,而大量的杂蛋白未被层析柱吸附,因此该层析柱能有效地将杂蛋白与目的蛋白分开。吸附部分的蛋白质用含0~1mol/L NaCl的缓冲液进行线性洗脱,有2个水解Z-Phe-Arg-MCA的酶活峰被洗脱下来。其中,前者为组织蛋白酶B,后者为组织蛋白酶L。在底物特异方面,组织蛋白酶B与L有着明显的区别,组织蛋白酶L只分解荧光底物Z-Phe-Arg-MCA,而组织蛋白酶B不仅水解Z-Phe-Arg-MCA,同是也分解Z-Arg-Arg-MCA荧光底物。因此,本研究的目的蛋白组织蛋白酶B约在0.2mol/L NaCl的盐浓度下被洗脱下来。将活性峰超滤浓缩后上样于Sephacryl S-200 HR凝胶过滤层析柱,结果如图1(B)所示。对活性部分进行电泳分析,由SDS-PAGE电泳图谱结果(图2)可知纯化得到分子量约为27ku左右的单一蛋白条带。有研究结果表明,鱼类肌肉中的组织蛋白酶B的分子量约为24~29ku,比组织蛋白酶L的分子量相对低。如花腹鲭鱼为 28ku[9],白腹鲭鱼(Scomber japonicus)为23ku[13]。根据分子量和底物特异性的结果推测本研究纯化得到的单一条带为组织蛋白酶B。从蓝圆鲹肌肉650g中可纯化得到0.4mg组织蛋白酶B,得率约为3%,纯化倍数为2619.3倍。

表1 蓝圆鲹组织蛋白酶B的纯化表Table 1 Summary of purification of cathepsin B from blue scad(Decapterus maruadsi)
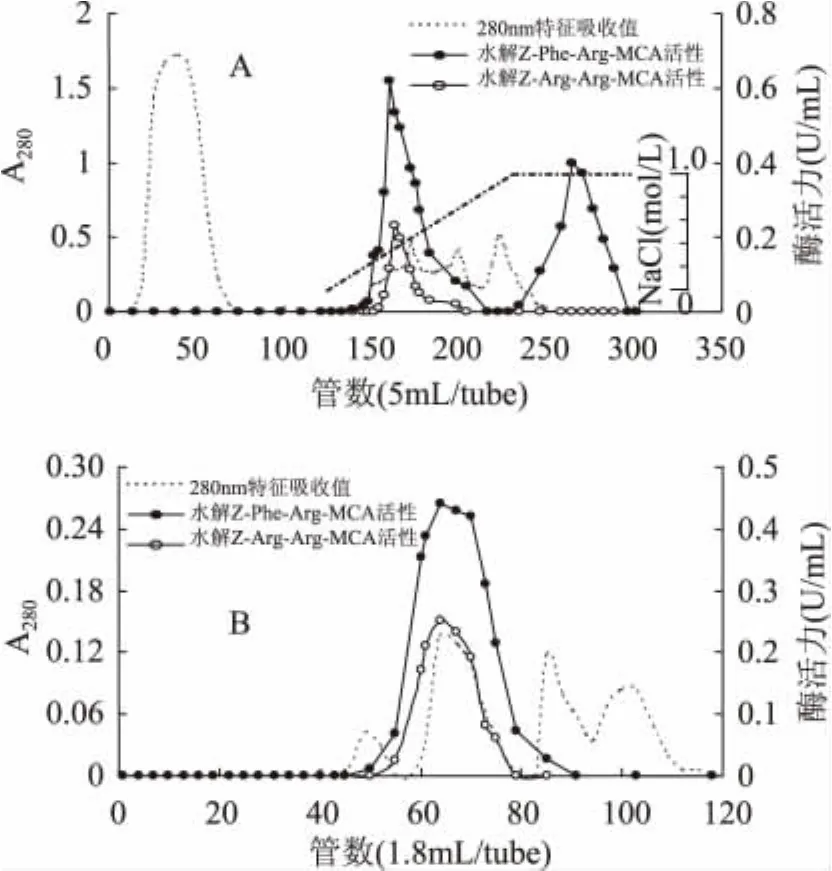
图1 蓝圆鲹组织蛋白酶B纯化柱层析图Fig.1 Chromatographic purification of cathepsin B from blue scad(Decapterus maruadsi)
2.2 温度和pH对酶活力的影响

图2 蓝圆鲹组织蛋白酶B纯化过程的SDS-PAGE图谱Fig.2 SDS-PAGE of cathespin B from blue scad (Decapterus maruadsi)in the purification processing
如图3(A)所示,蓝圆鲹肌肉中组织蛋白酶B的最适温度为55℃。当温度为20℃时,组织蛋白酶B仅表现出最适温度时30%左右的酶活力;当温度为70℃时,由于高温引起的蛋白变性,组织蛋白酶B的活性下降很快,仅为最适温度时的10%左右。该结果与Jiang等人[9]从鲭鱼中分离出组织蛋白酶B的温度性质表现相似。
如图3(B)所示,组织蛋白酶B的最适pH为5.5。当pH为4.0时,组织蛋白酶B酶活力相对较弱,仅有最适pH时50%的活性;当pH大于7.0时,组织蛋白酶B酶活性下降很快,直至pH8.0时,该酶几乎不表现酶活力。鲭鱼[9]和大马哈鱼(Oncorhynchus keta)[14]中都得到相似的结果。因此,鱼糜经过清水或者碱水漂洗后,组织蛋白酶B的活性有大部分的损失,但是仍然有部分的残留[6]。由于鱼糜凝胶劣化常常发生在55~60℃的温度区域,组织蛋白酶B的最适温度与该温度区域一致,因此,推测残留的组织蛋白酶B可能在该温度下表现出一定的酶活力,从而促进肌原纤维蛋白的降解。
2.3 底物特异性研究
组织蛋白酶B对荧光底物的水解作用表现专一。如表2所示,其仅对组织蛋白酶底物中的Z-Phe-Arg-MCA和Z-Arg-Arg-MCA产生强烈分解,而对其他类型的荧光底物,包括胰蛋白酶类底物Boc-Glu-Arg-Arg-MCA、Boc-Leu-Arg-Arg-MCA和Boc-Phe-Ser-Arg-MCA、胰凝乳蛋白酶底物Suc-Ala-Ala-Pro-Arg-MCA和Suc-Leu-Leu-Val-Tyr-MCA以及氨肽酶和组织蛋白酶H的底物Arg-MCA都表现出不分解或者分解程度很低。

图3 蓝圆鲹组织蛋白酶B的最适温度(A)和最适pH(B) Fig.3 Optimal temperature(A)and pH(B)of cathepsin B from blue scad(Decapterus maruadsi)
底物特异性是区别组织蛋白酶B与组织蛋白酶L的重要区别之一。2种组织蛋白酶对底物的水解作用都十分专一,只分解组织蛋白酶类的底物。但组织蛋白酶L仅分解在P2位为芳香族氨基酸残基的Z-Phe-Arg-MCA荧光底物[15-16],而组织蛋白酶B不仅对Z-Phe-Arg-MCA荧光底物有强烈的分解,对Z-Arg-Arg-MCA也有明显的水解作用[9,13]。

表2 组织蛋白酶B的底物特异性Table 2 Substrate specificity of cathepsin B
2.4 不同抑制剂对酶活力的影响
蛋白酶抑制剂E-64、Leupeptin和Chymostatin对组织蛋白酶B有强烈的抑制效果。如表3所示。当E-64浓度为0.01mmol/L、Chymostatin和 Leupeptin浓度为0.1mmol/L时,几乎可以完全抑制组织蛋白酶B的酶活力。Chymostatin和Leupeptin不仅是半胱氨酸蛋白酶抑制剂,同时也分别是胰凝乳蛋白酶和丝氨酸蛋白酶抑制剂。丝氨酸蛋白酶抑制剂PMSF对组织蛋白酶B没有表现明显的抑制作用。金属蛋白酶抑制剂EDTA的浓度为20mmol/L时,对组织蛋白酶B有微弱的抑制,但当其浓度为5mmol/L时表现出部分激活的作用。EDTA是巯基活性剂,因此证明组织蛋白酶B是一种巯基蛋白酶,该结果与Masahiro等人[13]对白腹鲭鱼的研究结果相似。
2.5 组织蛋白酶B对肌原纤维的作用
本实验室之前的研究表明,蓝圆鲹肌原纤维蛋白在55℃下自身降解较快[11],难于判断外加组织蛋白酶B对其降解的影响,因此选择自身降解较慢的罗非鱼肌原纤维为实验原料更为合理。如图4所示,组织蛋白酶B与罗非鱼肌原纤维蛋白在55℃,pH5.5下反应,当反应时间为120min时,肌球蛋白重链(Myosin heavy chain,MHC)发生明显的降解作用。当反应时间延长到300min时,MHC几乎降解80%。相比于对MHC的降解,组织蛋白酶B对肌动蛋白和原肌球蛋白的作用并不明显。因此,组织蛋白酶B较容易作用于MHC的降解,进而影响肌原纤维蛋白的结构稳定。Jiang等人对鲭鱼的组织蛋白酶B[9]的研究也指出,该蛋白酶对于鲭鱼肌原纤维中的MHC的降解有明显的促进作用[2],与本研究的结果相似。

表3 抑制剂对组织蛋白酶B活力的影响Table 3 Effect of inhibitor on cathepsin B
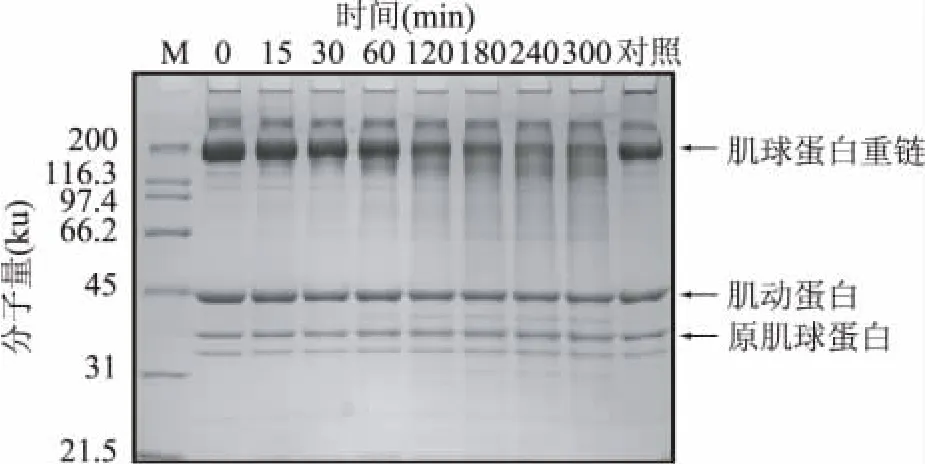
图4 蓝圆鲹组织蛋白酶B对肌原纤维蛋白降解的影响Fig.4 Effect of cathepsin B from blue scad (Decapterus maruadsi)on degradation of myofibrillar proteins
据报道,鱼糜的凝胶劣化常常发生在温度55~60℃。因此,鱼体中最适温度为55~60℃的酶类应该受到更多的关注。组织蛋白酶B与L相似,其最适温度为55℃[9,16],该酶是一种热稳定的蛋白酶。在鱼糜的生产过程中,鱼肉通常在冰水或者低浓度的碱水中反复漂洗,去除肌浆中的蛋白酶及色素等其它物质。组织蛋白酶B不仅是水溶性的蛋白酶,同时也是酸性蛋白酶。虽然经过反复的漂洗,但是组织蛋白酶B仍不能完全被去除,李树红等人[6]的研究发现,经过2次清水和1次盐水漂洗后,鲢鱼肌肉中的组织蛋白酶B残留率为11.46%。这些残留的组织蛋白酶B仍可能促进肌原纤维的降解。虽然众多研究认为组织蛋白酶L在鱼体肌原纤维的降解和鱼糜凝胶劣化中起着重要的作用[16-17],但是组织蛋白酶B与L的性质相似,该酶在鱼体中的作用也十分的重要。Jiang等人[2]研究鲭鱼中的肌原纤维降解时,发现添加一定量的组织蛋白酶B时,对肌原纤维蛋白的降解有着明显的促进作用,因此,认为组织蛋白酶B与肌原纤维蛋白的降解也有着密切的关系,该结论与本实验的结果相似。尽管组织蛋白酶B在中性pH下对蛋白的分解作用比肌原纤维结合型丝氨酸蛋白酶[4-5]弱,但在其酶学最适条件下,对肌原纤维蛋白的分解,尤其是对MHC,有着明显的促进作用。因此,在鱼糜制品生产过程中,抑制残留的组织蛋白酶B的活性,将有可能减少鱼肉肌原纤维蛋白的降解作用,部分解决鱼糜凝胶劣化的问题。
3 结论
从蓝圆鲹肌肉中分离纯化得到组织蛋白酶B,其分子量约为27ku,得率约为3%,纯化倍数为2619.3倍。纯化的组织蛋白酶B能够被半胱氨酸蛋白酶抑制剂E-64、Leupeptin和Chymostatin强烈抑制。同时,低浓度的EDTA可以激活组织蛋白酶B的酶活力,推测组织蛋白酶B也是一种巯基蛋白酶。在温度为55℃和pH5.5时,组织蛋白酶B表现最大的酶活力。在该条件下,组织蛋白酶B能够促进肌原纤维蛋白的降解作用,尤其是肌球蛋白重链(MHC)的分解。
[1]农业部渔业局.中国渔业年鉴2010[M].北京:中国农业出版社,2010:187.
[2]Jiang S T,Lee B L,Tsao C Y,et al.Mackerel cathepsins B and L effects on thermal degradation of surimi[J].Journal of Food Science,1997,62(2):310-315.
[3]Liu H,Yin L,Li S,et al.Effects of endogenous cathepsins B and L on degradation of silver carp(Hypophthalmichthys Molitrix) myofibrillar proteins[J].Journal of Muscle Foods,2008,19(2): 125-139.
[4]Cao M J,Jiang X J,Zhong H C,et al.Degradation of myofibrillar proteins by a myofibril-bound serine proteinase in the skeletal muscle of crucian carp(Carasius auratus)[J].Food Chemistry,2006,94(1):7-13.
[5]Cao M J,Hara K,Osatomi K,et al.Myofibril-bound serine proteinase(MBP)and its degradation of myofibrillar proteins[J]. Journal of Food Science,1999,64(4):644-647.
[6]李树红,张楠,刘欢,等.鲢鱼背肌肌原纤维蛋白自溶与内源组织蛋白酶B,L,H的关系[J].中国农业大学学报,2004,9 (5):71-75.
[7]Jiang S T,Lee J J,Chen H C.Proteolysis of actomyosin by cathepsins B,L,L-like,and X from mackerel(Scomber australasicus)[J].Journal of Agricultural and Food Chemistry,1996,44(3):769-773.
[8]Liu H,Yin L,Zhang N,et al.Isolation of cathepsin B from the muscle ofsilver carp(Hypophthalmichthysmolitrix)and comparison of cathepsins B and L actions on surimi gel softening[J].Food Chemistry,2008,110(2):310-318.
[9]Jiang S T,Lee J J,Chen H C.Purification and characterization of cathepsin B from ordinary muscle of mackerel(Scomber australasicus)[J].Journal of Agricultural and Food Chemistry,1994,42(5):1073-1079.
[10]Barrett A J,Kirschke H.Cathepsin B,cathepsin H,and cathepsin L[J].Methods Enzymol,1981,80:535-561.
[11]Sun L C,Yoshida A,Cai Q F,et al.Mung bean trypsin inhibitor is effective in suppressing the degradation of myofibrillar proteins in the skeletal muscle of blue scad(Decapterus maruadsi)[J].Journal of Agricultural and Food Chemistry,2010,58(24): 12986-12992.
[12]Yanagihara S,Nakaoka H,Hara K,et al.Purification and characterization of serine proteinase from white croaker skeletal muscle[J].Nippon Suisan Gakkaishi,1991,57(1):133-142.
[13]Matsumiya M,Mochizuki A,Otake S.Purification and characterization of cathepsin B from ordinary muscle of common mackerelScomber japonicus[J].Nippon Suisan Gakkaishi,1989,55(12):2185-2190.
[14]Yamashita M,Konagaya S.Purification and characterization of cathepsin B from thewhite muscleofchum salmon,Oncorhynchus keta[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1990,96(4):733-737.
[15]Visessanguan W,Benjakul S,An H.Purification and characterization of cathepsin L in arrowtooth flounder(Atheresthes stomias)muscle[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2003,134(3): 477-487.
[16]Liu H,Yin L,Zhang N,etal.Purification and characterization of cathepsin L from the muscle of silver carp (Hypophthalmichthys molitrix)[J].Journal of Agricultural and Food Chemistry,2006,54:9584-9591.
[17]Hu Y,Morioka K,Itoh Y.Participation of cysteine protease cathepsin L in the gel disintegration of red bulleye(Priacanthus macracanthus)surimi gel paste[J].Journal of the Science of Food and Agriculture,2010,90(3): 370-375.
Purification and characterization of cathepsin B from the skeletal muscle of blue scad(Decapterus maruadsi)
ZHONG Chan,SHEN Jian-dong,CAI Qiu-feng,WENG Wu-yin,CAO Min-jie*(College of Biological Engineering,Jimei University,Xiamen 361021,China)
During the manufacturing process of surimi,the modori phenomenon was an important factor that affected the final quality of the products.According to current studies,cathepsin B in the lysosome played a significant role in the degradation of myofibillar proteins.Cathepsin B in the muscle of various species of fish had been investigated.However,cathepsin B in marine fish blue scad(Decapterus maruadsi)was infrequently reported.In the present study,cathepsin B was purified by ammonium sulfate precipitation and a series of column chromatographies.SDS-PAGE showed that the molecular mass of the purified enzyme was about 27ku.The optimal temperature and pH of the enzyme were 55℃ and 5.5,respectively.Cathepsin B was effectively inhibited by cysteine proteinase inhibitor E-64.Under optimal conditions,cathepsin B could promote the degradation of myofibrillar proteins.Therefore,cathepsin B might participate in not only degradation of myofibrillar proteins,but also modori at acidic pH range.
Decapterus maruadsi;cathepsin B;characterization;myofibrillar protein
TS201.2+5
A
1002-0306(2012)10-0108-05
2011-10-13 *通讯联系人
钟婵(1986-),女,硕士研究生,主要从事食品生物技术方面的研究。
国家自然科学基金(31071519);厦门市科技计划项目(3502Z20111042)。

