Clostridium bolteae ATCC BAA-613 D-塔格糖3-差向异构酶的诱导表达、纯化及活性研究
储菲菲,沐万孟,邢庆超,周榴明,张 涛,江 波,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.罗盖特美国公司,基奥卡克52632,美国)
Clostridium bolteae ATCC BAA-613 D-塔格糖3-差向异构酶的诱导表达、纯化及活性研究
储菲菲1,沐万孟1,邢庆超1,周榴明2,张 涛1,江 波1,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.罗盖特美国公司,基奥卡克52632,美国)
D-塔格糖3-差向异构酶是生物法生产新型功能性因子D-阿洛酮糖最为有效的酶。一种新型的能够编码D-塔格糖3-差向异构酶的基因CLOBOL_00069被克隆,它来源于Clostridium bolteae ATCC BAA-613。以pUC57为克隆载体,以pET-22b(+)为载体质粒,E.coli BL21(DE3)为宿主细胞,构建了基因重组工程菌。IPTG诱导剂诱导目的蛋白的表达;通过镍柱亲和层析,杂蛋白与目的蛋白得到了很好的分离。对纯化的重组蛋白样品进行SDS-PAGE分析,在约32ku处出现明显的特征条带。通过活性研究表明,Clostridium bolteae ATCC BAA-613 DTEase属于DTEase家族,并具有较高的生物转化率,反应10h后转化率达到20%。
D-塔格糖3-差向异构酶,D-阿洛酮糖,基因重组,亲和层析
D-阿洛酮糖是一种在自然界中较为稀有的天然己酮糖,属于稀有糖的一种,是D-果糖的差向异构体。D-阿洛酮糖是近年发现的一种具有特殊保健功能的新型功能性因子,它的热量值只有0.007kcal/g[1];具有降低血糖的生理功能[2]和可抑制肝脏脂肪合成酶活性,减少脂肪沉积的作用[3];体外实验发现它具有神经保护作用,可抑制6-羟基多巴胺诱导的小鼠嗜铬细胞瘤细胞凋亡[4];与D-葡萄糖和D-果糖相比,具有较强的清除活性氧的能力[5]。所以,由于其优良的功能性质而受到人们的广泛关注,具有巨大的市场前景。D-塔格糖3-差向异构酶(D-tagatose 3-epimerase,DTE,EC5.3.1.-)家族则是实现D-阿洛酮糖生物法生产的重要生物催化剂,可以催化D-果糖异构化为D-阿洛酮糖。因此鉴于D-塔格糖3-差向异构酶的重要应用价值,国内外研究者已发现了几种属于DTEase家族的酶,如Pseudomonas cichorii DTEase[6-8]、AgrobacteriumtumefaciensDPEase[9-10]、Rhodobacter sphaeroidesSK011 DTEase[11-12]和Clostridium cellulolyticumDTEase[13],它们异构化果糖的效率分别为20%、32%、17%和30%。本文以Clostridium bolteaeATCC BAA-613 DTE基因组为模板,通过基因合成获得DTEase的编码基因CLOBOL_ 00069,以pET-22b(+)为载体,构建获得重组质粒pET22b-cb-dte,并在大肠杆菌中实现成功表达,表达产物DTEase被鉴定具有生物活性,可以由D-果糖差向异构化为D-阿洛酮糖,证明Clostridium bolteaeDTEase属于DTEase家族,并具有较高的生物转化率。
1 材料与方法
1.1 实验材料
载体E.coliDH5α、载体E.coliBL21(DE3)、T4 DNA连接酶、DNA聚合酶、脱氧核苷三磷酸、质粒抽提试剂盒 均购自生工生物工程(上海)有限公司;表达载体pET-22b(+)、克隆载体pUC57 均购自上海闪晶分子生物技术有限公司;Wide Range DNA Marker(500~15000bp)、限制性内切酶Nde I和Xho I、Isopropyl β-D-1-thiogalactopyranoside(IPTG)等 购于TaKaRa(宝生物工程有限公司,大连);低分子量标准蛋白Marker 购于中科院上海生物化学研究所;Chelating Sepharaose Fast Flow 购自GE(乌普萨拉,瑞典);D-阿洛酮糖标准品 购于Sigma公司。
1.2 实验方法
1.2.1Clostridium bolteaeATCC BAA-613 DTEase基因的克隆 上海闪晶分子生物技术有限公司通过基因合成技术合成目的基因CLOBOL_00069。同时,将Nde I和Xho I酶切位点引入上下游引物5’端。然后再将其产物克隆入pUC57克隆载体上,以此得到重组质粒pUC57-cb-dte。
1.2.2Clostridium bolteaeATCC BAA-613 DTEase基因的亚克隆 用Nde I、Xho I双酶切表达载体pET-22b(+)和重组质粒pUC57-cb-dte。而后,将回收到的目的片段与表达载体相连,连接产物转化至宿主菌E.coliDH5α,并涂布于LB固体培养基上,于37℃培养12h。LB固体培养基配比:胰蛋白胨1%(w/v),酵母提取物0.5%(w/v),氯化钠1%(w/v),琼脂粉1.5%(w/v)。挑取白色菌落37℃培养,抽提质粒进行酶切鉴定。
1.2.3Clostridium bolteaeATCC BAA-613 DTEase基因工程菌的构建 通过1.2.2中的筛选与鉴定,获得重组质粒阳性克隆pET22b-cb-dte,将该重组质粒转化至表达宿主菌E.coliBL21(DE3)中,以此获得基因工程重组菌E.coliBL21/pET22b-cb-dte。
1.2.4Clostridium bolteaeATCC BAA-613 DTEase的诱导表达优化 挑取基因工程菌E.coliBL21/pET22bcb-dte的单菌落,接种于小体积的含氨苄抗生素(终浓度50μg/mL)的LB液体培养基中进行活化,在200r/min,37℃条件下振荡培养10h。接着,再按4%接种量将其接种至大体积的LB培养基中,同条件下振荡培养,当菌体的OD600值为0.6~0.8时,加入一定浓度的IPTG低温诱导蛋白的表达。为了得到大量的目的蛋白,因此选择了诱导剂浓度、诱导时间、诱导温度等三个因素对诱导表达进行初步的优化。
1.2.4.1 诱导剂浓度对目的蛋白表达的影响 加入终浓度分别为0、0.1、0.5、1、1.5、2mmol/L的诱导剂IPTG,固定其他条件:在200r/min振荡条件下,诱导温度28℃,诱导时间5h。
1.2.4.2 诱导时间对目的蛋白表达的影响 选择不同的诱导时间0、1、2、3、4、5、6h,固定其他条件:在200r/min振荡条件下,诱导剂IPTG浓度0.5mmol/L,诱导温度28℃。每隔1h取菌液进行SDS-PAGE电泳分析。
1.2.4.3 诱导温度对目的蛋白表达的影响 选择不同的诱导温度0、10、15、20、28、35℃,固定其他条件:在200r/min振荡条件下,诱导剂IPTG浓度0.5mmol/L,诱导时间5h。
1.2.5 表达产物的SDS-PAGE验证 取诱导后的菌液,加入SDS样品缓冲液,混匀后煮沸几分钟,高速离心约1min,取20μL上清液进行SDS-PAGE电泳分析(4%浓度的浓缩胶,12%浓度的分离胶)。
1.2.6Clostridium bolteaeATCC BAA-613 DTEase的分离纯化 低温离心(8000×g,15min,4℃)收集菌体,然后以缓冲液(100mmol/L NaCl,50mmol/L Tris-HCl,pH7.5)重悬菌体,超声波破碎大肠杆菌细胞5min(300W,开1s/关1s)后,低温离心(10000×g,20min,4℃)弃细胞碎片,收集上清液进行以下层析纯化。
采用Ni2+-Chelating Sepharose Fast Flow亲和层析柱(1.0cm×10.0cm),对重组的Clostridium bolteaeDTEase进行纯化。上柱前预先用平衡液(100mmol/L NaCl,50mmol/L Tris-HCl,pH7.5)平衡层析柱,蛋白酶液上柱后以洗涤液(平衡液+50mmol/L咪唑)洗脱杂蛋白,再用洗脱液(平衡液+500mmol/L咪唑)洗脱目的蛋白,最后用透析液(50mmol/L NaCl,50mmol/L Tris-HCl,pH7.5)对目的蛋白酶液进行透析。以上操作均在4℃低温条件下进行。所得纯化的重组蛋白用SDS-PAGE进行电泳分析。
1.2.7 Folin-酚法测定纯化的重组蛋白浓度 取0.2mL纯化过的酶液,加水补足至1.0mL,然后加5mL试剂甲,在旋涡混合器上迅速混合,于室温20~25℃放置10min。再逐管加入0.5mL试剂乙(Folin-酚试剂),同样立即混匀,然后在室温下放置30min,最后于650nm处测定管中溶液的吸光度值。蛋白浓度测定按《蛋白质技术手册》[13]设计操作,根据标准曲线算出重组蛋白浓度。
1.2.8Clostridium bolteaeATCC BAA-613 DTEase的酶活性鉴定 为鉴定该酶的生物活性,利用全细胞Clostridium bolteaeATCC BAA-613 DTEase和纯化后的Clostridium bolteaeATCC BAA-613 DTEase进行果糖转化实验。DTEase可催化D-果糖生成D-阿洛酮糖,而D-果糖和D-阿洛酮糖含量可通过高效液相色谱法进行测定。HPLC条件:Waters Sugarpak-1钙型阳离子交换柱,Agilent 1200高效液相色谱仪,Shodex示差折光检测器。流动相:纯水;流速:0.4mL/min;柱温:85℃;进样量:10μL。
1.2.9Clostridium bolteaeATCC BAA-613 DTEase的催化效率研究 DTEase可催化D-果糖生成D-阿洛酮糖,将D-果糖(200mg/mL),Tris-HCl缓冲液(50mmol/L,pH7.0)和1U/mL的酶混合,45℃水浴,120r/min振荡条件下进行转化反应,每间隔1h取样测定生成的D-阿洛酮糖的含量。底物D-果糖与产物D-阿洛酮糖含量可通过HPLC进行测定。
2 结果与讨论
2.1 重组表达质粒的构建、酶切鉴定及序列分析
能够编码Clostridium bolteaeATCC BAA-613 DTEase的目的基因CLOBOL_00069通过基因合成获得,将其克隆至pUC57载体质粒中,再经亚克隆将目的片段连接至表达载体质粒pET-22b(+)中,连接产物转化至宿主菌E.coliDH5α,挑取白色菌落37℃培养,抽提质粒进行鉴定(图1)。

图1 Clostridium bolteae ATCC BAA-613 DTEase质粒抽提鉴定Fig.1 Plasmid extraction analysis of Clostridium bolteae ATCC BAA-613 DTEase
将获得的重组表达质粒pET22b-cb-dte经Nde I、Xho I双酶切和Nde I单酶切,酶切后将产物进行琼脂糖凝胶电泳,pET22b-cb-dte限制性酶切鉴定结果见图2。重组质粒pET22b-cb-dte经双酶切后得到pET-22b(+)表达载体线性片段和插入的目的基因CLOBOL_00069,目的基因片段大小约为800bp,该片段与编码Clostridium bolteaeATCC BAA-613 DTEase基因大小相同,表明重组质粒构建成功。

图2 重组质粒pET22b-cb-dte鉴定酶切图Fig.2 Restriction enzymatic analysis of recombinant plasmid pET22b-cb-dte
通过NCBI Blast分析,目的基因编码的氨基酸序列与之前报道过的DTEase家族Agrobacterium tumefaciensDPEase,Pseudomonas cichoriiDTEase,Rhodobacter sphaeroidesDTEase和ClostridiumcellulolyticumDTEase比较,有相对较高的氨基酸序列同源性,分别为49.48%、35.84%、29.10%和51.86%。
2.2 基因工程菌的诱导表达优化
为了得到大量的目的蛋白,对重组菌E.coliBL21/ pET22b-cb-dte的诱导表达进行了初步的优化,因此选择了诱导剂浓度、诱导时间、诱导温度等三个因素来进行研究。
2.2.1 诱导剂浓度对重组菌表达的影响 选择加入不同终浓度的诱导剂IPTG,固定其他条件:在200r/min振荡条件下,诱导温度28℃,诱导时间5h。从图3可以看出,最适的IPTG终浓度为0.5mmol/L,IPTG的浓度过高将导致杂蛋白的过量表达,相应的酶活将降低。
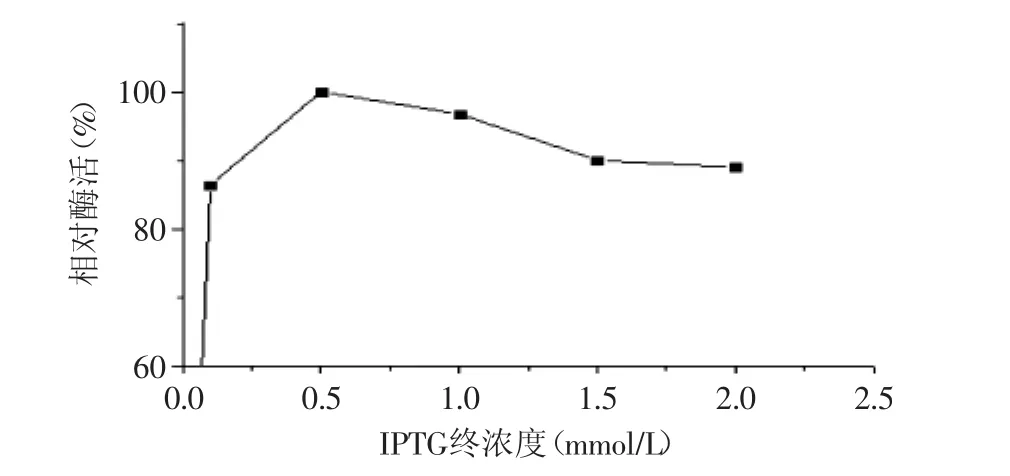
图3 IPTG终浓度对重组菌表达的影响Fig.3 Effect of IPTG concentration on the expression of recombinant strains
2.2.2 诱导时间对重组菌表达的影响 在28℃温度下,0.5mmol/L的IPTG诱导5h可达到最高表达产物量(图4),5h以后,随着诱导时间的延长,诱导量不再增加。表达产物SDS-PAGE分析结果所示,重组菌株经诱导表达后,约在32ku处明显出现特征蛋白条带。

图4 重组质粒pET22b-cb-dte在E.coli BL21(DE3)中的表达Fig.4 pET22b-cb-dte expression in E.coli BL21(DE3)
2.2.3 诱导温度对重组菌表达的影响 选择不同的诱导温度,固定其他条件:在200r/min振荡条件下,诱导剂IPTG浓度0.5mmol/L,诱导时间5h。从图5可以发现,高温诱导将导致酶活的迅速下降,所以为了防止目的蛋白DTEase形成大量包涵体,使用低温诱导温度。但是诱导温度过低,也不利于目的蛋白大量表达,所以选择的最适诱导温度为20℃。
2.3 Clostridium bolteae ATCC BAA-613 DTEase的纯化与蛋白含量测定
纯化后的重组DTEase样品进行SDS-PAGE分析(图6),该重组DTEase的亚基分子量约为32ku,进一步说明外源基因在宿主菌中得到了正确的表达。同时,目的蛋白经镍柱亲和层析后得到单一的蛋白条带,目的蛋白浓度达到90%以上,说明使用该方法可以很好地纯化目的蛋白。
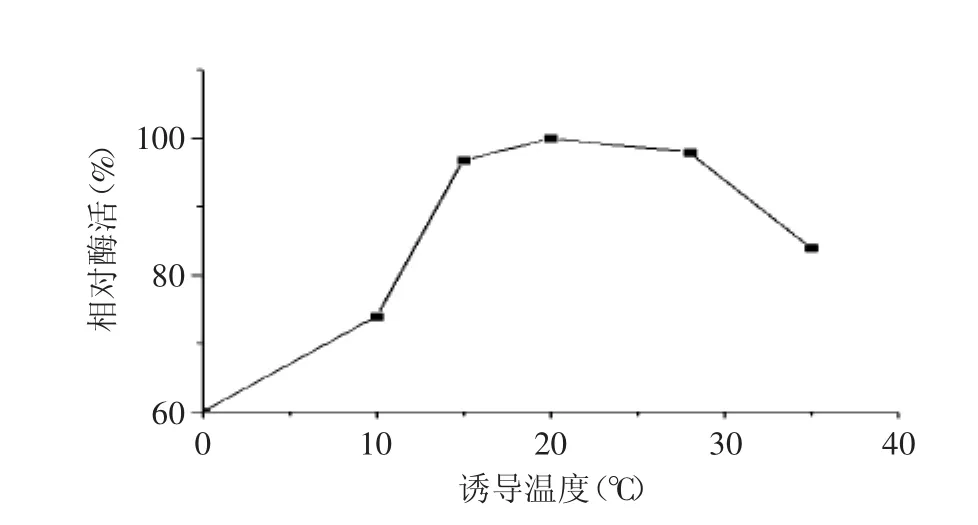
图5 诱导温度对重组菌表达的影响Fig.5 Effect of induction temperature on the expression of recombinant strains
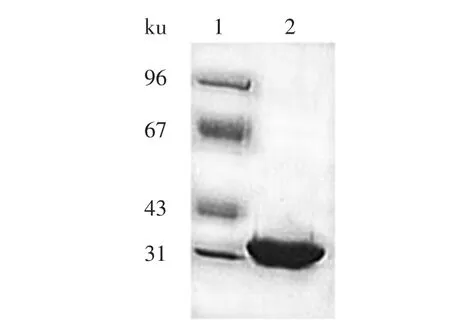
图6 SDS-PAGE电泳分析纯化后目的蛋白Fig.6 SDS-PAGE analysis of the purified target protein
2.4 Clostridium bolteae ATCC BAA-613 DTEase的酶活性鉴定
利用纯化后的Clostridium bolteaeATCC BAA-613 DTEase和全细胞Clostridium bolteaeATCC BAA-613 DTEase进行果糖转化实验(图7a和图7b),果糖与D-阿洛酮糖含量均可通过高效液相色谱法进行测定,图中果糖与D-阿洛酮糖的标样保留时间分别约为14.6min和20.8min(图7c和7d)。结果表明,Clostridium bolteaeATCC BAA-613 DTEase能够催化果糖生成D-阿洛酮糖,纯化后的酶活性更高,由此证明该酶属于DTEase家族。
2.5 Clostridium bolteae ATCC BAA-613 DTEase的催化效率研究
反应条件为45℃,pH7.0,在20%(w/v)的D-果糖反应体系中,反应10h产物含量达到最大,转化率为20%(图8),10h后产量略有下降,这与产物的抑制作用有关。目前,国外已经报道过的DTEase家族中的成员Agrobacterium tumefaciensDPEase[9-10]、Pseudomonas cichoriiDTEase[6-8]、Rhodobacter sphaeroidesDTEase[11-12]和Clostridium cellulolyticumDTEase[13]异构化果糖的效率分别为32%、20%、17%和30%。
通过Clostridium bolteaeATCC BAA-613 DTEase催化果糖生产D-阿洛酮糖,表明该新型酶具备工业化生产D-阿洛酮糖的潜能。
3 结论
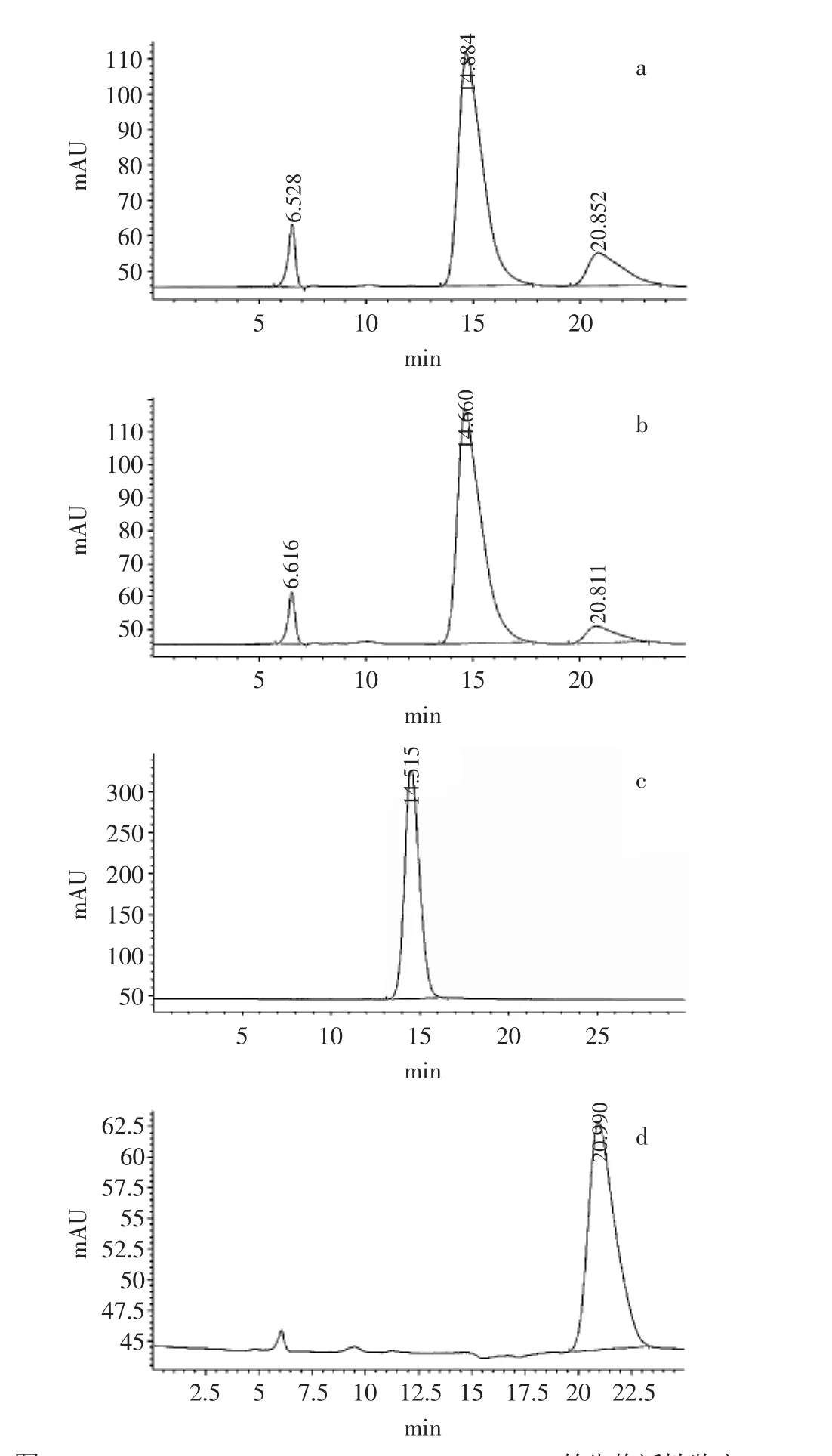
图7ClostridiumbolteaeATCCBAA-613DTEase的生物活性鉴定Fig.7 Bioactivity analysis of Clostridium bolteae ATCC BAA-613 DTEase
本研究以Clostridium bolteaeATCC BAA-613的基因组DNA为模版,通过基因合成获得DTEase的编码基因CLOBOL_00069,将其成功转化至表达菌E.coliBL21(DE3)中获得基因工程菌。在28℃温度下,添加0.5mmol/L的IPTG,诱导5h,表达产物达到最大量。经亲和层析纯化的蛋白酶液进行SDS-PAGE电泳分析,约在32ku处出现显著的单一蛋白条带,证明了Clostridium bolteaeATCC BAA-613 DTEase在大肠杆菌中得到了正确的表达。同时对Clostridium bolteaeDTEase的酶催化活性进行了研究,发现在45℃条件下,全细胞反应10h,D-阿洛酮糖的转化率为20%,说明在工业应用上该新型酶具备生产D-阿洛酮糖的潜能。
[1]Matsuo T,Suzuki H,Hashiguchi M,et al.D-psicose is a rare sugar that provides no energy to growing rats[J].J Nutr Sci Vitaminol,2002,48:77-80.
[2]Matsuo T,Izumori K.Effects of dietary D-psicose on diurnal variation in plasma glucose and insulin concentrations of rats[J]. Biosci Biotechnol Biochem,2006,70:2081-2085.
[3]Matsuo T,Baba Y,Hashiguchi M,et al.Dietary D-psicose,a C-3 epimer of D-fructose,suppresses the activity of hepatic lipogenic enzymes in rats[J].Asia Pac J Clin Nutr,2001,10:233-237.
[4]Suna S,Yamaguchi F,Kimura S,et al.Preventive effect of D-psicose,one of rare ketohexoses,on di-(2-ethylhexyl)phthalate(DEHP)-induced testicular injury in rat[J].Toxicol Lett,2007,173(2):107-117.
[5]Murata A,Sekiya K,Watanabe Y,et al.A novel inhibitory effect of D-allose on production of reactive oxygen species from neutrophils[J].J Biosci Bioeng,2003,96:89-91.
[6]Izumori K,Khan A R,Okaya H,et al.A new enzyme,D-ketohexose 3-epimerase,fromPseudomonassp.ST-24[J].Biosci Biotechnol Biochem,1993,57:1037-1039.
[7]Itoh H,Okaya H,Khan A R et al.Purification and characterization of D-tagatose 3-epimerase fromPseudomonassp.ST-24[J].Biosci Biotechnol Biochem,1994,58:2168-2171.
[8]Yoshida H,Yamada M,Nishitani T,et al.Crystal structures of D-tagatose 3-epimerase fromPseudomonas cichoriiand its complexes with D-tagatose and D-fructose[J].J Mol Biol,2007,374:443-453.
[9]Kim H J,Hyun E K,Kim Y S,et al.Characterization of anAgrobacterium tumefaciensD-psicose 3-epimerase that converts D-fructose to D-psicose[J].Appl Environ Microbiol,2006,72:981-985.
[10]Kim K,Kim H J,Oh D K,et al.Crystal structure of D-psicose 3-epimerase fromAgrobacterium tumefaciensand its complex with true substrate D-fructose:a pivotal role of metal in catalysis,an active site for the non-phosphorylated substrate,and its conformational changes[J].J Mol Biol,2006,361:920-931.
[11]Zhang L T,Mu W M,Jiang B,et al.Characterization of D-tagatose 3-epimerase fromRhodobacter sphaeroidesthat converts D-fructose into D-psicose[J].Biotechnol Lett,2009,31:857-862.
[12]Zhang L T,Jiang B,Mu W M,et al.Characterization of D-tagatose 3-epimerase fromRhodobacter sphaeroidesSK011 [J].J Biotechnol,2008,136:S726.
[13]储菲菲,邢庆超,沐万孟,等.Clostridium cellulolyticumD-塔格糖3-差向异构酶基因的克隆、表达及酶活性研究[J].食品与生物技术学报,2011,30(2):283-286.
[14]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2002:42-47.
Study on expression,purification and enzyme activity of Clostridium bolteae ATCC BAA-613 D-tagatose 3-epimerase
CHU Fei-fei1,MU Wan-meng1,XING Qing-chao1,ZHOU Liu-ming2,ZHANG Tao1,JIANG Bo1,*
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Roquette America,Keokuk 52632,United States)
D-tagatose 3-epimerase is the most effective enzyme for the biological production of D-psicose from D-fructose,a novel functional factor.Gene CLOBOL_00069 encoding the D-tagatose 3-epimerase fromClostridium bolteaeATCC BAA-613 was cloned and expressed inEscherichia coli.E.coliBL21(DE3)were host cells with pUC57 as cloning vector and pET-22b(+)as plasmid to construct recombinant strains.The bacterium was induced by IPTG;then the recombinant DTEase was purified to electrophoretical homogeneity with affinity chromatography.The recombinant DTEase was analyzed by SDS-PAGE,and approximately 32ku exogenous protein was observed on the SDS-PAGE.The activity of recombinant DTEase was also studied,indicating thatClostridium bolteaeATCC BAA-613 DTEase belonged to DTEase family enzymes and had a high rate of biological transformation.The conversion reached 20%after 10h reaction.
D-tagatose 3-epimerase;D-psicose;gene recombinant;affinity chromatography
Q786
A
1002-0306(2012)07-0198-05
2011-06-20 *通讯联系人
储菲菲(1986-),女,硕士研究生,研究方向:食品生物技术。
国家自然基金项目(20906040);中央高校基本科研业务费专项资金(JUSRP31002);江苏省社会发展科技支撑项目(BE2010626)。

