两代繁殖实验研究牛初乳粉对大鼠生殖发育的影响
徐 丽,张兰威,*,张玉梅,薛 勇,刘钊燕,吕艳丽
(1.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨 150081;
2.北京大学医学部公共卫生学院,北京 100191)
两代繁殖实验研究牛初乳粉对大鼠生殖发育的影响
徐 丽1,张兰威1,*,张玉梅2,薛 勇2,刘钊燕2,吕艳丽2
(1.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨 150081;
2.北京大学医学部公共卫生学院,北京 100191)
为探讨围产期接受牛初乳粉对子代生殖发育的影响,设计了两代繁殖实验,分析亲代和子代雌雄鼠血清激素水平,生殖器官发育和生殖受孕变化。结果表明:食用含有牛初乳粉的饲料后,亲代和子代雌鼠生殖受孕指标及雄鼠精子密度和活率与空白组相比无显著差异(p>0.05)。亲代和子代雄鼠血清激素水平与空白组相比无显著差异(p>0.05),但亲代雌鼠血清中催乳素和孕酮显著低于空白组(p<0.05),子一代血清中催乳素显著低于空白组(p<0.05)。子二代雌鼠F2a生殖器间距与空白组相比显著降低(p<0.05),子二代F2b的阴道开口时间推迟(p<0.05),不能确定是偶然发生还是受生理影响所致,需要重复实验的验证。
牛初乳粉,两代繁殖研究,精子活率,生殖器间距
许多研究已调查人类食用的动物源性食物包括乳制品中含有多种内源性激素,这些食物的摄入与人类癌症的发生率存在显著的流行病学相关性[1]。食物中携带的激素特别是类固醇激素具有较强的激素活性,促进了人类癌症的发生[2]。同样,男性生殖能力下降,精子数量降低及精子发育异常与类固醇激素的暴露也相关[3-4]。乳制品是人类倍受睛睐的食物,现代的商业乳75%来自怀孕乳牛分泌的乳,雌激素水平显著提高。通过对西方人的膳食模式调查发现,因摄入乳制品而给人体带入的雌激素占动物膳食来源雌激素的60%~70%[5]。研究表明青春期前儿童饮用怀孕乳牛分泌的牛乳后,尿液中雌激素水平显著提高,性发育受到影响[6]。怀孕乳牛分泌的乳汁也使人类生殖发育受到不利影响[7]。除常乳外,牛初乳也是人类消费的主要乳制品。牛初乳中的雌激素及孕激素等类固醇化合含量高于牛乳[8]。但作为人类功能食品和营养补充剂的牛初乳制品始终缺乏针对人类生殖发育影响的研究报道。本研究采用两代动物繁殖实验探讨围产期接受牛初乳粉对SD大鼠子代生殖发育的影响,重点探讨SD大鼠在摄入牛初乳粉后雌雄鼠的内分泌激素水平,生殖器官发育及成年后的生殖受孕变化。
1 材料与方法
1.1 材料与仪器
甲醇、乙醇 分析纯,购于北京化工厂;瑞氏染液、Giemsa染液、f12培养液 均购于中科迈晨科技有限公司;苏木精染液、酸酒精、伊红染液 均购于北京益利化学品有限公司;促黄体生成素(LH)测定试剂盒、促卵泡激素(FSH)测定试剂盒、孕酮(P)测定试剂盒、雌二醇(E2)测定试剂盒、睾酮(T)测定试剂盒 均购于北京科美生物技术有限公司;牛初乳粉 哈尔滨康普生物科技公司赞助(其中可的松含量为 19.84μg/kg,氢化可的松 15.03μg/kg,睾酮1.41μg/kg,雄烯二酮2.17μg/kg,孕酮13.00μg/kg,雌二醇9.71μg/kg,雌酮21.08μg/kg)。
WLZY-9000型伟力彩色精子质量检测系统 北京伟力技贸公司;DFM-96型放射免疫计数器
合肥众成机电技术开发有限公司;奥林巴斯CKX-41型光学显微镜 日本。
1.2 动物饲料的配制和分组
动物饲料分为空白饲料和牛初乳粉饲料,空白授试物为能够满足SD鼠日常所需营养物质而配制的标准饲料。牛初乳粉饲料是在空白饲料基础上添加牛初乳粉,并调整其他辅料配比以达到能量均衡,蛋白质,脂肪及碳水化合物与空白组一致,其中牛初乳粉提供了授食物37%的蛋白质、6.7%脂肪和4.3%碳水化合物。
实验动物由北京大学医学部实验动物科学部提供,为SPF级4周龄健康SD大鼠雌雄各20只,体重分别为(80±20)g和(100±20)g。本次实验获得北京大学医学伦理委员会批准。SD大鼠在SPF级动物房温度(23±2)℃,相对湿度50% ±5%,24h昼夜交替,光照时间为6:00~18:00适应3d后,根据体重随机分为空白组和牛初乳粉组,每组雌雄各十只,分别编号,并分笼饲养,每笼3~4只,自由摄入水和饲料。
1.3 实验方法
1.3.1 动物繁殖实验操作流程 亲代鼠在不同饲料干预8周后雌雄鼠合笼,合笼雌雄比例为2∶1,雌鼠每天都合笼,雄鼠轮换。每晚22:00合笼,次日8:00做阴道涂片,镜下检查涂片有精子表示合笼成功。按图1流程完成两代繁殖实验。亲代雌鼠在合笼、怀孕及哺乳期间都食用实验饲料。幼鼠断乳后继续接受相应组饲料,从生命第五周开始每隔一周测定亲代和子一代雌雄鼠体重至生命12周。亲代和子一代雌鼠怀孕后测定第0、7、14、21d体重。子一代和子二代幼鼠出生后测定第0、4、7、14、21d体重。
1.3.2 雌雄鼠生殖器间距及雌鼠动情周期检测 雌雄鼠断乳后观察阴道开口时间和包皮张开时间,并于35d测量子鼠肛门生殖器间距,精确度为0.1mm。实验雌鼠膳食干预5周后,做阴道涂片,镜下观察涂片状况,连续观察三周确定动情周期。

图1 两代繁殖实验亲代,子一代,子二代实验流程Fig.1 Experimental outline for parental,offspring F1,F2a and F2b generations in two-generation reproduction
1.3.3 亲代和子一代雌雄鼠血清激素检测 雌雄鼠处死后取股动脉血,低温离心分离得血清,采用放射性免疫吸附法检测雄鼠血清中促黄体生成激素(LH)、卵泡刺激素(FSH)、睾酮(Testosterone)激素水平,和雌鼠血清中促黄体生成激素(LH)、卵泡刺激素 (FSH)、雌二醇 (Estradio-17β)、孕酮(Progesterone)、催乳素(Prolactin)水平。
1.3.4 亲代和子一代雄鼠精子数和活率测定 分离雄鼠左侧附睾,称重后,立即放置于1m L含有1%小牛血清的f12培养液(37℃预热)中,用眼科剪剪碎,5m in后吸取上清,利用 Computer-aided sperm analysis(CASA)系统评价精子数及活力。
1.3.5 亲代和子一代雌雄鼠组织器官和体重比 亲代和子一代雌雄大鼠12h禁食后称重,之后处死,摘取雄鼠左侧附睾、右侧附睾、左侧睾丸、右侧睾丸、左侧储精囊和右侧储精囊称重,摘取雌鼠左侧卵巢、右侧卵巢和子宫称重,与处死前禁食12h后的体重相比,得到脏体比。
2 结果与讨论
2.1 亲代雌雄鼠生长状况及生殖发育
2.1.1 亲代雌雄鼠体重及脏器重量比 4周龄SD鼠进入实验期,第五周随机分组后开始监测各实验组雌雄鼠体重至12周龄,此期间,牛初乳粉组雄性鼠从第8周龄开始体重明显高于空白组(p<0.05)。两组雌鼠在此期间体重无统计差异(p>0.05),如图2所示。
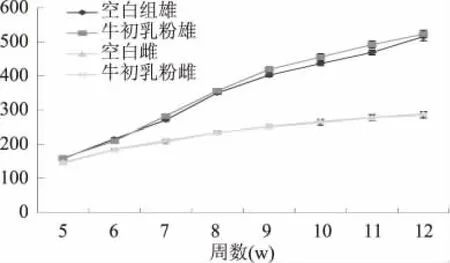
图2 亲代雌雄鼠体重变化Fig.2 Weight of partenal female and male
亲代雄鼠与雌鼠被处死前称量体重,处死后取脏器称重。如表1所示,牛初乳粉组雄鼠在处死前体重显著高于空白组,且左储精囊脏体比也显著高于空白组(p<0.05)。而牛初乳粉组雌鼠处死前体重及各脏体比与空白组无统计差异(p>0.05)。
表1 亲代雌雄鼠器官重量(±SD) Table 1 Organ weights of parental andoffspring generation female and male rats(±SD)

表1 亲代雌雄鼠器官重量(±SD) Table 1 Organ weights of parental andoffspring generation female and male rats(±SD)
注:*:与空白组的差异。表3、4、7、9、10、12同。
指标 空白组 牛初乳粉组雄性体重(g) 606.64±16.74 689.07±56.56*脏体比(‰) 1.87±0.45 1.93±0.58右睾丸 2.89±0.29 2.78±0.52左睾丸 2.93±0.32 2.91±0.33右附睾 0.58±0.09 0.54±0.05左附睾 0.61±0.13 0.56±0.10右储精囊 0.50±0.09 0.45±0.07左储精囊 0.55±0.09 0.45±0.08*雌性体重(g) 333.19±30.31 340.69±19.06脏体比(‰)右卵巢 0.33±0.08 0.29±0.05左卵巢 0.32±0.06 0.27±0.06子宫
2.1.2 亲代雌鼠生殖指标 如表2所示两组雌鼠孕期体重、受孕率、妊娠率、孕期时间等均无统计差异(p>0.05)。牛初乳粉组小鼠出生后存活率略高于空白组,但两组间无统计学差异(p>0.05)。对于出生小鼠的性别,牛乳粉组出生的雄性小鼠比率高于空白组,但两组间也无统计学差异(p>0.05)。
表2 亲代雌鼠生殖数据(±SD)Table 2 Parental reproductive data(±SD)

表2 亲代雌鼠生殖数据(±SD)Table 2 Parental reproductive data(±SD)
注:a受孕率(%)=怀孕动物数/交配雌性动物数×100;b妊娠率(%)=分娩有活体幼仔的窝数/怀孕动物数×100;c出生存活率(%)=产后4 d仔鼠存活数/出生时活仔数×100; d性别比=仔鼠成熟时雄鼠数/雌鼠数。表7同。
10 10受孕率(%)a 100 100妊娠率(%)b 100 100出生存活率(%)c 95.71 99.22动情周期(d) 4.32±0.53 4.46±0.64繁育幼鼠性别比d 1.00±0.97 1.19±0.59雌鼠怀孕后体重(g) 0d 311.00±31.26 323.45±30.36 7d 348.53±36.39 352.34±27.67 14d 387.58±32.74 382.25±33.69指标 空白组 牛初乳粉组配对动物数21d 483.62±29.87 474.43±49.05
2.1.3 亲代雄鼠精子数量和活率 如表3所示牛初乳粉组精子总数显著高于空白组(p<0.05),两组间精子密度与精子活率无统计差异(p>0.05)。
表3 亲代雄鼠精子数量及质量(±SD)Table 3 Sperm counts and quality of parentalmale(±SD)

表3 亲代雄鼠精子数量及质量(±SD)Table 3 Sperm counts and quality of parentalmale(±SD)
指标 空白组 牛初乳粉组精子总数 105.00±33.76 141.44±33.55* 15.78±8.28 16.14±4.47精子密度(百万/mL) 8.96±2.94 9.94±2.55精子活率(%)
2.1.4 亲代雌雄鼠血清激素水平 如表4所示,两组间雄鼠血清中睾酮、FSH、LH水平无统计差异(p>0.05)。牛初乳粉组雌鼠血清中催乳素和孕酮显著低于空白组(p<0.05),其余激素两组间无统计差异。
表4 亲代血清激素水平(±SD)Table 4 Serum hormone concentrations of parents(±SD)
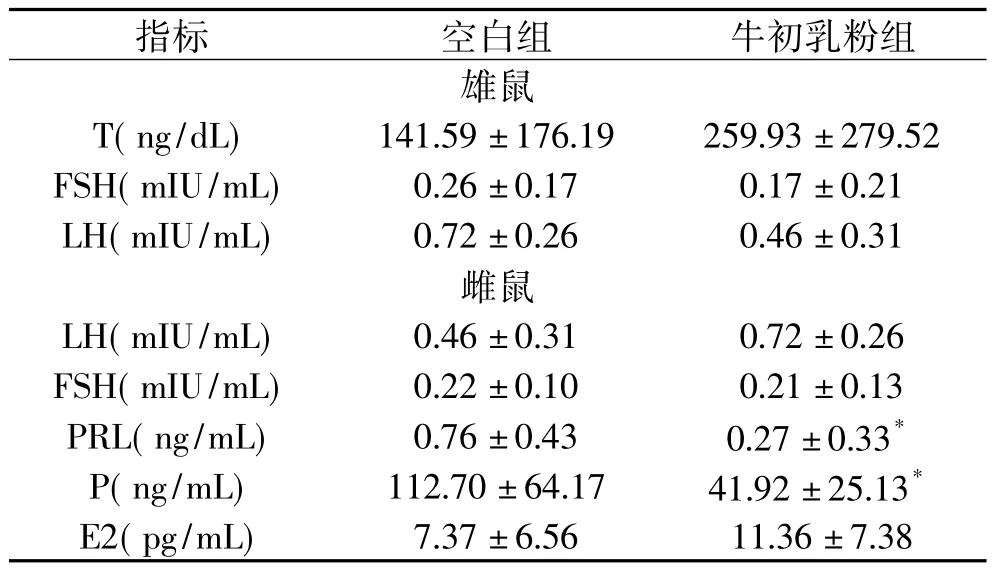
表4 亲代血清激素水平(±SD)Table 4 Serum hormone concentrations of parents(±SD)
指标 空白组 牛初乳粉组7.37±6.56 11.36±7.38雄鼠T(ng/dL) 141.59±176.19 259.93±279.52 FSH(m IU/mL) 0.26±0.17 0.17±0.21 LH(m IU/mL) 0.72±0.26 0.46±0.31雌鼠LH(m IU/mL) 0.46±0.31 0.72±0.26 FSH(m IU/m L) 0.22±0.10 0.21±0.13 PRL(ng/mL) 0.76±0.43 0.27±0.33* P(ng/mL) 112.70±64.17 41.92±25.13* E2(pg/mL)
2.2 子一代雌雄鼠生殖发育变化
子一代幼鼠出生后食用对应母鼠的乳汁,监测第0、4、7、14、21d体重变化,如表5所示。两组间无统计差异(p>0.05)。
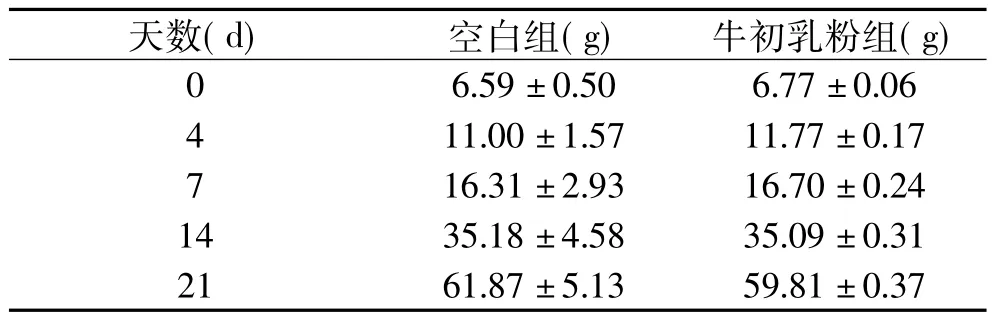
表5 子一代出生后体重Table 5 Weight of offspring after birth
子一代幼鼠3w后断乳,之后食用与母鼠一致的饲料,第5w开始每隔一周称量体重至第12周,评估子一代体重变化。如图3所示,两组间雌雄鼠的体重无统计上的差异(p>0.05)。

图3 子一代雌雄鼠体重变化Fig.3 Weight of offspring female and male
测定幼鼠体重同时,观察各组幼鼠生殖器官的发育如表6所示。两组雄鼠包皮开口时间在出生后33~35d之间,但无统计差异(p>0.05)。雌鼠阴道开口时间在出生后31~33d之间,牛初乳粉组相对早于空白组,但两组间也无统计差异(p>0.05)。出生后第35d雌雄鼠生殖器间距两组间也无统计差异(p>0.05)。
表7 子一代(F1)生殖数据(±SD)Table 7 Offspring generation(F1)reproductive data(±SD)

表7 子一代(F1)生殖数据(±SD)Table 7 Offspring generation(F1)reproductive data(±SD)
10 10 10 10受孕率(%)a 80 100 70 100妊娠率(%)b 100 100 100 100出生存活率(%)c 99.15 95.23 100 99.34动情周期(d) 4.73±0.55 4.83±0.54 / /繁育幼鼠性别比d 1.28±0.41 1.52±1.23 1.63±1.08 1.35±0.66雌鼠怀孕后体重(g) 0d 328.35±28.66 336.70±22.29 383.26±28.86 375.20±28.46 7d 357.30±27.08 359.75±24.97 414.19±40.74 406.48±32.04 14d 398.94±32.59 411.83±26.48 459.49±41.78 453.36±33.00 21d 455.7±90.73 508.83±35.49 557.79±36.16 560.96±34.50空白组 牛初乳粉组 空白组 牛初乳粉组配对动物数指标 子一代F1(第一次生育) 子一代F1(第二次生育) *
表6 子一代生殖器指标(±SD)Table 6 Reproductive organ index of offspring F1 pups(±SD)

表6 子一代生殖器指标(±SD)Table 6 Reproductive organ index of offspring F1 pups(±SD)
1.59±0.11 1.57±0.09 34.5±3.37 33.89±3.48雌鼠阴道开口时间(d) 32.90±2.96 31.56±1.33 35日雄鼠生殖器间距(mm) 3.45±0.45 3.71±0.21 35日雌鼠生殖器间距(mm)指标 空白组 牛初乳粉组雄鼠包皮开口时间(d)
子一代雌鼠生育指标如表7所示,两组雌鼠动情周期无统计学差异(p>0.05)。子一代雌雄鼠孕育两次,测定两次雌鼠怀孕期间第0、7、14、21d体重。第一次孕育期间,牛初乳粉组各时间段体重与空白组无统计差异(p>0.05)。第二次孕育期间,第21d牛初乳粉组雌鼠体重显著高于空白组(p<0.05)。两次孕育牛初乳粉组受孕率和妊娠率均为100%,相对高于空白组。但出生后空白组幼鼠的存活率相对高于牛初乳粉组,主要因牛初乳粉组母鼠食掉幼鼠所致。对两次孕育生出的幼鼠的性别进行统计,发现两组幼鼠的雄性数量均高于雌性数量,但两组间在性别比上无统计学差异(p>0.05)。
子一代雄鼠精子活率测定如表8所示,两组间雄鼠精子总数,精子密度和精子活率均无统计差异(p>0.05)。
表8 子一代雄鼠精子数量及质量(±SD)Table 8 Sperm counts and quality of offspring generation male(±SD)

表8 子一代雄鼠精子数量及质量(±SD)Table 8 Sperm counts and quality of offspring generation male(±SD)
27.39±7.47 24.35±7.17 111.30±62.76 109.20±51.10精子密度(百万/mL) 34.98±14.75 39.32±13.30精子活率(%)指标 空白组 牛初乳粉组精子总数
子代雌雄生殖器官称重与处死前体重比如表9所示,除处死前牛初乳粉组雄鼠体重显著高于空白组(p<0.05),两组间的雌雄鼠的脏体均无统计差异(p>0.05)。
子一代雌雄鼠孕育完两次后处死,取血分析血清中激素水平如表10所示。牛初乳粉组雄鼠血清激素水平与空白组无统计差异(p>0.05)。对于雌鼠,除牛初乳粉组催乳素含量显著高于空白组外(p<0.05),其余激素水平两组间无统计差异(p>0.05)。
表9 子一代器官重量(±SD)Table 9 Organ weights of offspring generation rats(±SD)

表9 子一代器官重量(±SD)Table 9 Organ weights of offspring generation rats(±SD)
指标 空白组 牛初乳粉组雄鼠体重(g) 702.74±59.97 787.3±63.13*右睾丸 2.18±0.24 2.02±0.24左睾丸 2.23±0.25 2.02±0.26右附睾 0.45±0.09 0.43±0.06左附睾 0.50±0.09 0.45±0.11右储精囊 0.40±0.07 0.37±0.05左储精囊 0.42±0.08 0.37±0.05雌鼠体重(g) 433.84±64.37 441.44±44.05脏体比(‰)脏体比(‰) 1.45±0.48 1.30±0.45右卵巢 0.19±0.06 0.17±0.07左卵巢 0.22±0.07 0.19±0.09子宫
表10 子一代血清激素水平(±SD)Table 10 Serum hormone concentration in parental and offspring generation rats(±SD)

表10 子一代血清激素水平(±SD)Table 10 Serum hormone concentration in parental and offspring generation rats(±SD)
指标 空白组 牛初乳粉组9.10±4.30 9.31±3.33雄鼠T(ng/dL) 252.26±234.81 211.26±160.66 FSH(m IU/mL) 0.11±0.08 0.16±0.09 LH(m IU/mL) 0.30±0.06 0.31±0.04雌鼠LH(m IU/mL) 0.29±0.03 0.31±0.07 FSH(m IU/mL) 0.14±0.06 0.11±0.04 PRL(ng/mL) 43.16±21.25 57.57±38.62* P(ng/mL) 496.14±312.09 507.22±409.29 E2(pg/mL)
2.3 子二代(F2a,F2b)雌雄鼠生殖发育
子二代F2a,F2b幼鼠出生后第0、4、7、14、21d的体重的测定结果如表11所示。各时间段两组间无统计差异(p>0.05)。
测定幼鼠体重同时,观察两组幼鼠生殖器官的发育如表12所示。F2a雄鼠包皮开口时间在出生后32~34天之间,F2b雄鼠包皮开口时间在33~35d之间,两组间无统计差异(p>0.05)。F2a雌鼠阴道开口时间在出生后32~33d之间,两组间无统计差异。但F2b雌鼠阴道开口时间在30~34d之间,牛初乳粉组显著迟于空白组(p<0.05)。F2a出生后第35d雄鼠生殖器间距牛初乳粉组与空白组无差异(p>0.05),F2b第35d雄鼠生殖器间距两组间也无统计差异(p<0.05)。对于雌鼠第35d生殖器间距,F2a牛初乳粉组均显著低于空白组(p<0.05),F2b牛初乳粉组与空白组无统计差异(p>0.05)。
表11 子二代出生后体重(±SD)Table 11 Weight of offspring(F2a,F2b)after birth(±SD)

表11 子二代出生后体重(±SD)Table 11 Weight of offspring(F2a,F2b)after birth(±SD)
天数(d) F2b空白组(g) 牛初乳粉组(g) 空白组(g) 牛初乳粉组(g) F2a 7.64±1.61 6.96±0.53 6.51±0.52 6.65±0.67 4 9.84±1.70 10.67±2.40 10.72±1.20 11.38±1.94 7 16.22±2.37 17.65±4.79 18.95±1.11 19.67±2.56 14 34.83±4.06 35.53±3.07 32.15±4.60 39.10±4.09 21 58.01±7.35 61.81±5.81 56.45±7.44 62.87±3.15 0
表12 子二代F2a、F2b生殖器指标(±SD)Table 12 Reproductive organ index of offspring F2a and F2b pups(±SD)

表12 子二代F2a、F2b生殖器指标(±SD)Table 12 Reproductive organ index of offspring F2a and F2b pups(±SD)
F2a F2b空白组 牛初乳粉组 空白组 牛初乳粉组雄鼠包皮开口时间(d) 32.88±3.98 33.22±4.63 33.86±2.91 34.70±3.59指标雌鼠阴道开口时间(d) 32.13±2.30 32.00±3.02 30.14±0.90 33.67±2.55* 35日雄鼠生殖器间距(mm) 3.44±0.18 3.54±0.12 3.54±0.12 3.69±0.23 35日雌鼠生殖器间距(mm) 1.71±0.12 1.61±0.07*1.53±0.10 1.61±0.13
食用含有牛初乳粉的饲料后,亲代雄鼠左储精囊脏体比显著降低,但在子代中未表现出相同的现象,推断亲代雄鼠左储精囊脏体比的降低与牛初乳粉的摄入无关。雄鼠包皮开口时间和雌鼠阴道开口时间是大鼠一个可靠的无损操作青春期效应指标,子宫内接受雌激素类物质会使雄鼠包皮开口时间推迟,雌鼠阴道开口时间提前或推后[9-10],暗示青春期发育受到影响。本研究使用的牛初乳粉含有相对含量较高的雌激素和孕激素,但围产期接受牛初乳粉并未使两代雄鼠血清中内分泌激素产生异常,暗示了内分泌系统没有受到损害,雄鼠包皮开口时间未被引起异常,即青春期发育正常。对于雌鼠,亲代和子一代雌鼠的阴道开口时间和动情周期表现正常,但子二代F2b的阴道开口时间明显推迟,这一现象未在子二代F2a中表现,因此还不能真正推断牛初乳粉的摄入延迟了子二代雌鼠的青春期发育,需要重复实验的验证。生殖器间距是评估子宫内激素水平的敏感指标,雌性生殖器间距只有雄性的一半,雄性幼仔生殖器间距变小与生殖系统雌化有关,暗示了可能在子宫内受到了内分泌干扰物的暴露,生殖系统受到损害[11-12]。本研究发现食用牛初乳粉后子二代雌鼠F2a生殖器间距与空白组相比显著降低,但子一代和子二代F2b雌鼠生殖器间距表现正常,因此还不能确定这种现象的产生是偶然发生还是生物学的差异,仍需重复实验的验证。
3 结论
两代繁殖实验证明了牛初乳粉对亲代和子代雌雄鼠的生长具有潜在的促进作用,对于在围产期接受牛初乳粉的子代幼鼠的青春期发育和生殖系统无明显的严重损伤,没有对SD大鼠生殖系统产生明显的不良影响。对于子二代F2a雄鼠生殖器间距和F2b雌鼠阴道开口时间的异常表现需要重复实验的进一步证实。
[1]Andersson A M,Skakkebaek N E.Exposure to exogenous estrogens in food:possible impact on human development and health[J].European Journal of Endocrinology,1999,140: 477-485.
[2]Malekinejad H,Scherpenisse P,Bergwerff A A.Naturally occurring estrogens in processed milk and in raw milk from gestated cows[J].Journal of Agricultural and Food Chemistry,2006,54:9785-9791.
[3]Sharpe R M,Skakkebaek N E.Are oestrogens involved in falling sperm counts and disorders of themale reproductive tract?[J].Lancet,1993,341:1392-1395.
[4]Ganmaa D,Wang P Y,Qin L Q,et al.Ismilk responsible for male reproductive disorders?[J].Medicine Hypotheses,2001,57: 510-514.
[5]Remesar X,Tang V,Ferrer E,et al.Estrone in food:a factor influencing the development of obesity[J].European Journal Nutrition,1999,38:247-253.
[6]Maruyama K,Oshima T,Ohyama K.Exposure to exogenous estrogen through intake of commercial milk produced from pregnant cows[J].Pediatrics International,2010,52:33-38.
[7]Ganmaa D,Qin L Q,Wang P Y,et al.A two-generation reproduction study to assess the effects of cows’milk on reproductive development inmale and female rats[J].Fertility and Sterility,2004,83:1106-1114.
[8]Xu L,Zhang L W,Zhang Y M,et al.Qualitative and quantitative comparison of hormone contents between bovine and human colostrums[J].International Dairy Journal,2011,21: 54-57.
[9]Gray L E,Ostby J,Cooper R L.The estrogenic and antiandrogenic pesticidemethoxychlor alters the reproductive tract and behavior without affecting pituitary size or LH and prolactin secretion inmale rats[J].Toxicology and Industrial Health,1999,15:37-47.
[10]You L,Casanova M,Bartolucci E J.Combined effects of dietary phytoestrogen and synthetic endocrine active compound on reproductive development in Sprague-Dawley rats:genistein and methoxychlor[J].Toxicology Science,2002,66:91-104.
[11]Ashby J,Tinwell H,Lefewe P A.Normal sexual development of rats exposed to butyl benzyl phthahe from conception to weaning[J].Regulatory Toxicology Phanllacology,1997,26: 102-118.
[12]Levy J R,Faber K A,Ayyash L.The efffect of prenatal exposure to the phytoestrogen genistein on sexual differentiation in rats[J].Proceeding of the Society for Experiment Biology and Medicine,1995,208:60-66.
Effect of bovine colostrum s powders on reproductive development in male and female rats assessed by a two-generation reproduction
XU Li1,ZHANG Lan-wei1,*,ZHANG Yu-mei2,XUE Yong2,LIU Zhao-yan2,LV Yan-li2
(1.School of Food Science and Engineering,Harbin Institute of Technology,Harbin 150081,China;
2.Department of Nutrition and Food Hygiene,School of Public Health,Peking University Health Science Center,Beijing 100191,China)
To exam ine the effect of bovine colostrum powder on the rep roductive development and rep roductive ability of offsp ring rats when the exposure began in uteri,the two-generation rep roduction study was designed.The hormone levels in serum,the developm entof rep roduc tive organs and rep roduc tive date were detec ted.There were no significant differences in fertility or rep roductive organ developmentof both parents and offsp ring female pups,or in the germ cell numbers and the germ ac tivity of both parents and offsp ring male pups between bovine colostrum powder g roup and controlg roup(p>0.05).There were no significantdifferences in the hormone levels of parents and offsp ring male pups between two g roups(p>0.05).However,the p rogesterone content of parents female rats and the p rolactin contents of parents and offsp ring female pups in bovine colostrum powder g roup were significant lower than those of controlg roup(p<0.05).The anogenital d istance of F2a fem ale pups in bovine colostrum powder g roup was shorten(p<0.05),and the vaginal open of F2b fem ale pups in bovine colostrum powder g roup were delayed com paring w ith control g roup(p<0.05).It was unknown whether they occurred by chance or was biolog ically significant until this treatment effect is rep licated.
bovine colostrum s powder;two-generation study;sperm ac tivity;anogenital d istance
TS202
A
1002-0306(2012)19-0335-06
2012-02-28 *通讯联系人
徐丽(1976-),女,在读博士,研究方向:食品科学与工程。

