响应面法优化脂肪酶的固定化条件及其水解橄榄油的特性研究
刘自琴,黄惠华*
(华南理工大学轻工与食品学院,广东 广州 510640)
响应面法优化脂肪酶的固定化条件及其水解橄榄油的特性研究
刘自琴,黄惠华*
(华南理工大学轻工与食品学院,广东 广州 510640)
采用Sepharose CL-4B和7种大孔树脂为载体固定Palatase 20000L脂肪酶,对载体进行筛选,以酶活力为指标,采用响应面法优化固定化条件,并考察所制得固定化酶的稳定性和水解橄榄油的酶学性质。结果表明:以大孔树脂HPD-600为载体制得的固定化酶具有较高的活性和良好的稳定性。其最优的固定化条件为:pH3.9,酶与载体比例为9.1mg/g,吸附时间1.8h。在最优条件下制得固定化酶在最适合条件下测得的酶活力达到1440U/g,酶活回收率大于50%。固定化酶最适作用温度为50℃,最适作用pH值为8.0。固定化酶的Km值为0.130g/mL,高于游离酶的Km(0.069g/mL)。固定化酶的热稳定性有一定程度的提高,其重复操作5次后相对酶活力仍保持在58%以上。
Palatase 20000L脂肪酶;固定化;稳定性;响应面法
脂肪酶(三酰基甘油酰基水解酶,EC 3.1.1.3)是使用最广泛的酶之一。广泛应用于食品、化学、油脂化学品、农业化学、造纸、洗涤和生物表面活性剂的合成及生物柴油生产等工业[1]。但是脂肪酶的工业化应用主要有两个障碍,一是成本高,二是游离脂肪酶的稳定性差。为了解决这两个障碍,众多研究者都进行了脂肪酶固定化的研究,旨在解决脂肪酶的应用难题,使其发挥更大的工业用途[2]。固定化酶具有很多游离酶不具备的优点,如运用固定化酶可以进行反复分批反应和装柱连续反应,能更好的控制产品质量;固定化酶一般具有更好的稳定性;产物溶液中没有酶的残留,简化了提纯工艺;酶的使用效率提高,成本降低等[3]。近年来国内外很多专家都对脂肪酶的固定化进行了研究,主要集中在载体和固定化方法的选择方面。相关研究表明,将脂肪酶固定在琼脂糖凝胶和大孔树脂上,可以改善酶的稳定性,并且可以重复利用,降低生产成本[4-8]。
本研究选用Palatase 20000L脂肪酶进行固定化,Palatase 20000L具有很强的1,3-专一性,催化活力高,具有广阔的应用前景。以琼脂糖凝胶Sepharose CL-4B和7种大孔树脂为载体,采用共价结合和物理吸附的方法进行固定化,通过评价各载体固定化的效果选出最优的载体,在此基础上采用响应面法对该载体固定脂肪酶的固定化条件进行优化,并对在最优条件下生产的固定化酶的酶学性质和稳定性进行研究。
1 材料与方法
1.1 材料与试剂
脂肪酶Palatase 20000L(液体酶,酶活力为520U/mL)丹麦诺维信公司;HPD系列大孔树脂、D101、AB-8大孔树脂 沧州宝恩吸附材料科技有限公司;HP20、HP2MGL大孔树脂 日本三菱公司;Sepharose CL-4B 美国Pharmacia公司;橄榄油 国药集团化学试剂公司;磷酸、冰乙酸、乙酸钠、95%乙醇、聚乙烯醇、磷酸二氢钠、磷酸氢二钠、甘氨酸等均为分析纯。
1.2 仪器与设备
紫外-可见分光光度计 日本Shimadzu Dorporation公司;恒温水浴振荡器 常州澳华仪器有限公司;循环水式多用真空泵 巩义市予华仪器有限公司;超声波细胞粉碎仪 宁波新芝生物科技股份有限公司;磁力搅拌器 荣华仪器制造有限公司;PHS-25型pH计 上海虹益仪器仪表公司。
1.3 大孔树脂固定脂肪酶
大孔树脂预处理:称取10g树脂于锥形瓶中,用95%的乙醇浸泡24h,真空抽滤,用1L蒸馏水冲洗。树脂依次用25mL的5% HCl和5% NaOH溶液浸泡4h后抽滤,用蒸馏水洗至中性。抽滤后置于4℃冰箱中干燥4 h,室温保存备用。
固定化:称取经预处理的大孔树脂0.50g于50mL锥形瓶中,加入10mL磷酸缓冲液(pH7.5,0.05mol/L)和600μL脂肪酶(蛋白含量4mg/mL),置于恒温水浴振荡器中吸附5h(37℃,150r/min)。然后真空抽滤,并用100mL缓冲液冲洗载体,抽干后置于4℃冰箱中干燥4h,得到干燥的固定化酶0.25g,并于4℃冰箱中密封保存。
1.4 琼脂糖凝胶固定脂肪酶
活化:称取10g凝胶于真空抽滤漏斗中抽干,用100mL 0.5mol/L NaCl溶液冲洗,再用100mL蒸馏水洗,抽干后转移到50mL三角瓶中,然后加入6.5mL 2mol/L NaOH、1.5mL环氧氯丙烷、15mL质量分数为56%的1,4-二氧六环,在40℃恒温水浴摇床中活化2h。将活化的凝胶真空抽滤后用100mL 0.05mol/L pH7.5的磷酸缓冲液冲洗,抽干后立即偶联。
偶联:将活化的凝胶0.5g转入三角瓶中,加入10mL 0.05mol/L pH7.5的磷酸缓冲液和600μL脂肪酶,置于恒温水浴振荡器中偶联20h。然后真空抽滤,用100mL缓冲液冲洗,抽干后置于4℃冰箱中干燥4h,得到的固定化酶于4℃冰箱中密封保存。
1.5 脂肪酶活力测定
脂肪酶活力测定采用橄榄油乳化法[9]。用超声的方法制备乳化液,并优化乳化液制备的条件(超声功率、超声时间、橄榄油与乳化液的比例)。分别移取4mL磷酸缓冲液(pH7.5,0.05mol/L)和4mL乳化液(橄榄油含量为0.225g/mL)于50mL锥形瓶中,置于37℃恒温水浴振荡器中预热10min,然后加入游离脂肪酶50μL(固定化酶活力测定时则加入固定化酶25mg),180r/min振荡反应20min,加入15mL 95%乙醇停止反应。用0.05mol/L的NaOH标准溶液滴定反应产生的脂肪酸,酚酞为指示剂。酶活力单位定义为:在上述条件下,每分钟生成1μmol脂肪酸所需的酶量为1个酶活力单位,用U表示。
1.6 载体的固定化率和酶活力回收率测定
固定化时溶液中的蛋白质含量采用考马斯亮蓝染色法测定。
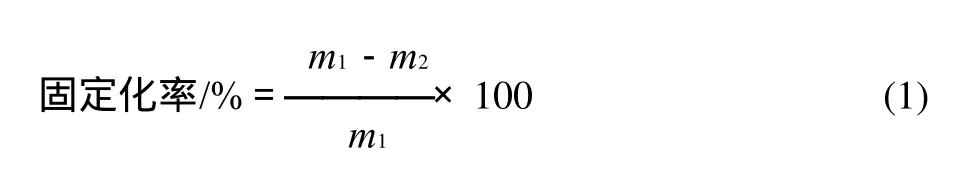
式中:m1为固定前溶液中蛋白质质量/μg;m2为固定后溶液中蛋白质质量/μg。

1.7 响应面试验设计
先进行单因素试验,根据单因素试验结果,选择对固定化酶活力影响较大的3个因素,以固定化酶活力为指标,在30℃条件下固定化,进行响应面试验,因素水平设计见表1。根据Box-Benhnken的中心组合试验设计原理,进行三因素三水平的响应面试验,采用Design-Expert 7对试验结果进行分析。

表1 响应面试验设计因素表Table 1 Factors and levels in response surface design因素 水平-1 0 1 A pH 3 4 5 B时间/h 1 2 3 C酶与载体比例/(mg/g) 6 8 10
1.8 Palatase 20000L固定化酶的水解性质研究
1.8.1 固定化酶和游离酶的最适作用温度测定
在pH7.5条件下,分别在温度为25、30、37、45、50、55、60℃测定Palatase 20000L游离酶和固定化酶的水解活力。
1.8.2 固定化酶和游离酶的最适作用pH值测定
在一定温度条件下(游离酶45℃,固定化酶50℃),分别在pH值为4、5、6、7、7.5、8、9、10测定Palatase 20000L游离酶和固定化酶的水解活力。
1.8.3 固定化酶和游离酶的Km值测定
采用Lineweaver-Burk双倒数作图法进行固定化酶和游离酶的Km值测定。固定酶的浓度,在不同底物质量浓度(0.0675~0.1575g/mL)条件下测定酶反应的初速率,以初速率的倒数对底物质量浓度的倒数作图,得一直线。由式(3)即可算出Km值。
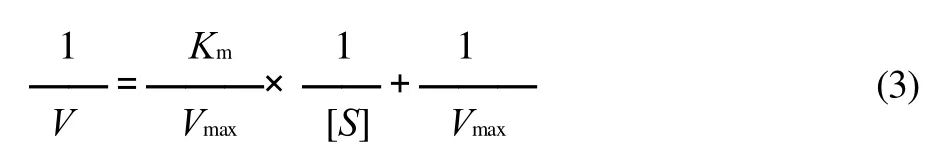
式中:V为反应初速率/(μmol/(mL·min));[S]为底物质量浓度/(g/mL)。
1.9 Palatase 20000L固定化酶的稳定性研究
1.9.1 固定化酶和游离酶的pH值稳定性测定
将Palatase 20000L游离酶和固定化酶分别在pH值为4、5、6、7、8、9、10的缓冲液中处理2h,然后测定处理后的酶活力,定义未经处理的酶活力为100%。
1.9.2 固定化酶和游离酶的热稳定性研究
将Palatase 20000L游离酶和固定化酶分别在50、60、70、80、90℃处理2h,然后测定酶活力,定义未经处理的酶活力为100%。
1.9.3 固定化酶的操作稳定性研究
将4mL磷酸缓冲液(pH8.0,0.05mol/L)和4mL橄榄油乳化液(橄榄油含量为0.225g/mL)置于50mL锥形瓶中,于50℃恒温水浴振荡器中预热10min,然后加入25mg固定化的Palatase 20000L,精确反应20min后,用移液枪移取4mL反应液与7.5mL 95%乙醇混合后用0.05mol/L的NaOH标准溶液滴定反应产生的脂肪酸,酚酞为指示剂,然后计算出固定化酶的酶活力。将余下的反应液与固定化酶采用过滤的方式分离出固定化酶,然后按上述方法测定第2次使用时固定化酶的活力。按此方法测定5次,得出固定化酶在重复使用5次时每批次的酶活力。
2 结果与分析
2.1 固定化载体及固定化方法的选择
分别选用了7种大孔树脂和Sepharose CL-4B作为载体对脂肪酶进行固定。由表2可知,HPD-600可以较好的固定脂肪酶,并得到较高的酶活力。后续实验选用HPD-600作为载体,进行固定化条件的优化与固定化酶的特性研究。
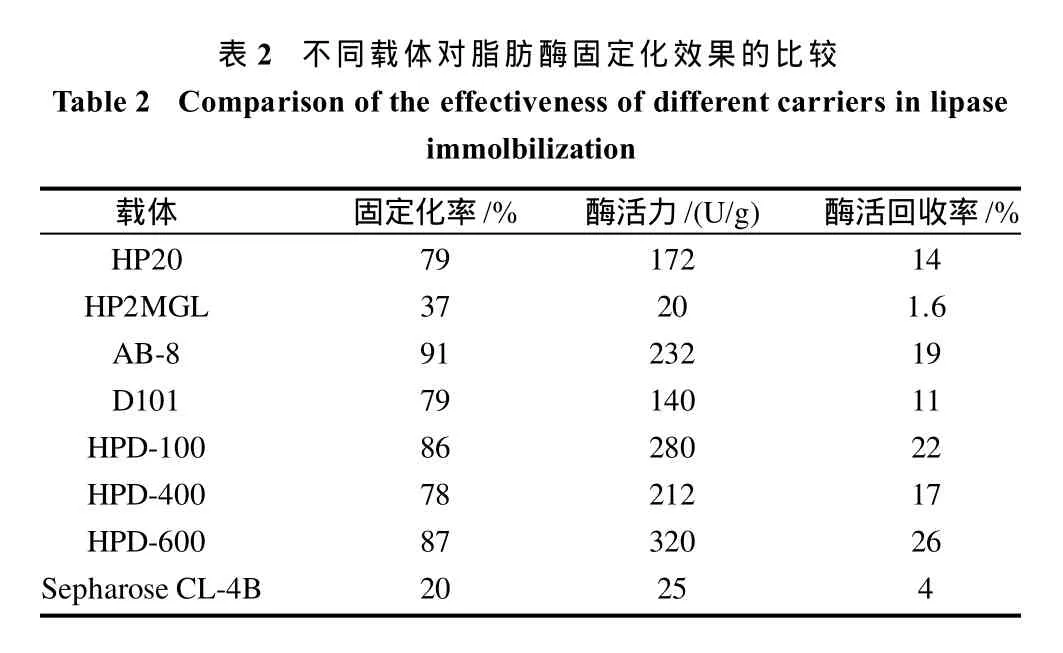
表2 不同载体对脂肪酶固定化效果的比较Table 2 Comparison of the effectiveness of different carriers in lipase immolbilization载体 固定化率/% 酶活力/(U/g) 酶活回收率/%HP20 79 172 14 HP2MGL 37 20 1.6 AB-8 91 232 19 D101 79 140 11 HPD-100 86 280 22 HPD-400 78 212 17 HPD-600 87 320 26 Sepharose CL-4B 20 25 4
2.2 HPD-600固定Palatase 20000L的条件优化
2.2.1 吸附温度对酶固定化效果的影响
将0.50g载体、600μL酶和10mL缓冲液(pH7.5)混合后分别在25、30、37、45、55℃条件下固定5h,测定各温度条件下脂肪酶的固定化率和相对酶活力。结果见图1。
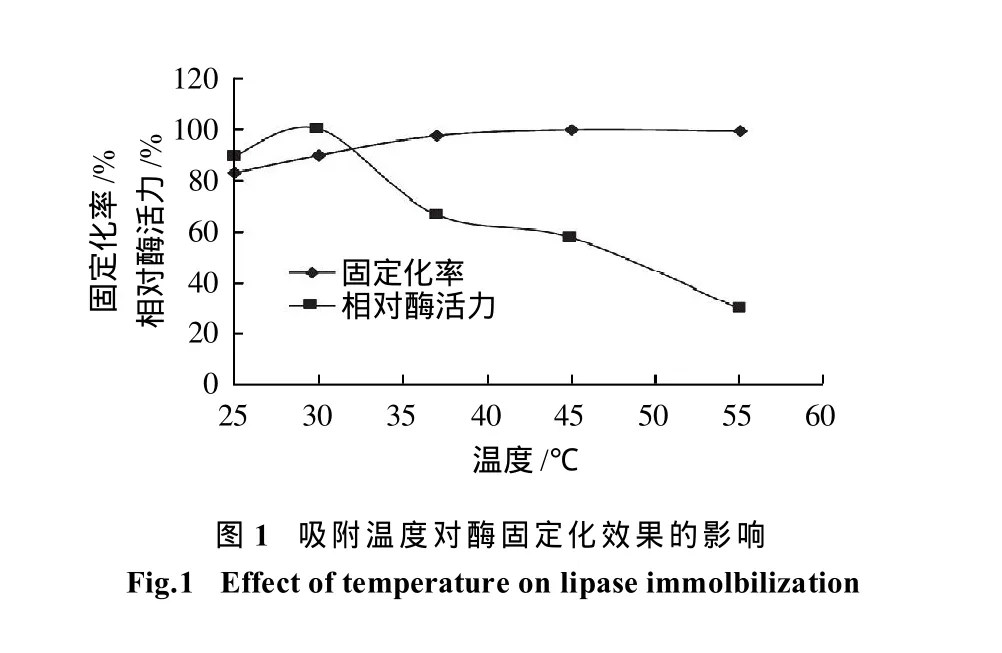
由图1可知,在吸附温度低于37℃时,随着温度的升高,固定化率增大,固定在载体上的酶的相对酶活力增加,高于37℃后固定化率趋于稳定。在30℃时相对酶活力达到最大值,再升高温度则会导致相对酶活力急剧下降。这是因为较高温度下蛋白分子运动加剧,减小了酶的扩散限制作用,使酶分子能更快扩散进入载体的孔道内并与载体发生相互作用,加快固定化[10]。但高温会破坏蛋白质的结构,导致酶因热变性而失活。
2.2.2 pH值对酶固定化效果的影响
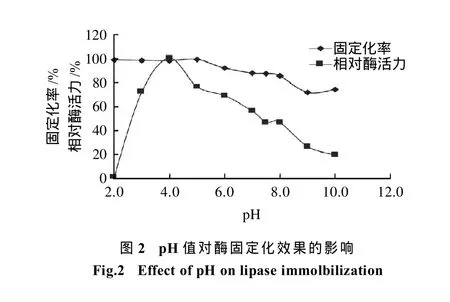
将0.50g载体,600μL酶分别和pH值为2、3、4、5、6、7、7.5、8、9、10的10mL缓冲液混合后在30℃条件下固定5h,并测定各pH值条件下的固定化率和相对酶活力,结果见图2。在pH值为2~6时,固定化率没有明显变化,pH值再增大会导致固定化率的降低,而相对酶活力在pH值为4时达到最大值。缓冲液的pH值会影响酶分子周围的离子微环境,从而影响固定化酶的活力,在特定的pH值条件下,酶分子的活性基团能处于最佳的离子状态,从而使酶显示出较高的相对酶活力[6]。
2.2.3 吸附时间对酶固定化效果的影响
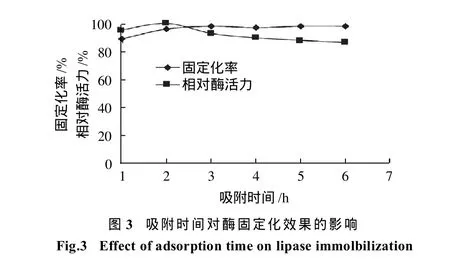
将0.50g载体、600μL酶和10mL缓冲液(pH4)混合后在30℃条件下分别固定1、2、3、4、5、7h,测定不同吸附时间条件下的固定化率和相对酶活力,结果见图3。随着吸附时间的延长,载体的固定化率在增大,在2h后基本达到平衡,吸附刚开始时,载体上的吸附位点很多,传质的驱动力大,吸附迅速[11]。吸附时间超过2h后,相对酶活力开始下降,因为酶分子在载体上开始积聚,影响了酶分子的扩散,降低了暴露的活性位点数量[10],且在长时间的振摇过程中部分酶会失活,因此选择2h为最佳吸附时间。
2.2.4 游离酶与载体比例对酶固定化效果的影响
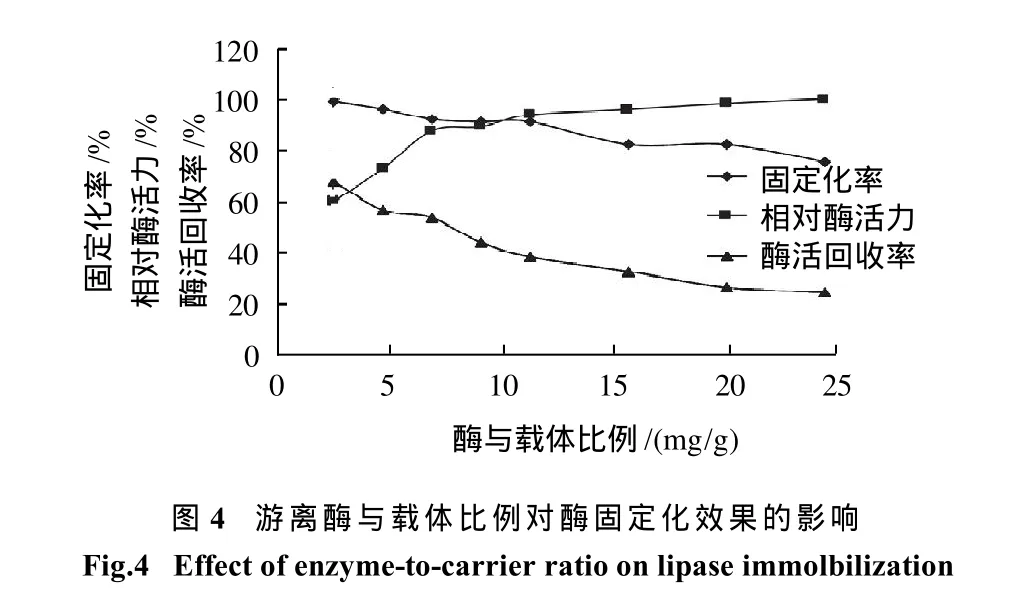
研究酶添加量(用蛋白含量计算,酶液的蛋白含量为4mg/mL)与载体的比例为4、6、8、10、12、16、20、24mg/g时的固定化率和相对酶活力。pH4.0,30℃条件下固定2h,结果见图4。随着酶添加量的增多,相对酶活力增大,但是固定化率和酶活回收率都在下降。当酶添加量较小时,载体吸附的酶量少,酶可以更加分散,增大它与底物接触的比表面积,活性部位更加暴露,提高反应效率,但当酶添加量大时,载体上吸附的酶增多,空间位阻增大,影响酶活性中心和底物的接触,从而降低了反应效率,导致相对酶活力和酶活回收率下降[12],因此本研究选择酶与载体比例为8mg/g作为最优的酶添加量。
2.3 响应面优化固定化条件
2.3.1 响应面试验结果

表3 响应面试验设计与结果Table 3 Response surface design and results试验号 A B C 酶活力/(U/g)1-1 -1 0 837 2 1-1 0 755 3-1 1 0 743 4 1 1 0 708 5-1 0 -1 696 6 1 0-1 625 7-1 0 1 872 8 1 0 1 837-1 -1 779 10 0 1 -1 813 11 0 -1 1 970 12 0 1 1 926 13 0 0 0 1017 14 0 0 0 1076 15 0 0 0 1002 16 0 0 0 1019 17 0 0 0 1029 9 0
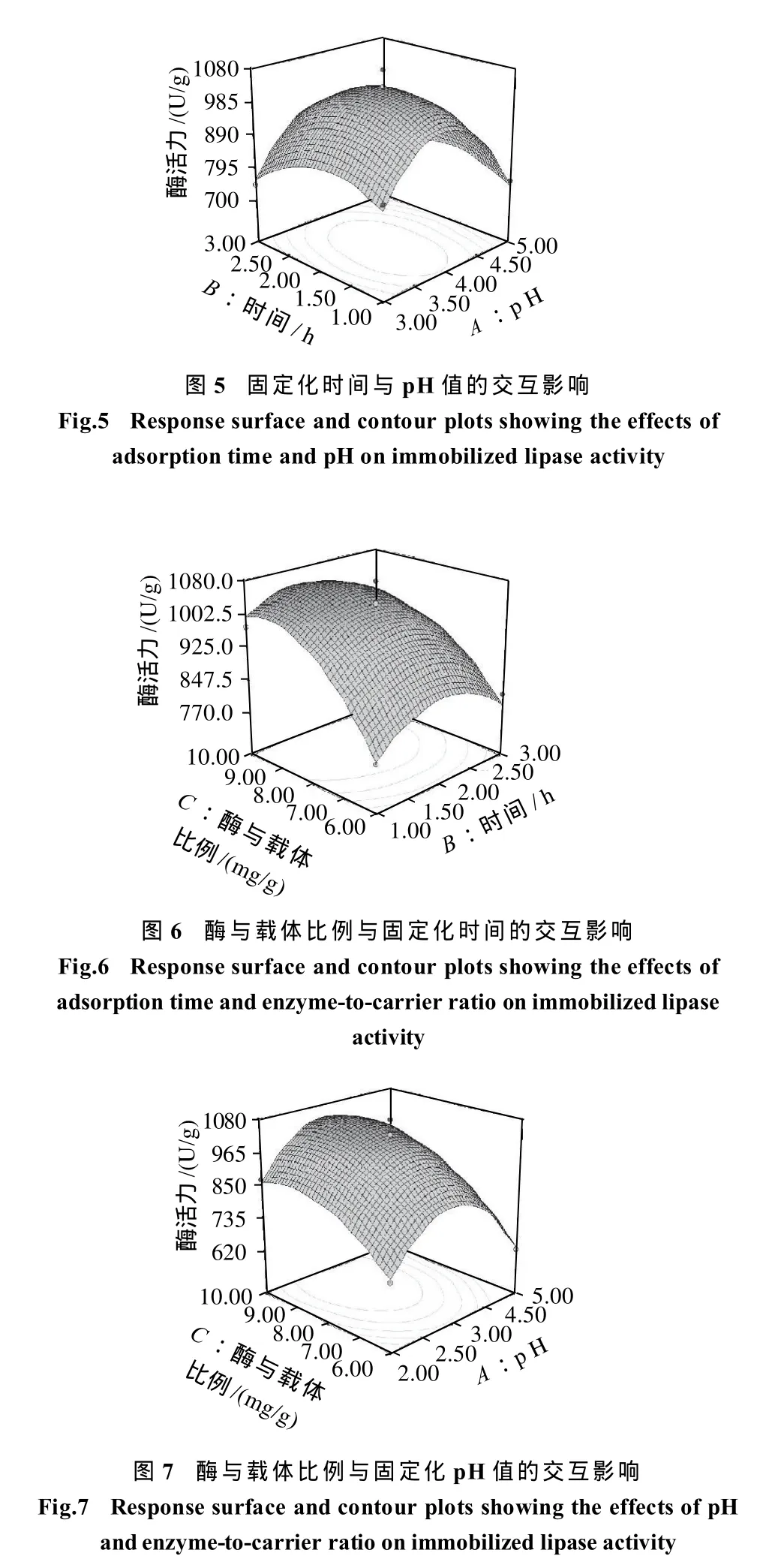
采用Design-Expert 7对表3的试验结果进行分析得到回归方程和响应面图。由图5~7可以看出各因素对响应值的影响变化趋势,且回归模型存在最大值,说明各个因素都有一个最适合的值。
酶活力回归模型P<0.0001(Prob>F),说明模型十分显著,失拟项P>0.05,说明模型拟合程度良好,实验误差小。一次项C以及二次项B2的P值小于0.0001,十分显著,一次项A和二次项A2、C2高度显著。在原有的拟合方程基础上,对拟合方程进行手动优化,去掉不显著的交互相AB和AC,失拟值由1.28变为0.99,因此去掉交互相AB和AC可以使方程获得更好的拟合效果。优化后的回归方程为:酶活力/(U/g)=1028.67-27.94A+18.81B+86.49C+19.76BC-191.12A2-76.80B2-79.99C2。
决定系数R2为97.63%,校正决定系数为0.9527,说明该模型能解释95.27%响应值变化,仅有4.73%的变异不能用此模型解释,说明回归方程的拟合程度很好,能够真实地反映数据结果[13-15]。
2.3.2 最优值的确定
利用回归方程确定最佳固定化条件,最佳条件为:固定化时间1.81h、pH3.93、酶与载体比例为9.13mg/g。采用上述优化工艺参数进行酶的固定化,考虑到实际操作的便利,将工艺参数改为:固定化时间1.8h、pH3.90、酶与载体比为9.1mg/g。在此酶解条件下重复3次实验,平均酶活力为1032U/g,与预测值1056U/g相比,其相对误差为2.3%,这说明实验模型合理。
2.4 Palatase 20000L固定化酶的水解性质研究
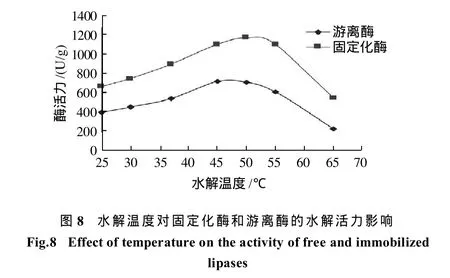
2.4.1 水解温度对固定化酶和游离酶的水解活力影响如图8所示,固定化酶和游离酶分别在50℃和45℃时达到最大水解活力,酶经固定后,热稳定性有所提高,所以最适作用温度也随之提高。
2.4.2 pH值对固定化酶和游离酶的水解活力影响

如图9所示,固定化酶和游离酶的最适作用pH值均为8.0。Palatase 20000L脂肪酶在固定化后的最适作用pH值并没有改变。
2.4.3 固定化酶和游离酶的Km值比较
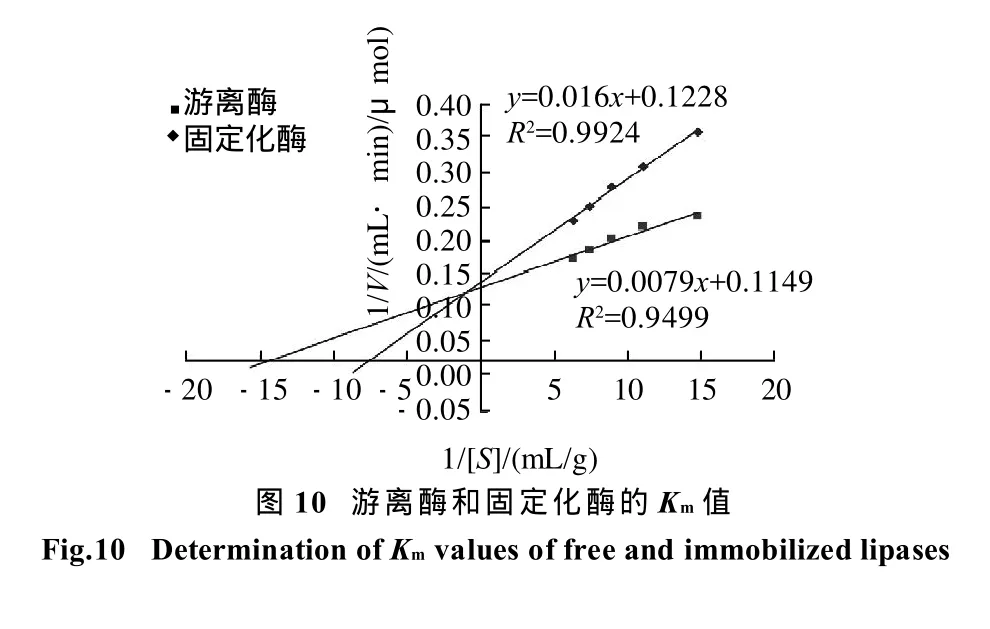
由图10可知,固定化酶和游离酶的Km分别为0.130g/mL和0.069g/mL。固定化酶的Km值比游离酶的Km值大,这是因为酶固定在载体上后,使底物与酶活性部位的接触比面积减小,降低了其与底物的亲和力,反应速率也相应降低[12]。
2.5 Palatase 20000L固定化酶的稳定性研究

表4 固定化酶和游离酶的pH值稳定性Table 4 pH stability of free and immobilized lipases酶种类 相对酶活力/%未处理 pH4 pH5 pH6 pH7 pH8 pH9 pH10固定化酶 100 99 91 93 83 80 58 46游离酶 100 98 93 90 84 79 57 36
由表4可知,Palatase 20000L脂肪酶固定化后的pH值稳定性并没有明显提高,游离酶和固定化酶在pH4~6内都有很高的稳定性,处理2h后相对酶活力变化很小。随着pH值的增大,游离酶和固定化脂肪酶的稳定性也开始下降。pH7~8处理2h相对酶活力保持在80%左右,pH9处理2h后能保持60%左右的相对酶活力,而在pH10中处理2h能保持35%以上相对酶活力。

表5 固定化酶和游离酶的热稳定性Table 5 Thermal stability of free and immobilized lipases酶种类 相对酶活力/%未处理 50℃ 60℃ 70℃ 80℃ 90℃固定化酶 100 96 80 58 40 18游离酶 100 75 72 50 35 2
由表5可知,固定化酶的热稳定性较游离酶相比有提高,在不同温度条件下处理后的相对酶活力都较游离酶高。酶经过固定化后通常会降低其在不利环境中构像变化的自由度,因此在热稳定性方面会较游离酶有一定的提高[16]。
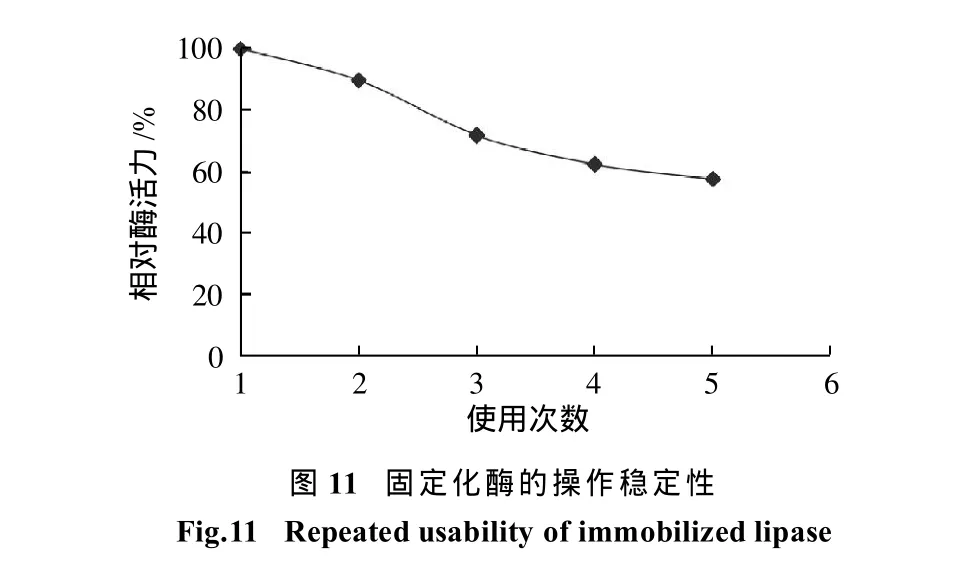
酶的固定化可以提高酶的重复利用率,降低生产成本,因此,固定化酶的重复利用性能(操作稳定性)是反映固定化效果的重要指标。研究了HPD-600固定化Palatase 20000L所得固定化酶水解橄榄油乳化液时,循环5次的操作稳定性。由图11可知,该酶在循环使用5次后仍能保持58%以上的相对酶活力,具有良好的操作稳定性。
3 结 论
HPD-600大孔树脂具有好的固定化脂肪酶的能力,通过响应面优化得到其固定Palatase 20000L脂肪酶的最优条件为:固定化温度30℃、固定化pH3.9、酶与载体比例为9.1mg/g、吸附时间1.8h。在最优条件下制得固定化酶在最适合条件下测得的酶活力为1440U/g,酶活力回收率大于50%。固定化酶和游离酶的最适作用温度分别为50℃和45℃,最适作用pH值均为8.0。固定化酶的Km值为0.130g/mL,高于游离酶的Km值(0.069g/mL)。固定化酶的热稳定性有一定程度提高,其重复操作5次后相对酶活力仍保持在58%以上。
[1]兰立新, 肖怀秋. 微生物脂肪酶应用研究进展[J]. 安徽农业科学, 2010,38(14): 7547-7548.
[2]许建军, 张颖. 脂肪酶的应用研究进展[J]. 江苏食品与发酵, 2002(2):19-21.
[3]罗贵民, 曹淑桂, 张今. 酶工程[M]. 北京: 化学工业出版社, 2002: 37-52.
[4]朱珊珊, 邵佩霞, 王永华. LipozymeTL100L脂肪酶的固定化及其性质研究[J]. 食品工业科技, 2010, 31(5): 97-100.
[5]RODRIGUES D S, MENDES A A, ADRIANO W S, et al. Multipoint covalent immobilization of microbial lipase on chitosan and agarose activated by different methods[J]. Journal of Molecular Catalysis B:Enzymatic, 2008, 51(3/4): 100-109.
[6]SUN Jiangna, JIANG Yanjun, ZHOU Liya. Immobilization ofCandida antarcticalipase B by adsorption in organic medium[J]. New Biotechnology, 2010, 27(1): 53-58.
[7]曹立强, 邓红, 韩瑞. 脂肪酶的大孔树脂固定化工艺条件研究[J]. 农产品加工: 学刊, 2010(3): 23-27.
[8]饶关香, 张熊禄, 余开. DM-130大孔树脂固定脂肪酶的研究[J]. 应用科技, 2005, 35(11): 65-64.
[9]江慧芳, 王雅琴, 刘春国. 三种脂肪酶活力测定方法的比较及改进[J]. 化学与生物工程, 2007, 24(8):72-75.
[10]赵丽芳. 脂肪酶的固定化及其催化性能研究[D]. 长春: 吉林大学, 2008.
[11]KANDASAMY R, KENNEDY L J, VIDYA C, et al. Immobilization of acidic lipase derived fromPseudomonas gessardiionto mesoporous activated carbon for the hydrolysis of olive oil[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 62(1): 59-66.
[12]OUMPANIOTI M, STAMATIS H, XENAKIS A. Microemulsion-based organogels as matrices for lipase immobilization[J]. Biotechnology Advances, 2010, 28(3): 395-406.
[13]张媛媛, 聂少平, 万成. 响应面法优化离子交换法固定化β-D- 呋喃果糖苷酶[J]. 食品科学, 2010, 31(19): 236-240.
[15]曹阳, 相姝楠, 甘芝霖. 响应面法优化海藻酸钠-淀粉固定化蒜氨酸酶[J]. 食品工业科技, 2010, 31(7): 162-170.
[16]MONIER M, ELSOKKARY A A M, SARHAN A A. Immobilization ofCandida rugosalipase on modified natural wool fibers[J]. Reactive &Functional Polymers, 2010, 70(2): 122.
Optimization of Immobilization of Lipase Using Response Surface Methodology and Its Performances in Olive Oil Hydrolysis
LIU Zi-qin,HUANG Hui-hua*
(College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, China)
Different carriers such as Sepharose CL-4B and seven kinds of macroporous resins were used to immobilize lipase Palatase 20000L. The lipase showed higher activity and better stablity when immpbilized on macroporous resin type HPD-600 compared with other carriers. Ressponse surface methodolgy was employed to optimize key conditions for the immobilization of lipase Palatase 20000L on macroporous resin type HPD-600 to achieve maximum immobilized lipase activity. The optimal immobilization conditions were found as follows: pH 3.9, enzyme-to-carrier ratio 9.1 mg/g, and adsorption time 1.8 h. Under these conditions, the immobilized lipase achieved its maximum activity, 1440 U/g and a rantivity ecovery above 50%. The optimal reacton temperature of the immobilized lipase was 50 ℃, the optimal reaction pH 8.0, and theKm value 0.130 g/mL, which was higher than that (0.069 g/mL) of the free form. Moreover, the immobilized lipase showed higher thermal stability and maitained over 58% of its original activity after the fifth repeated use.
lipase Palatase 20000L;immobilization;stability;response surface methodology
Q814.2
A
1002-6630(2012)03-0184-06
2011-02-27
国家“863”计划项目(2010AA101505)
刘自琴(1986—),女,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:ziqinliu@126.com
*通信作者:黄惠华(1959—),男,教授,博士,研究方向为食品科学及农产品加工。E-mail:fehhuang@scut.edu.cn

