免疫低下和食物过敏小鼠外周血中细胞因子的变化
张 浩,胡志和*
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
免疫低下和食物过敏小鼠外周血中细胞因子的变化
张 浩,胡志和*
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
建立小鼠免疫低下模型和食物过敏模型,采用ELISA法检测外周血中细胞因子(IL-4、IL-6、IL-10、IL-12、IFN-γ、TGF-β)的变化。结果表明:与空白对照组比较,腹腔注射环磷酰胺所建立免疫低下小鼠胸腺指数和脾脏指数均有显著降低(P≤0.05),且在第3天达到最低;经卵清蛋白致敏小鼠外周血IgE水平极显著升高(P≤0.01)。免疫低下小鼠外周血中IFN-γ(除第3天外)、TGF-β含量(除第3天外)和IFN-γ/IL-4比值均显著降低,而IL-10水平也有下降趋势;除第2天外IL-6水平显著升高,但IL-4水平只在第3天显著性增高,IL-12先是下降随后呈现增多的趋势;食物过敏小鼠的IL-4、IL-6、IL-10和TGF-β水平均有显著性增高,IFN-γ/IL-4比值有显著性下降,而IFN-γ和IL-12没有明显的变化。因此,免疫低下和食物过敏小鼠的Th1/Th2细胞平衡均向Th2细胞偏移,免疫低下对Th1细胞的影响大,食物过敏对Th2细胞的影响更明显。
免疫低下;食物过敏;细胞因子;Th细胞;Th1/Th2细胞平衡
机体免疫系统是由免疫器官、免疫细胞和免疫因子构成的内环境网络体系,该体系的平衡和稳定是维持机体健康存在的基本条件。当机体免疫系统的平衡受到破坏而呈现免疫低下状态时,很可能导致人们许多疾病的引发,例如类风湿关节炎、Ⅰ型糖尿病、系统性红斑狼疮和获得性免疫缺陷综合症(AIDS)等[1]。同样,食物过敏(food allergy,FA)也是由机体免疫系统介导的不良反应而引发,又称为食物超敏反应(food hypersensitivity,FH)。大量研究结果表明,机体在免疫低下或食物过敏状态下其细胞因子发挥着极其重要的免疫调节作用[2-4]。但机体处于该两种状态时体内细胞因子的具体变化情况及两者之间的异同,目前对这类的报道还比较鲜见。本研究以BALB/c小鼠为实验动物,一次性腹腔注射环磷酰胺建立免疫低下模型;以卵清蛋白(ovalbumin,OVA)致敏BALB/c小鼠建立过敏模型,并分析两种状态下外周血中部分细胞因子(IL-4、IL-6、IL-10、IL-12、IFN-γ、TGF-β)的变化及其免疫调节作用,为机体不同免疫状态下功能性食品的研发提供理论依据和参考。
1 材料与方法
1.1 试剂与仪器
药用环磷酰胺(国药准字号H32020857) 江苏恒瑞医药股份有限公司;Albumin Egg(Grade Ⅱ) 美国Sigma公司;氢氧化铝(分析纯) 天津市赢达稀贵化学试剂厂;IL-4、IL-6、IL-10、IL-12、IFN-γ、TGF-β、IgE 小鼠血清ELISA检测试剂盒 美国Rapidbio公司。
FA1104N型电子天平 上海精密科学仪器有限公司;3-18K高速冷冻离心机 德国Sigma公司;Multiskan MK3酶标仪 美国Thermo Labsystems公司。
1.2 实验动物
BALB/c雄性小鼠66只,6~8周龄,体质量18~21g,由中国军事医学科学院实验动物中心提供(SPF级,动物合格证号:SCXK-(军)2007-004)。
1.3 方法
1.3.1 免疫低下模型的建立
BALB/c雄性小鼠50只,预饲养1周,随机分为空白对照组和模型组,每组25只。在第0天模型组一次性腹腔注射80mg/kg(以体质量计)的环磷酰胺,空白对照组注射等量的生理盐水。分别在第1、2、3、4、5天的相同时间点对相应的空白对照组和模型组进行体质量称量,眼球采血,随后处死取脾脏和胸腺并进行称质量,检测其脾脏指数和胸腺指数;血液在静置30min后,1000×g离心10min,吸取上清液,分别在第1、2、3、4天检测其细胞因子水平。

1.3.2 食物过敏模型的建立
BALB/c雄性小鼠16只,预饲养1周,随机分为空白对照组和模型组,每组各8只。然后分3步进行给药处理:1)基础致敏:模型组小鼠在第0天一次性腹腔注射0.5mL的OVA生理盐水溶液(10μg OVA和1mg Al(OH)3溶入 0.5mL生理盐水中);2)强化注射:模型组小鼠在第14天使用含10μg OVA的生理盐水溶液0.5mL腹腔注射进行强化致敏;3)激发肠道过敏反应:模型组小鼠在第24天以0.4mL的OVA生理盐水溶液(50mg OVA溶于0.4mL生理盐水中)进行隔日灌胃处理,共6次,直至第34天结束;空白对照组小鼠进行以上处理时均以相同剂量的生理盐水代替。在最后一次给药1h后进行眼球采血,静置30min后1000×g离心10min,取上清液用于检测细胞因子水平。
1.3.3 细胞因子定量检测
采用ELISA法检测样品中IL-4、IL-6、IL-10、IL-12、IFN-γ、TGF-β、IgE的水平,具体的操作步骤详见试剂盒操作说明书。
1.3.4 数据处理
2 结果与分析
2.1 免疫低下小鼠模型
2.1.1 环磷酰胺对小鼠脾脏指数的影响
表1 环磷酰胺引起小鼠脾脏指数的变化结果(±s,n=5)Table 1 Effect of CY on mouse spleen index (x ± s,n=5)%

表1 环磷酰胺引起小鼠脾脏指数的变化结果(±s,n=5)Table 1 Effect of CY on mouse spleen index (x ± s,n=5)%
注:*.与空白对照组相比,有显著性差异(P≤0.05);**.与空白对照组相比,有极显著性差异(P≤0.01)。下同。
组别 第1天 第2天 第3天 第4天 第5天空白对照组 4.77±0.46 5.25±0.68 5.17±0.71 4.37±0.69 4.89±0.15免疫低下模型组 3.06±0.22*2.79±0.39**2.48±0.18**2.92±0.72**3.56±1.07*
由表1可知,随着时间的推移,免疫低下模型组小鼠的脾脏指数逐渐下降,在第3天时达到最低,随后的2d又呈现增长的趋势。从整体来看,腹腔注射环磷酰胺的免疫低下模型组小鼠和空白对照组小鼠的脾脏指数相比,在5d内均具有显著性差异(P≤0.05)。
2.1.2 环磷酰胺对小鼠胸腺指数的影响
表2 环磷酰胺引起小鼠胸腺指数的变化结果(±s,n=5)Table 2 Effect of CY on mouse thymus index (x ± s,n=5)%
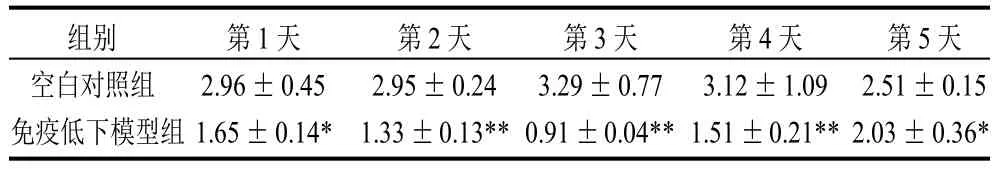
表2 环磷酰胺引起小鼠胸腺指数的变化结果(±s,n=5)Table 2 Effect of CY on mouse thymus index (x ± s,n=5)%
组别 第1天 第2天 第3天 第4天 第5天空白对照组 2.96±0.45 2.95±0.24 3.29±0.77 3.12±1.09 2.51±0.15免疫低下模型组 1.65±0.14* 1.33±0.13**0.91±0.04**1.51±0.21**2.03±0.36*
表3 环磷酰胺对小鼠外周血中细胞因子水平的影响(±s,n=5)Table 3 Effect of CY on cytokine contents in mouse peripheral blood (x± s,n=5)
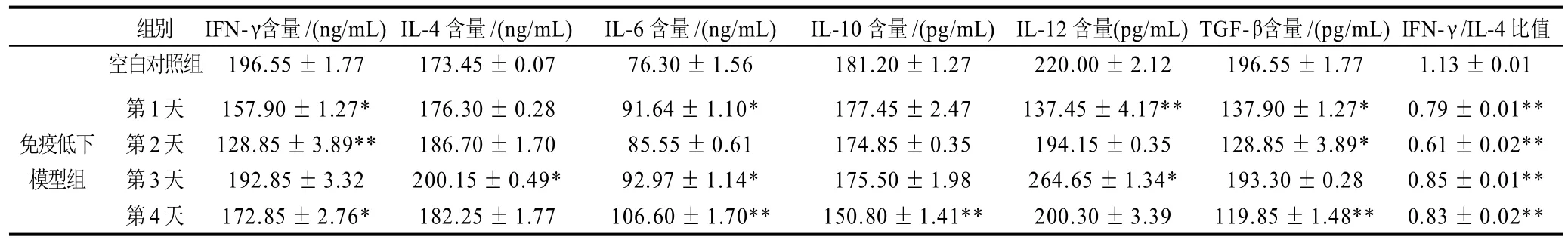
表3 环磷酰胺对小鼠外周血中细胞因子水平的影响(±s,n=5)Table 3 Effect of CY on cytokine contents in mouse peripheral blood (x± s,n=5)
组别 IFN-γ含量/(ng/mL)IL-4含量/(ng/mL) IL-6含量/(ng/mL) IL-10含量/(pg/mL)IL-12含量(pg/mL)TGF-β含量/(pg/mL)IFN-γ/IL-4比值空白对照组 196.55±1.77 173.45±0.07 76.30±1.56 181.20±1.27 220.00±2.12 196.55±1.77 1.13±0.01第1天 157.90±1.27* 176.30±0.28 91.64±1.10* 177.45±2.47 137.45±4.17** 137.90±1.27* 0.79±0.01**免疫低下 第2天 128.85±3.89** 186.70±1.70 85.55±0.61 174.85±0.35 194.15±0.35 128.85±3.89* 0.61±0.02**模型组 第3天 192.85±3.32 200.15±0.49* 92.97±1.14* 175.50±1.98 264.65±1.34* 193.30±0.28 0.85±0.01**第4天 172.85±2.76* 182.25±1.77 106.60±1.70** 150.80±1.41** 200.30±3.39 119.85±1.48** 0.83±0.02**
表4 食物过敏小鼠外周血中细胞因子和IgE水平的变化(±s,n=5)Table 4 Changes of cytokines and IgE in mouse peripheral blood (x ± s,n=5)

表4 食物过敏小鼠外周血中细胞因子和IgE水平的变化(±s,n=5)Table 4 Changes of cytokines and IgE in mouse peripheral blood (x ± s,n=5)
组别 IFN-γ含 IL-4含 IL-6含 IL-10含 IL-12含 TGF-β含 IgE含量/ IFN-γ/IL-4量/(ng/mL) 量/(ng/mL) 量/(ng/mL) 量/(pg/mL) 量/(pg/mL) 量/(pg/mL) (μg/mL) 比值空白对照组 196.55±1.77 173.45±0.07 76.30±1.56 138.95±2.47 220.00±2.12 196.55±1.77 3.24±0.01 1.13±0.01模型组 197.80±0.42 216.45±2.05** 96.64±0.63* 181.20±1.27** 221.2±6.51 221.30±2.55* 4.48±0.01** 0.80±0.01**
由表2可知,随着时间的推移,免疫低下模型组小鼠的胸腺指数逐渐下降,在第3天时同样达到最低,随后的2d也呈现增长的趋势。从整体来看,腹腔注射环磷酰胺的免疫低下模型组小鼠和空白对照组小鼠的胸腺指数相比,在5d内亦均具有显著性差异(P≤0.05)。因此,结合脾脏指数可以得知,一次性腹腔注射环磷酰胺后小鼠在第3天达到了免疫最低状态,同时表明该免疫低下模型的成功建立。
2.1.3 环磷酰胺致免疫低下小鼠外周血中部分细胞因子的变化
由表3可知,免疫低下模型组和空白对照组相比,外周血中IFN-γ水平在4d内均有所下降,在第2天最低且有显著性差异(P≤0.01);IL-4水平有增加的趋势,在第3天最高且有显著性差异(P≤0.05);IL-6整体水平有所增加;IL-10水平有下降的趋势,在第4天水平最低且有极显著性差异(P≤0.01);IL-12水平先是下降随后出现增多的趋势;TGF-β水平显著性下降,但第3天的水平相对较高;IFN-γ/IL-4比值均有显著性下降(P≤0.01),在第2天时其比值达到了最低。
2.2 食物过敏小鼠模型
由表4可知,OVA致敏的小鼠外周血中IgE的含量显著增加,表明该食物过敏模型的成功建立。与空白对照组相比,实验组血清中IL-4、IL-6、IL-10和TGF-β的水平均显著升高(P≤0.05),IFN-γ/IL-4的比值极显著下降(P ≤0.01),但IFN-γ和IL-12水平却没有显著性的变化。
3 讨 论
目前诱导免疫低下动物模型的药物很多,有环磷酰胺、地塞米松、氢化可的松、环孢菌素A、长春新碱等,但国内外在免疫低下模型方面应用最多的依然是环磷酰胺[2,5-7]。环磷酰胺是一种烷基化合物,作为抗肿瘤药物,它普遍应用于人类癌症和自身免疫疾病的化疗中[8]。有研究报道[6-7],环磷酰胺可以抑制体液免疫和细胞免疫,从而造成机体免疫低下状态。而脾脏、胸腺是动物体内主要的免疫器官,其相对质量的变化是反映免疫器官发育和免疫细胞功能状况的直接指标。李业鹏等[9]对BALB/c小鼠一次性腹腔注射40~100mg/kg环磷酰胺后成功建立了免疫低下模型,且在注射24h后便出现脾脏指数的显著下降。本结果也表明,一次性腹腔注射80mg/kg环磷酰胺显著降低了小鼠脾脏指数和胸腺指数,达到了机体免疫低下状态,且均在第3天达到了免疫最低状态。
食物过敏是人体对食物中抗原产生的、由机体免疫系统介导的不良反应,又称为食物超敏反应。绝大部分食物过敏是由蛋、贝类、奶、大豆、花生、大豆、坚果等高致敏性食物引起。目前,国内外针对食物过敏模型的研究多以IgE和组胺含量作为食物过敏的特征性指标,用来衡量机体对食物过敏症状的免疫调节作用[10-12]。Brandt等[13]用OVA诱导的食物过敏小鼠的体内出现IgE水平明显升高,并诱导小肠分泌大量的Th2型细胞因子。由本实验结果可知,通过使用OVA及佐剂Al(OH)3试剂对小鼠两次腹腔注射和多次肠道激发后,其外周血中特异性IgE水平出现显著性增多;在肠道激发阶段90%以上的小鼠出现了抓鼻、毛发稀疏等症状,由此可以判定OVA致小鼠食物过敏模型的成功建立。
20世纪80年代中期Mosmann等[14]首次将CD4+T细胞(Th)分为具有两种功能不同的亚群,即Th1和Th2细胞。前者主要分泌IL-2、IFN-γ、TNF-α、IL-12、IL-17、GM-CSF等,介导细胞免疫应答;后者主要分泌IL-4、IL-5、IL-6、IL-9、IL-10、IL-13和GM-CSF等,介导体液免疫应答。Th1和Th2细胞间的平衡是维持正常免疫功能和身体健康的基础,其中任何一方受到破坏都会发生“Th1/Th2平衡漂移”,从而引发多种免疫性疾病。目前有研究表明,可以将IFN-γ和IL-4分别作为Th1和Th2细胞的特征性细胞因子[15],并通过检测IFN-γ/IL-4的比值变化作为Th1/Th2平衡漂移的指标[2,8-11]。由表3可得知,环磷酰胺致免疫低下小鼠外周血中IFN-γ水平有显著性下降,IL-4水平整体有上升的趋势且在第3天达到了最高,同时结合在4d内均有显著性下降的IFN-γ/IL-4比值,由此可以判定免疫低下小鼠体内Th细胞的平衡偏向了Th2细胞。Matar等[8]用环磷酰胺对大鼠处理后同样发现偏向了Th2细胞及其细胞因子的分泌增多。由表4可知,食物过敏小鼠外周血中虽然IFN-γ水平没有显著性的变化,但IL-4水平却有显著性的升高,从而使IFN-γ/IL-4比值亦有显著性的降低,因此食物过敏小鼠体内Th细胞平衡也偏向了Th2细胞,该结果与白枫等[11]的研究结果一致。这两种免疫状态下IL-4和IFN-γ水平的变化也说明抗炎细胞因子IL-4的增多对前炎细胞因子IFN-γ的分泌产生了一定的抑制作用。然而,通过比较IFN-γ和IL-4水平的变化不难发现,免疫低下机体对Th1型细胞影响较为严重,而食物过敏状态是对Th2型细胞的影响更明显。
IL-10最初被认为主要是由Th2型细胞分泌并用来抑制Th1细胞增殖及其细胞因子分泌,但最近越来越多的研究证明,IL-10其实主要是由CD4+regulatory T cells(Tr1)分泌[16],其免疫抑制性作用不仅针对Th1细胞还针对Th2细胞[17]。Bischoff等[4]报道TGF-β(Th3细胞分泌)和IL-10(Tr1细胞分泌)两者是休戚相关的细胞因子,对Th1和Th2细胞均具有下调的作用,从而更长远的调节Th1/Th2细胞的平衡和稳定。与此同时,这两种细胞因子也可以抑制IgE的产生并分别诱导同型非炎症性免疫球蛋白IgG4和IgA[18]。从本实验结果来看,食物过敏小鼠外周血中作为抗炎细胞因子的IL-10和TGF-β水平均有显著性的增多,既可以防止抗炎细胞因子IL-4的过度分泌,又对Th1/Th2漂移具有一定的免疫调节作用。但同时又观察到免疫低下小鼠外周血中TGF-β有显著性的下降,而IL-10水平也有下降的趋势,由此可以推断环磷酰胺诱导的免疫低下很可能对Th3细胞和Tr1细胞造成了损伤,从而影响其细胞因子的分泌。目前有研究结果表明环磷酰胺可以直接诱导B淋巴细胞的损耗、T细胞的损伤及巨噬细胞的缺陷[19],从而抑制体液免疫和细胞免疫[6-7];此外Matar等[20]研究表明对患有肿瘤的大鼠进行一定量的环磷酰胺处理后可以减少脾脏对IL-10、TGF-β和NO的分泌。
IL-12主要由网状树突细胞(dendritic cells,DCs)、单核细胞、巨噬细胞和中性粒细胞分泌产生。从本实验结果可知小鼠外周血中IL-12水平在免疫低下期间先是下降随后又出现升高的趋势,而在食物过敏期间却没有明显变化,这一现象可能由于IL-12在机体不同免疫状态中的作用有关。作为前炎症细胞因子的IL-12可以促进纯真T细胞( T cell)向Th1细胞的增殖和分化,从而间接促进Th1细胞对IFN-γ的分泌,也可以说DCs分泌IL-12是Th1细胞分泌IFN-γ的始动者[10,21]。而IL-4有诱导CD8α(-)DC前体细胞凋亡,抑制CD8α(-)DC前体细胞增殖的作用[10]。当机体处于免疫低下时,由于Th1细胞受损而导致IFN-γ的分泌明显减少,同时IL-4的相对增多并没有完全抑制CD8α(-)DC前体细胞的增殖,因此DCs对IL-12的分泌就会有所增加而促进Th1细胞的增殖及IFN-γ分泌;然而在食物过敏状态时Th1细胞受损较轻且IFN-γ没有显著性的减少,同时IL-4的显著增多对CD8α(-)DC前体细胞产生了一定的抑制作用,所以DCs对前炎症细胞因子IL-12的分泌也没有显著性的影响。IL-6是一种多效性细胞因子,主要由巨噬细胞、DCs、T细胞和B细胞分泌。许多研究结果已表明IL-6可以将Th1/Th2平衡向促进Th2细胞分化的方向调节,增加其对IL-4的分泌从而抑制Th1细胞功能[22-23]。该实验中的两种免疫状态小鼠外周血IL-6均有显著性的增多,这就说明IL-6增强了Th2细胞对IL-4的分泌,并且促进了向Th2细胞分化的调节。
另外,分析比较表1~3可知,通过免疫器官指数的测定确定了小鼠在第3天时出现了免疫最低下状态,而其细胞因子IFN-γ/IL-4比值却是在第2天时最低,这是由于机体处于免疫最低下状态时呈现了最强抵抗及防御,从而出现了相关细胞因子代偿性的增多以弥补Th1/Th2细胞的平衡,但是这一现象是短暂的,所以随后又出现了IFN-γ/IL-4比值下降的趋势。
通过对BALB/c小鼠分别使用环磷酰胺和OVA从而建立了较好的免疫低下模型和食物过敏模型。这两种模型虽然都出现了向Th2细胞漂移的现象,但免疫低下状态对Th1细胞的影响较大,而食物过敏状态则对Th2细胞的影响更明显。
[1] 姚金晶, 陈宜涛. Th1/Th2平衡调节与疾病发生的研究进展[J]. 现代生物医学进展, 2009, 9(13): 2597-2599.
[2] 彭广华. 从Th1/Th2漂移探讨千佛菌对环磷酰胺模型小鼠的免疫调节作用[J]. 陕西中医学院学报, 2007, 29(3): 17-19.
[3] LARCHE M, AKDIS C A, VALENTA R. Immunological mechanisms of allergen-specific immunotherapy[J]. Nature, 2006, 6: 761-771.
[4] BISCHOFF S, CROWE S E. Gastrointestinal food allergy: new insights into pathophysiology and clinical perspectives[J]. Gastroenterology,2005, 128(4): 1089-1113.
[5] WANG Z W, ZHANG F, GENG Q, et al. Effect of orally administered bovine colostrum on cytokine production in vivo and in vitro in immunosuppressed mice[J]. International Dairy Journal , 2010, 20: 522-527.
[6] ARTYM J, ZIMECKI M, KRUZEL M L. Reconstitution of the cellular immune response by lactoferrin in cyclophosphamide-treated mice is correlated with renewal of T cell compartment[J]. Immunobiology, 2003,207: 197-205.
[7] ARTYM J, ZIMECKI M, PAPROCKA M, et al. Orally administered lactoferrin restores humoral immune response in immunocompromised mice[J]. Immunology Letters, 2003, 89(1): 9-15.
[8] MATAR P, ROZADOS V R, GERVASONI S, et al. Th2/Th1 switch induced by a single low dose of cyclophosphamide in a rat metastatic lymphoma model[J]. Cancer Immunol Immunother, 2002, 50: 588-596.
[9] 李业鹏, 计融, 韩春卉. 建立小鼠免疫低下模型的初步研究[J]. 中国食品卫生杂志, 2001,13(6): 7-10.
[10] 李斐, 黎海芪. 金银花水提物对卵清蛋白致敏小鼠的抗过敏作用研究[J]. 重庆医科大学学报, 2004, 29(3): 288-291.
[11] 白枫, 黎海芪. 黄褐毛忍冬总皂苷对卵清蛋白致敏小鼠的免疫调节作用[J]. 重庆医科大学学报, 2010, 35(4): 504-511.
[12] HALTEREN A G S, CAMMEN M J F, BIEWENGA J, et al. IgE and mast cell responses on intestinal allergen exposure: a murine model to study the onset of food allergy[J]. J Allergy Clin Immunol, 1997, 98(1): 94-99.
[13] BRANDT E B, STRAIT R T, HERSHKO D, et al. Mast cells are required for experimental oral allergen-induced diarrhea[J]. The Journal of Clinical Investigation 2003, 112(11): 1666-1677.
[14] MOSMANN T R, CHERWINSKI H, BOND M W. Two types of murine helper T cell clone I definition according to profiles of lymohokine activities and secreted proteins[J]. J Immunol, 1986, 136(7): 2348-2357.
[15] AKDIS M, VERHAGEN J, TAYLOR T, et al. Immune response in healthy and allergic individuals are characterized by a fine balance between allergen-specific T regulatory 1 and T helper 2 cells[J]. The Journal of Experimental Medicine, 2004, 199(6):1567-1575.
[16] COTTREZ F, HURST S D, COFFMAN R L, et al. T regulatory cells 1 inhibit a Th2-Specific response in vivo[J]. Journal of Immunology,2000, 165(9): 4848-4853.
[17] KOSAKA S, TAMAUCHI H, TERASHIMA M, et al. IL-10 controls Th2-type cytokine production and eosinophil infiltration in a mouse model of allergic airway inflammation[J]. Immunobiology, 2010, 12(9):1-10.
[18] TAYLOR A, VERHAGEN J, BLASER K, et al. Mechanisms of immune suppression by inteleukin-10 and transforming growth factor-β: the role of T regulatory cells[J]. Immunology, 2006, 117(4): 433-442.
[19] BRODE S, COOKE A. Immune-potentiating effects of the chemotherapeutic drug cyclophosphamide[J]. Critical Reviews in Immunology,2008, 28(2): 109-126.
[20] MATAR P, ROZADOS V R, GONZALEZ A D, et al. Mechanism of antimetastatic immunopotentiation by low-dose cyclophosphamide[J].Eur J Cancer, 2000, 36(8): 1060-1066.
[21] WATFORD W T, MORIGUCHI M, MORINOBU A, et al. The biology of IL-12: coordinating innate and adaptive immune responses[J].Cytokine & Growth Factor Reviews, 2003, 14: 361-368.
[22] DIEHL S, RINCON M. The two faces of IL-6 on Th1/Th2 differentiation[J]. Molecular Immunology, 2002, 39(9): 531-536.
[23] DIENZ O, RINCON M. The effects of IL-6 on CD4 T cell reponses[J].Clinical Immunology, 2009, 130(1): 27-33.
Changes in Cytokines in the Peripheral Blood of Immunosuppressed Mice and Those with Food Allergy
ZHANG Hao,HU Zhi-he*
(Tianjin Key Laboratory of Food and Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce,Tianjin 300134, China)
An immunosuppressed mouse model and a mouse mode of food allergy were created and used to determine the changes in cytokines such as IL-4, IL-6, IL-10, IL-12, IFN-γ and TGF-β in the peripheral blood by ELISA. The results showed that the spleen and thymus indices of the immunosuppressed model induced by cyclophosphamide (CY) injection significantly decreased (P ≤ 0.05) compared with the blank control group with the lowest level on the third day of administration. The peripheral blood in the mouse model with allergy to albumin displayed an extremely significantly increase in IgE level (P ≤ 0.01). IFN-γ(except for the third day) and TGF-β (also except for the third day) contents and IFN-γ /IL-4 ratio in the peripheral blood in the immunosuppressed mouse model significantly decreased and IL-10 also showed a decreasing trend. A significant increase in IL-4 level was observed except for the second day, but IL-4 level significantly increased only on the third day, and IL-12 level decreased at first and then increased. The mice allergic to albumin showed significant increases in IL-4, IL-6, IL-10 and TGF-β levels, but a significant decrease in IFN-γ/IL-4 ratio, and no obvious changes in IFN-γ and IL-12 levels. In conclusion, the balance between Th1 andTh2 cells is shifted to Th2 cells in both models. Immunosuppression has a greater impact on Th1 cells but a weaker impact on Th2 cells than food allergy.
immunosuppression;food allergy;cytokine;T helper cell;the balance of Th1/Th2 cells
Q816
A
1002-6630(2012)05-0263-05
2011-07-25
张浩(1985—),男,硕士研究生,研究方向为食品生物技术。E-mail:zhanghao_dengdai@163.com
*通信作者:胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn

