库尔勒香梨苹果褪绿叶斑病毒RNAi载体构建及烟草遗传转化
李诗林,郑银英,崔百明,都业娟,乔亚红,田桂英,向本春
(石河子大学农业生物技术重点实验室/石河子大学生命科学学院,石河子832003)
苹果褪绿叶斑病毒(Apple chlorotic leaf spot virus,ACLSV)最早在1959年由英国学者Luckwill和Campbell报道,命名为大果海棠线斑病毒(Line pattern virus)。我国在1989和1993年由刘福昌等[1]首次报道了苹果和梨树的ACLSV等。苹果褪绿叶斑病毒分布较广,能侵染多种果树,包括苹果、梨、桃、李、樱桃和杏,同时与其他病毒常常引起混合感染,造成树势衰退,果品产量和质量均受严重影响[2-6]。目前,最有效的脱毒方法是采用热处理和茎尖培养结合处理[7],但在田间很难避免病毒的再度感染。近年来,利用RNA沉默实现植物抗病引起了植物病毒学研究的高度关注,并取得了进展[8-10],如朱俊华等获得了马铃薯Y病毒坏死株系免疫抗病转基因植株[10]。同时RNA沉默技术与其他的基因工程方法相比具有很大优势,如对核苷酸序列特异性、高效性、沉默信号的可遗传性和持久性。
为此,本研究主要采用将ACLSV目标基因的正向和反向重复序列分别插入到内含子两侧,构建RNAi干扰载体,通过农杆菌介导的方法转入西方烟中,通过对转基因烟草的抗病性检测试验来评价各RNAi载体的干扰效果,旨在为研究该病毒的主要基因的功能,了解其关键致病因子,提供材料和理论依据,同时也为通过基因工程手段培育和大量繁殖具有高抗或免疫作用的无病毒栽培苗木奠定基础。
1 材料与方法
1.1 材料
2010年3-4月,自库尔勒市、新疆兵团农二师28团和29团和沙依东园艺场采集库尔勒香梨枝条。西方烟(Nicotiana occidentalis)为本实验室保存。
用于构建干扰载体的质粒piRDG12、pBi35SG12、大肠杆菌E.coli DH5α和根癌农杆菌GV1301均由本实验室保存。
实验使用的Taq DNA聚合酶购自上海生工公司;限制性内切酶为Frementas公司产品;克隆载体pGEM-T Easy Vector、M-MLV Reverse Transcriptase、T4DNA连接酶和凝胶电泳DNA回收试剂盒、植物总RNA提取试剂盒等购自Promega公司;DNA Markers购自东盛生物科技有限公司;其他试剂为进口分装或国产分析纯。
1.2 方法
1.2.1香梨枝条的培养
将采集的库尔勒香梨枝条在植物培养室水培3周,待枝条萌发出新芽,采集幼嫩的新芽进行试验。
1.2.2植物总RNA的提取和cDNA的合成
从香梨嫩芽中提取植物总RNA,方法依照Promega公司SV Total RNA Isolation System说明书操作完成。cDNA模板第一链的合成,根据Promega公司M-MLV Reverse Transcriptase的说明书合成。
1.2.3引物的设计与合成
根据GenBank收录的ACLSV基因序列,应用VectorNTI 10.0设计合成引物,试验所用引物均由华大基因合成(表1)。

表1 扩增所需的引物及其序列Tab.1 Primer sequences and the amplified fragments

续表1
1.2.4基因片段的克隆和测序
以cDNA为模板,用引物ACL_SP和ACL_ASP扩增出377bp产物命名为片段PCR-CLA;用引物CL2_SP和CL_ASP扩增出354bp产物命名为片段PCR-CLB。将扩增片段分别克隆到pGEMT Easy Vector,转化大肠杆菌E.coli DH5α感受态细胞,酶切鉴定并送华大基因进行测序。
以含有基因片段PCR-CLA的重组质粒为模板,用引物ACLSP/SP和ACLSP/ASP扩增277bp CLA-f正 向 干 扰 片 段;用 引 物 ACLSP/SP-R 和ACLSP/ASP-R扩增277bp CLA-r反向干扰片段。以含有基因片段PCR-CLB的重组质粒为模板,用引物B5/SP和B5/ASP扩增334bp CLB-f正向干扰片段;用引物B5/SP-R和B5/ASP-R扩增334bp CLB-r反向干扰片段。将各干扰片段用T4DNA连接酶连接到pGEM-T Easy Vector构建重组质粒CLA-f、CLA-r、CLB-f、CLB-r。
1.2.5构建RNAi载体
将CLA-r重组质粒用Sac I/Spe I双酶切,回收并连接到piRDG12相应位点,构成piRD_CLA-r;将CLA-f重组质粒和piRD_CLA-r分别用 BamH I/Kpn I双酶切,回收并连接,构成中间载体piRD_CLA。最后,将piRD_CLA上Xba I/Sac I双酶切片段连接到pBi35SG12相应位点,构成植物表达载体pBi35S_CLA。
将CLB-r质粒用Sac I/Spe I双酶切,收并连接到piRDG12相应位点,构成piRD_CLB-r;将CLA-f质粒和piRD_CLB-r分别用BamH I/Kpn I双酶切,回收并连接,构成piRD_CLB。最后,将piRD_CLB上Xba I/Sac I片段连接到pBi35SG12相应位点,构成植物表达载体pBi35S_CLB。载体结构简图如下:

1.2.6干扰载体遗传转化及转基因植株鉴定
用电击转化法将表达载体pBi35S_CLA和pBi35S_CLB分别转入农杆菌GV1301,采用农杆菌介导的方法转化西方烟。
取生根的抗性植株叶片,用SDS法提取植物基因组DNA作模板,用检测引物SP/pBi35S_CLA和ASP/pBi35S_CLA,SP/pBi35S_CLB 和 ASP/pBi35S_CLB,分别进行PCR扩增,电泳分析。
2 结果与分析
2.1 PCR-CLA和PCR-CLB基因片段克隆及序列分析
从库尔勒香梨枝条新叶提取的总RNA模板中逆转录模板合成cDNA链。用cDNA为模板,加入引物ACL_SP/ACL_ASP和CL2_SP/CL_ASP,经PCR扩增出与预期大小一致的377和354bp产物(图1)。

图1 PCR-CLA和PCR-CLB片段克隆Fig.1 Clone of PCR-CLA and PCR-CLB
序列测序证明PCR-CLA和PCR-CLB分别是ACLSV CP和MP部分片段。经序列比对发现PCRCLA与Genbank中登录号为EU223295、AY669389、X99752、APCCOMS、APCCG、AJ243438、AB326225的其他ACLSV分离物核苷酸序列同源性为74.0%~88.9%;PCR-CLB与以上分离物核苷酸序列同源性为78.7%~92.4%(图2)。

图2 PCR-CLA和PCR-CLB的系统进化树分析Fig.2 Phylogenetic tree of ACLSV from different isolates

图3 CLA-f和CLA-r的克隆Fig.3 Clone of CLA-f and CLA-r
2.2.3构建植物RNAi表达载体pBi35S_CLA及重组子鉴定
将中间载体piRD_CLA用Xba I/Sac I双酶切,回收目的片段(小片段)并连接到pBi35SG12的Xba I/Sac I位点之间,构成重组质粒pBi35S_CLA。
2.2 构建RNAi载体pBi35S_CLA及重组子鉴定
2.2.1克隆干扰片段CLA-f和CLA-r
以PCR-CLA 重 组 质 粒 为 模 板,用 引 物ACLSP/SP和ACLSP/ASP扩增277bp CLA-f正向干 扰 片 段;用 引 物 ACLSP/SP-R 和 ACLSP/ASP-R扩增277bp CLA-r反向干扰片段(图3)。
2.2.2构建中间载体piRD_CLA及重组子鉴定
将CLA-r重组子和piRDG12质粒均Spe I/Sac I双酶切,回收目的基因片段并连接,构成质粒piRD_CLA-r。
将重组质粒 CLA-f和 piRD_CLA-r分别用BamH I/Kpn I双酶切,回收目的片段并连接,构成重组子piRD_CLA-r-f(命名为piRD_CLA)。重组子piRD_CLA经Xba I/Sac I双酶切获得与预期大小一致的857bp片段,说明质粒piRD_CLA构建成功(图4)。

图4 piRD_CLA重组子鉴定Fig.4 Identification of recombinant vector piRD_CLA
重组质粒pBi35S_CLA,用BamH I/EcoICR I双酶切和BamH I/EcoR I双酶切2次鉴定,分别获得与预期大小一致的851bp条带(图5a)和1122bp条带(图5b),说明RNAi表达载体pBi35S_CLA构建成功。

图5 pBi35S_CLA重组子鉴定Fig.5 Identification of recombinant vector pBi35S_CLA
2.3 构建RNAi载体pBi35S_CLB及重组子鉴定
2.3.1克隆干扰片段CLB-f和CLB-r
以PCR-CLB重组质粒为模板,用引物B5/SP和B5/ASP扩增334bp CLB-f正向干扰片段;用引物B5/SP-R和B5/ASP-R扩增334bp CLB-r反向干扰片段(图6)。
2.3.2构建中间载体piRD_CLB及重组子鉴定
将CLB-r重组子进行Spe I/Sac I双酶切,回收小片段(目的基因片段),连接到piRDG12质粒经Spe I/Sac I位点之间,构成质粒piRD_CLB-r。
将重组质粒 CLB-f和 piRD_CLB-r分别用BamH I/Kpn I双酶切,回收目的片段并连接,构成重组子piRD_CLB-r-f(命名piRD_CLB)。重组子piRD_CLB经Xba I/Sac I双酶切获得与预期大小一致的971bp片段,说明质粒piRD_CLB构建成功(图7)。

图6 CLB-f和CLB-r克隆Fig.6 Clone of CLB-f and CLB-r
2.3.3构建植物RNAi表达载体pBi35S_CLB及重组子的鉴定
将中间载体piRD_CLB分别用Xba I/Sac I双酶切,回收目的片段(小片段)并连接到pBi35SG12的Xba I/Sac I位点之间,构成重组质粒pBi35S_CLB。
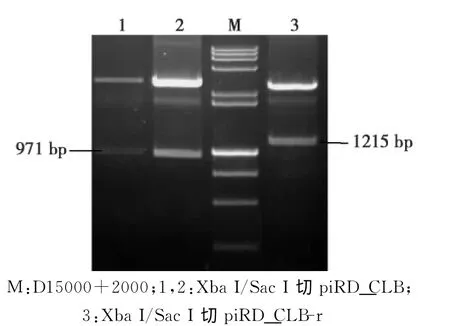
图7 piRD_CLB重组子鉴定Fig.7 Identification of recombinant vector piRD_CLB
质粒pBi35S_CLB用BamH I/EcoICR I双酶切和BamH I/EcoR I双酶切鉴定,获得与预期大小一致的965bp条带(图8a)和1236bp条带(图8b),说明RNAi表达载体pBi35S_CLB构建成功。

图8 pBi35S_CLB重组子鉴定Fig.8 Identification of recombinant vector pBi35S_CLB
2.4 转化农杆菌GV1301及鉴定
采用电击转化法将RNAi表达载体pBi35S_CLA和pBi35S_CLB转入农杆菌GV1301中。用引物 ACLSP/SP和 ACLSP/ASP检测 GV1301_pBi35S_CLA,扩增产物为270bp左右(图9),与预期大 小 一 致;用 引 物 B5/SP 和 B5/ASP 检 测GV1301_pBi35S_CLB,扩增产物为340bp左右(图10),与预期大小一致,说明2个载体均成功转入农杆菌GV1301。

图9 PCR检测GV1301_pBi35S_CLAFig.9 GV1301_pBi35S_CLA tested by PCR

图10 PCR检测GV1301_pBi35S_CLBFig.10 GV1301_pBi35S_CLB tested by PCR
2.5 转基因烟草的检测及鉴定
将RNAi表达载体pBi35S_CLA和pBi35S_CLB通过农杆菌介导的方法获得转基因西方烟。用SDS法提取转基因植株叶片基因组DNA,然后进行PCR检测。
用引物SP/pBi35S_CLA和 ASP/pBi35S_CLA检测47株pBi35S_CLA抗性植株,成功扩增出220 bp目的片段的有27株(图11);用引物SP/pBi35S_CLB和 ASP/pBi35S_CLB检测39株pBi35S_CLB抗性植株,成功扩增出270bp目的片段的有24株(图12)。

图11 转pBi35S_CLA烟草DNA检测Fig.11 Test transgenic plants of pBi35S_CLA by PCR
3 讨论
在新疆特殊的地理位置和气候环境下,各种生物在长期的进化过程中,遗传物质变化及差异性都较大。
根据对本研究中扩增的序列分析比对发现:新疆库尔勒香梨苹果褪绿叶斑病毒的核苷酸序列与其他分离物存在非常大的差异。这些差异性主要表现在该病毒源于不同地域的分离物和源于不同寄主植物的分离物,如本研究中来源于香梨的PCR-CLA和PCR-CLB与来源于桃树分离物(Genbank登陆号EU223295)[11]核苷酸同源性最低,分别为74%和78%;与来源于李树分离物(AJ243438)核苷酸同源性最高,分别为88.9%和92.4%。PCR-CLA与同样来自于新疆库尔勒香梨分离物(AY669389)同源性也只有80.4%。这说明ACLSV病毒的遗传变异性非常大,给检测和研究该病毒带来一定困难。

图12 转pBi35S_CLB烟草DNA检测Fig.12 Test transgenic plants of pBi35S_CLB by PCR
利用RNAi技术实现转基因植株的抗病性更具有特异性、稳定性、可传递性和高效性。但是在设计RNAi载体时,如何选取干扰靶标序列能更有效抑制病毒入侵,其中包括靶标序列的长度,靶标序列位于病毒基因组区段等,还有待进一步深入研究了解。
本研究中,CLB干扰片段和CLA干扰片段分别位于MP基因和CP基因的高度保守区域内,而ACLSV的MP蛋白也属于基因沉默抑制蛋白中的一种,能抑制基因沉默信号的长距离运输[12],希望通过干涉入侵ACLSV病毒的MP蛋白和CP蛋白的合成,来分析了解各病毒蛋白分子在病毒感染过程中所起的作用,所扮演的角色,并进一步了解ACLSV的关键致病因子。同时,希望通过转基因技术培育和繁殖高抗病的苗木资源。
目前,经农杆菌介导的遗传转化,已成功获得2个RNAi载体的转基因烟草,从而为后期对各干扰载体的干涉效果评价试验奠定了材料基础。
[1]刘福昌,王焕玉.苹果潜隐病毒(Latent virus)研究Ⅱ、苹果品种和矮生砧木潜隐病毒鉴定[J].植物病理学报,1989,19(4):193-197.
[2]洪霓,王国平.苹果褪绿叶斑病毒生物学及生化特性研究[J].植物病理学报,1999,29(1):77-81.
[3]Rongrong Tan,Liping Wang,Ni Hong,et al.Enhanced efficiency of virus eradication following thermotherapy of shoot-tip cultures of pear[J].Plant Cell Tiss Organ Cult,2010,101:229-235.
[4]蔡瑜,向本春,席德慧,等.苹果褪绿叶斑病毒库尔勒香梨分离物外壳蛋白基因的序列分析[J].石河子大学学报:自然科学版,2004,22(3):197-199.
[5]马书尚,阮小凤,杨勇.苹果褪绿叶斑病毒的ELISA检测技术研究[J].西北农业大学学报,2000,28(2):27-30.
[6]Zheng Y Y,Wang G P,Hong N,et al.Partial mole cular characterization of Apple chlorotic leaf spot virus from peach and apple trees and prokaryotic expressionfor cp gene[J].Acta Phytopathologica Sinica,2007,37(4):356-361.
[7]王国平,洪霓.果树病毒检测与脱除技术的研究进展[J].华中农业大学学报,2004,23(6):685-691.
[8]Lindbo J A,Silvar Rosales L,Proebsting W M,et al.Induction of a highly specific antiviral state in transgenic plants:implications for regulation of gene expression and virus resistance[J].Plant Cell,1993,5(12):1749.
[9]Andrew J Hamilton,Stephen Brown,Han Yuanhai,et al.A transgene with repeated DNA causes high frequency,posttranscriptional suppression of ACC-oxidase gene expression in tomato[J].Plant Journal,1998,15(6):737-746.
[10]朱俊华,朱常香,温孚江,等.正向和反向RNA重复介导的抗马铃薯Y病毒基因工程比较研究[J].植物病理学报,2004,34(2):133-140.
[11]Marini D B,Gibson P G,Scott S W.The complete nucleotide sequence of an isolate of apple chlorotic leaf spot virus from peach (Prunus persica(L.)Batch)[J].Archives of Virology,2008,153:1003-1005.
[12]Hajime Yaegashi,Tsubasa Takahashi,Masamichi Isogai,et al.Apple chlorotic leaf spot virus 50kDa movement protein acts as a suppressor of systemic silencing without interfering with local silencing in Nicotiana benthamiana[J].Journal of General Virology,2007,88:316-324.

