水稻叶片质膜的纯化及质膜蛋白质双向电泳分析
何 磊,聂燕芳,高元媛,曹 燕,李云锋,王振中
(1 华南农业大学资源环境学院,教育部生物防治工程研究中心,广东广州 510642;2 华南农业大学图书馆,广东广州 510642)
细胞质膜(Plasma membrane,PM)作为植物细胞与外界的屏障,在细胞壁的合成、离子转运和细胞信号转导过程等方面起着重要的作用[1].同时,植物细胞质膜上存在着识别病原菌及感受环境刺激等的大多数受体及早期反应蛋白[2-3],因此植物质膜蛋白质的研究已受到了广泛的关注[2-4].但由于质膜与其他细胞器有相近的组成,且膜结构复杂,给质膜蛋白质的研究带来了困难[5].近年来,植物亚细胞蛋白质组学技术的发展,为从整体水平深入研究质膜蛋白质提供了新的思路和技术平台.
开展植物质膜蛋白质组研究的前提是必需获得高纯度的质膜.由于研究目的和研究材料等的差异,在植物细胞质膜的纯化策略上需针对特定的植物材料及研究目的而进行条件的摸索.目前常用的植物质膜纯化方法主要有离心法、两相分配法、阳离子硅胶法和亲和纯化法等[6].在适合于水稻质膜蛋白质组研究的质膜纯化方法中,大多采用了两相分配法,并在水稻悬浮细胞及根系的质膜纯化方面建立了良好的试验体系[7-10].
以双向电泳(Two-dimensional electrophoresis,2-DE)技术为基础的蛋白质组学研究策略具有分辨率高和重复性好的优点,仍是植物质膜蛋白质组学研究中最常采用的方法之一[11].但由于质膜蛋白质具有疏水性强及丰度较低等特点,因此建立适合于双向电泳的质膜蛋白质组分析方法是非常重要的.本研究对适合于水稻叶片质膜纯化的双水相分配法的条件进行了摸索,并分析了质膜蛋白质的双向电泳,以期为进一步的水稻叶片质膜蛋白质组研究奠定基础.
1 材料与方法
1.1 材料
供试水稻为籼稻品系C101LAC和CO39,由华南农业大学植物病理生理学研究室保存.水稻播种在盛有稻田土的塑料盆中,在24~26℃、每天14 h光照(约 250 μmol·m-2·s-1)的生长室中生长.按常规方法管理,于第4片叶完全展开时采样,取第3和第4片叶.
Beckman超速离心机购自美国Beckman Coulter公司;IPGphor电泳单元、灌胶模具、垂直电泳单元、EPS 301电源购自 Amersham Pharmacia Biotech公司.
1,3-二[三(羟甲基)甲氨基]丙烷(BTP)、2-吗啉乙磺酸(MES)、聚乙二醇(PEG 3350)、聚乙烯吡咯烷酮(PVP k 30)、聚氧乙烯醚(Brij 58)、蔗糖和尿素购自Sigma公司;苯甲基磺酰氟(PMSF)、二硫苏糖醇(DTT)和碘乙酰胺购自Promega公司;硫脲、18 cm(pH 4~7)线性IPG预制胶条和IPG缓冲液(pH4~7)购自Amersham Pharmacia Biotech公司;聚丙烯酰胺凝胶储液、低熔点琼脂糖封胶液购自Bio-Rad公司;葡聚糖(Dextran T 500)购自Pharmacosmos公司;其他试剂均为国产分析纯.
1.2 水稻叶片质膜的分离及纯化
1.2.1 粗质膜的制备 粗质膜的制备参考Whiteman 等[8]和 Chen 等[9]方法,略作修改.将 20 g 水稻叶片液氮研磨至粉末,加入预冷的70 mL提取缓冲液(含250 mmol/L蔗糖,2 mmol/L EDTA,φ为10%甘油,5 g/L BSA,2 mmol/L DTT,1 mmol/L PMSF,15 mmol/L β - 巯基乙醇,6 g/L PVP k30,50 mmol/L BTP-MES,pH 7.8),研磨至匀浆,用 260 μm 孔径的滤网过滤,滤液于12100 r/min离心20 min,取上清液;将上清液于33000 r/min离心40 min,再将沉淀悬浮于6 mL相缓冲液(250 mmol/L蔗糖,3 mmol/L KCl,5 mmol/L KH2PO4,1 mmol/L DTT,pH 7.8)中,所获样品即为粗质膜.以上操作均在4℃进行.
1.2.2 质膜的纯化 质膜的纯化参考Hodges等[12]和Cheng等[13]方法,略作修改.将上述6 mL的粗质膜溶液加入到26 g双水相体系中(聚合物Dextran T 500/PEG 3350质量分数分别为 6.1%、6.2%、6.3%、6.4%和6.5%,250 mmol/L蔗糖,3 mmol/L KCl,5 mmol/L KH2PO4,pH 7.8)混匀,于1100 r/min离心5 min使其分相,取上相,重复3次(每次所获上相分别标记为U1、U2、U3).U3组分用10倍体积的相缓冲液稀释,于39200 r/min离心1 h,取沉淀;将沉淀悬浮于4 mL质膜保存液(250 mmol/L蔗糖,2 mmol/L KCl,1 mmol/L DTT,5 mmol/L BTP-MES,pH 7.8),于39200 r/min离心1 h(2次),再将沉淀悬浮于300 μL质膜保存液,所获样品即为富含质膜的组分.以上操作均在4℃进行.
1.3 质膜纯度鉴定
1.3.1 质膜标志性酶H+-ATPase的活性测定 参照王宁等[14]方法.反应体系为 0.5 mL BTP-MES 缓冲液[含30 mmol/L BTP-MES(pH 6.5),5 mmol/L MgSO4,50 mmol/L KCl,0.2 g/L Brij 58,5 mmol/L Na2-ATP].加入 5 μg 质膜蛋白质启动反应,30 ℃ 保温30 min,加入2.5 mL终止剂[含0.5 mmol/L PVP k30,86 mmol/L(NH2OH)2· H2SO4,5.3 mmol/L EDTA-Na2,φ(H2SO4)=0.2%,13 g/L(NH4)2MoO4]终止反应,再迅速加入0.25 mL显色液(50 mmol/L Na2CO3,6.47 mol/L NaOH) 反 应 30 min,测 定D720nm;以加入煮沸30 min的质膜蛋白质作为空白对照.活性抑制率测定是在上述反应体系中分别加入0.5 mmol/L Na3VO4、50 mmol/L KNO3、1 mmol/L NaN3和1 mmol/L Na2MoO4后,测定 D720nm,再分别计算不同抑制剂所抑制的H+-ATPase活性在总活性中所占的比例.以酶反应液中有无去垢剂Brij 58时,质膜H+-ATPase活性抑制率的变化来检测质膜的方向性.
1.3.2 质膜的电镜观察 参考Roland等[15]方法,并稍作修改.将粗质膜与纯化的质膜溶液于12100 r/min离心1.5 h后,取沉淀;将沉淀分别于 φ为2.5%戊二醛中固定8 h、0.1 g/L四氧化锇中固定2 h、酒精脱水、用环氧丙烷和Epon 812完全渗透,再分别于45℃聚合24 h、60℃聚合24 h,用超薄切片机切片,镍网收集,再进行柠檬酸铅-醋酸铀双染色,用FEI型透射电镜(荷兰Tecnai 12)进行观察.
1.4 电泳样品制备
参考Cheng等[13]方法,略作修改.将质膜样品用4 mL 洗涤液[含 10 mmol/L Tris-HCl(pH 7.8),5 mmol/L KCl]于33000 r/min离心1 h(2次).将沉淀用增溶缓冲液(含7 mol/L尿素,2 mol/L硫脲,φ为0.5%IPG Buffer(pH 4 ~7),20 mmol/L DTT,40 g/L CHAPS,10 g/L ASB-14)溶解,于 9680 r/min 离心5 min,取上清液.
1.5 SDS-PAGE
取质膜蛋白质样品(20 μg)进行电泳,分离胶质量浓度为120 g/L,浓缩胶质量浓度为50 g/L.采用胶体考染法对凝胶进行染色[16],用 UMAX 2100XL光密度扫描仪对凝胶进行扫描,并用Quantity One 4.6.3一维分析软件(Bio-Rad)对 SDS-PAGE 图谱进行分析.
1.6 双向电泳
取质膜蛋白质样品(200 μg)于350 μL增溶缓冲液中水化16 h后,进行第一向固相梯度等电聚焦电泳(Isoelectric focusing,IEF),IEF聚焦参数为:300 V慢速升压0.5 h;500 V慢速升压0.5 h;1000 V慢速升压0.5 h;5000 V快速升压1.5 h;8000 V快速升压聚焦60000 Vh,水化和聚焦温度为20℃.等电聚焦结束后取出胶条,在平衡液Ⅰ[含50 mmol/L Tris-HCl(pH 8.8),6 mol/L 尿素,φ =30% 甘油,20 g/L SDS,20 g/L DTT]中振荡平衡15 min,再于平衡液Ⅱ[含 50 mmol/L Tris-HCl(pH 8.8),6 mol/L 尿素,φ=30%甘油,20 g/L SDS,25 g/L碘乙酰胺]中平衡15 min.第二向SDS-PAGE质量浓度为120 g/L,电泳参数为16 mA.采用质谱兼容的银染法对凝胶染色[18],用UMAX 2100XL光密度扫描仪扫描凝胶,并用 PDQuest 8.0 图像分析软件(Bio-Rad)对 2-DE图谱进行分析.试验以3次分别提取的质膜蛋白质样品作为重复.
1.7 蛋白质含量测定
蛋白质含量测定按照 Bradford等[19]方法,以BSA为标准蛋白质.
2 结果与分析
2.1 双水相体系中不同聚合物质量分数对质膜纯化效果的影响
采用不同质量分数的PEG 3350/Dextran T 500双水相分配体系对水稻叶片质膜进行了纯化.结果表明:双水相分配体系中聚合物质量分数不同,细胞质膜在上相中的分配情况有明显差异.图1的结果表明,随聚合物浓度升高,上相中的质膜蛋白质产率明显下降.图2的结果表明,聚合物质量分数不同,不同内膜标志酶H+-ATPase对特异性抑制剂的敏感性存在明显的差异.H+-ATPase对钒酸盐敏感性先升后降,在 PEG 3350/Dextran T 500质量分数为6.3%时H+-ATPase相对活性最高(93.5%),而各种内膜(V型和F型)的H+-ATPase相对活性分别为9.4%和7.6%,非特异性磷酸酶相对活性为5.6%.综合比较质膜产率和纯度,选用质量分数为6.3%的PEG 3350/Dextran T 500聚合物组成的双水相体系可以获得高纯度的质膜及较高的蛋白质产率,适合于水稻叶片细胞质膜的纯化.
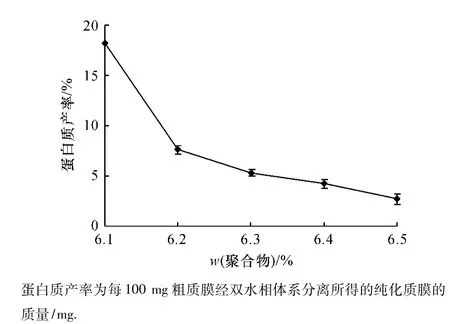
图1 聚合物质量分数对水稻叶片质膜蛋白质产率的影响Fig.1 Effect of polymer concentration on the productivity of rice PM proteins isolated by two aqueous phase partitioning
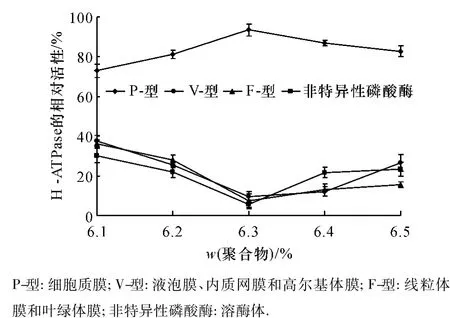
图2 聚合物质量分数对水稻叶片质膜H+-ATPase相对活性的影响Fig.2 Effect of polymer concentration on relative activities of H+-ATPase in rice leaves PM isolated by two aqueous phase partitioning
2.2 质膜纯度鉴定
2.2.1 粗质膜经3次双水相体系分配后的各组分标志酶活性的测定 采用w为6.3%的PEG 3350/Dextran T 500双水相体系对水稻叶片来源的粗质膜进行了纯化.粗质膜及3次分配所获上相(U1、U2和U3)的质膜标志酶(H+-ATPase)对特异性抑制剂的敏感性测定结果如表1.表1的结果表明,粗质膜经3次分配后,H+-ATPase对钒酸盐的敏感性从45.2%升高到93.5%,表明随分配次数的增加,质膜的纯度越高;V型(液泡膜、内质网膜、高尔基体膜等)H+-ATPase对KNO3的敏感性从65.3%下降至9.4%;F型(线粒体和叶绿体)H+-ATPase对NaN3的敏感性从73.6%下降至7.6%;非特异性磷酸酶(溶酶体)对Na2MoO4的敏感性从40.8%下降至5.6%,说明质膜组分的杂质(其他内膜组分)随分配次数的增加而减少.上述结果表明,w为6.3%的 PEG 3350/Dextran T 500双水相体系对粗质膜进行3次分配后,可以有效减少V型和F型等其他内膜杂质,获得高纯度的质膜.
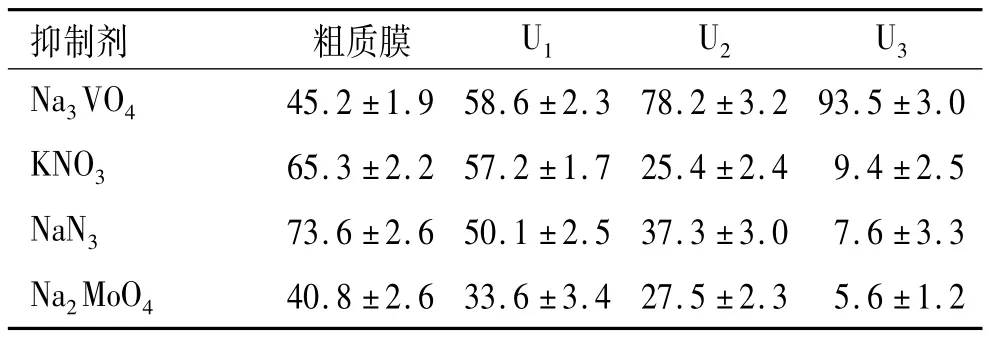
表1 粗质膜和质膜囊泡H+-ATPase的相对活性1)Tab.1 Relative activities of H+-ATPase on crude PM and PM vesicles isolated by two aqueous phase partitioning from rice leaves %
2.2.2 质膜电镜观察 由于柠檬酸铅-醋酸铀双染色能使所有的质膜囊泡浅着色,因此可通过质膜组分的复杂程度来判断质膜的纯度[13].采用柠檬酸铅-醋酸铀双染色,对水稻叶片粗质膜和纯化后的质膜进行了电镜观察.结果(图3)表明,粗质膜组分比较复杂,而纯化后的质膜比较均一;表明粗质膜经过双水相体系的3次分配后获得了高纯度的质膜.

图3 水稻叶片粗质膜和纯化质膜经柠檬酸铅和醋酸铀双染色后的电镜图谱Fig.3 Electron micrographs of rice leaves crude PM and purified PM from rice leaves with uranyl actate-lead citrate staining
2.3 双水相分配法对质膜蛋白质产率的影响
采用w为6.3%的PEG 3350/Dextran T 500双水相体系对水稻叶片质膜进行纯化后,对粗质膜及双水相体系3次分配所获得的上相(U1、U2和U3)的质膜蛋白质产率进行了测定.结果表明,100 mg粗质膜蛋白质经3次分配,U1、U2和U3组分的蛋白质产率分别为11.37、6.46和2.73 mg;即粗质膜经过3次双水相分配后的蛋白质产率为2.73%.
2.4 水稻叶片质膜的定向
对酶反应体系中有无去污剂(Brij 58)时质膜H+-ATPase的活性变化进行了测定,结果表明在有非离子型去垢剂Brij 58(ρ=0.2 g/L)条件下,H+-ATPase的活力比无Brij 58条件下的提高了60%,表明经双水相分配法提取的水稻叶片细胞质膜微囊封闭性较好,主要为正向型质膜微囊.
2.5 水稻叶片质膜蛋白质的SDS-PAGE
将水稻叶片粗质膜及纯化后的质膜进行SDSPAGE,考马斯亮蓝染色结果如图4.用Quantity One 4.6.3软件对其进行分析,发现粗质膜有21个蛋白质条带,纯化后的质膜则有23个蛋白质条带,相对分子质量主要分布于12000~80000之间.该结果表明,与粗质膜相比,纯化质膜中的一些特定蛋白质条带消失或者丰度减少,可能与粗质膜中的杂蛋白得到了去除有关;同时,由于减少了杂蛋白,粗质膜和纯化质膜在同等上样量的条件下,使质膜中其他蛋白质的丰度得到了有效增加(或新出现),使蛋白质条带的分布更为均匀,有利于基于SDS-PAGE/质谱技术为基础的质膜蛋白质组分析.
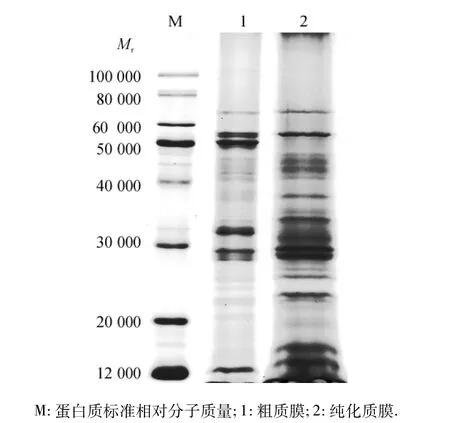
图4 水稻叶片粗质膜和纯化质膜的SDS-PAGE图谱Fig.4 SDS-PAGE image of crude and purified PM proteins isolated from rice leaves
2.6 水稻叶片纯化质膜蛋白质的双向电泳
为了进一步检测所纯化的水稻叶片质膜是否合适于双向电泳,本试验采用对疏水性蛋白质具有高溶解性的增溶缓冲液对质膜蛋白质进行了溶解.经2-DE、质谱兼容的银染法染色、图像扫描,获得了水稻第4叶片质膜蛋白质的2-DE图谱(图5).PDQuest 8.0软件分析结果表明,2-DE图谱中共有(579±17)个蛋白质点,且具有良好的重复性;同时2-DE图谱背景清晰,蛋白质点分布均匀,没有明显的纵向拖尾和水平横纹现象.
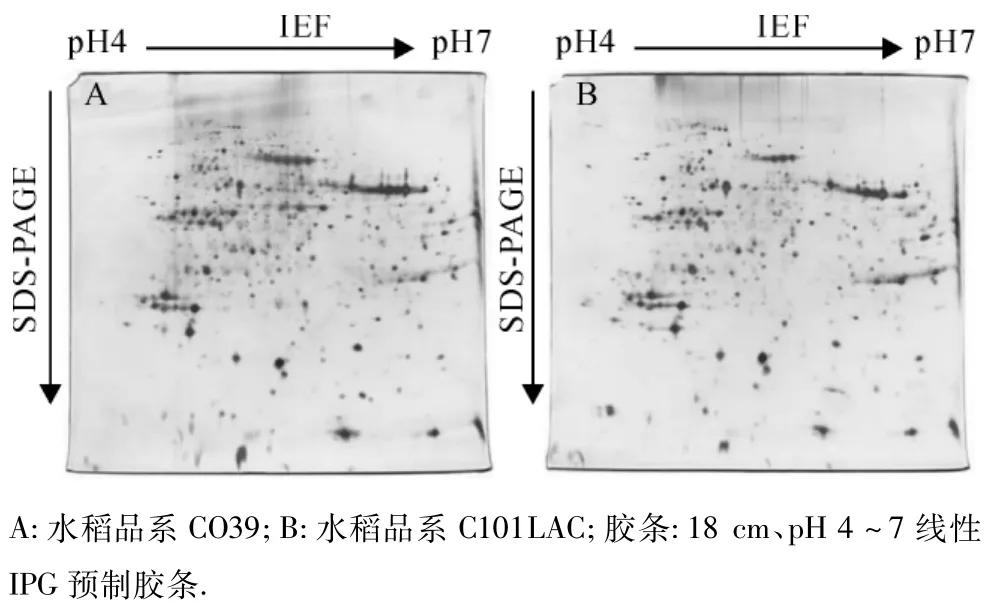
图5 水稻叶片质膜蛋白质的双向电泳图谱Fig.5 Representative 2-DE patterns of PM proteins from rice leaves
3 讨论
PEG/Dextran双水相分配法是目前纯化植物细胞质膜最常用的方法之一,其原理主要是根据不同的膜微囊在两相中的分配系数不同而达到分离的目的,其中质膜倾向于分配PEG上相部分,而其他内膜倾向于分配Dextran下相部分[20].研究表明,由于所分析植物样品的来源和研究目的不同,其细胞质膜的特性也不同;因此在利用双水相分配法制备细胞质膜时,需针对特定的植物材料而进行条件优化.其中,聚合物浓度和盐浓度是最主要的影响因素,一般由高浓度的聚合物和较低盐浓度组成的双水相体系可以获得较好的植物细胞质膜的纯化效果[21-23].本研究在低盐浓度(3 mmol/L KCL)下结合离心法,对不同浓度的PEG 3350/Dextran T 500双水相体系分离纯化水稻叶片质膜的效果进行了探索,结果表明:聚合物质量分数为6.3%的双水相体系具有最好的纯化效果;相对于传统的蔗糖密度梯度离心方法(质膜纯度一般为60% ~70%),该方法所获的质膜纯度更高(达90%以上).
由于细胞质膜与其他内膜系统(如液泡膜、内质网膜和高尔基体膜等)在结构和功能上都联系紧密,加上其密度相近,且容易发生粘连,因此纯化的细胞质膜很容易受到这些内膜的污染.一般细胞质膜的纯度评价可以从形态学观察、特异性酶的活性测定和特异抗体检测等方面进行,且一般采用2种或以上的方法同时检测[24-25].H+-ATPase 是细胞质膜及其他内膜系统的特异性标志酶,可分为P型、V型和F 型三大类[6].根据各细胞器 H+-ATPase 的活性测定结果就可以计算出提取的细胞器相对于匀浆液的富集度和其他细胞器的污染程度.本试验结果表明:纯化质膜的H+-ATPase对Na3VO4敏感性很高,而对KNO3、NaN3和Na2MoO4的敏感性很低,说明该组分中的内膜污染少.同时,本试验还结合柠檬酸铅-醋酸铀双染色法,对质膜进行了电镜观察,结果表明:纯化后的质膜微囊大小较均匀,边缘完整清晰,表明质膜获得了较好的纯化.
一般认为质膜囊泡以2种类型存在,即正向型和外向型;正向型是指质膜微囊的朝外侧是原质膜的胞质外侧,外向型是指质膜微囊的内侧、外侧分别是原质膜的外侧和内侧.而酶分子在膜上的定向可受其分离方法或介质的影响,因此确定酶在质膜上的方向性是必需的[26].通常采用在有无去垢剂条件下,根据H+-ATPase活性变化来分析质膜的封闭性和方向性.本试验结果表明,在有Brij 58存在时,比无Brij 58条件下的H+-ATPase活力提高了60%,这说明分离纯化的质膜囊泡的封闭性较好,基本上为正向封闭囊泡.
双向电泳(2-DE)技术是经典蛋白质组学的核心技术,相比其他方法,具有较高的分辨率和良好的重复性;但由于质膜蛋白质疏水性较强,传统的尿素-去垢剂混合物对于质膜蛋白质的溶解效果不理想,因此基于2-DE技术为基础的质膜蛋白质组学研究面临较大的困难.随着新的非离子去污剂和两性去污剂的使用,目前这一问题也已逐步得到了解决[26-27].研究表明,新的非离子去污剂和两性去污剂能较好地溶解质膜蛋白质[28].Santoni等[29]利用两性离子去垢剂ASB-14对模式植物拟南芥的质膜蛋白进行了分析,发现ASB-14能够使更多疏水性的膜蛋白溶解,并能在2-DE图谱上清晰显示.Twine等[30]采用ASB-14和CHAPS对土拉弗菌Francisella tularensis的质膜蛋白质进行了有效的分离.本试验采用了两性离子去垢剂(ASB-14和CHAPS)对水稻叶片的质膜蛋白质进行溶解,在2-DE胶上获得了较多的质膜蛋白质点[共有(579±17)个],且在2个水稻品系中均有良好的重复性.
亚细胞结构的分离和纯化是对全细胞蛋白质分离方法的补充,这种策略的优点在于减少了全细胞的复杂性,而保留了细胞生物学的功能结构.目前在蛋白质组学技术尚待完善的情况下,其研究的初始样本越简单,研究结果则越细致.本试验采用双水相分配法对水稻叶片质膜进行了纯化,一方面降低了样品的复杂度(减少了其他内膜蛋白质的污染),使分析简单化;另一方面可以富集相应亚细胞结构的低丰度蛋白质,对于水稻质膜蛋白质组的研究将奠定良好的基础.
[1]MARMAGNE A,ROUET M A,FERRO M,et al.Identification of new intrinsic proteins in Arabidopsis plasma membrane proteome[J].Mol Cell Proteomics,2004,3:675-691.
[2]ALEXANDERSSON E,SAALBACH G,LARSSON C,et al.Arabidopsis plasma membrane proteomics identifies components of transport,signal transduction and membrane trafficking[J].Plant Cell Physiology,2004,45:1543-1556.
[3]HÜCKELHOVEN R.Transport and secretion in plantmicrobe interactions[J].Current Opinion in Plant Biology,2007,10:573-579.
[4]HOEFLE C,HÜCKELHOVEN R.Enemy at the gates:traffic at the plant cell[J].Cellular Microbiology,2008,10(12):2400-2407.
[5]SPRENGER R R,SPEIJER D,BACK J W,et al.Comparative proteomics of human endothelial cell caveolae and rafts using two-dimensional gel electrophoresis and mass pectrometry[J].Electrophoresis,2004,25(1):156-172.
[6]张玲,刘录群,黄有国.胡杨质膜的纯化及其H+-ATPase活性的研究[J].生物化学与生物物理进展,2000,27(6):637-640.
[7]齐耀程,王宁,程彦伟,等.水稻根尖质膜蛋白质组学研究方法的建立[J].中国水稻科学,2008,22(2):11-17.
[8]WHITEMAN S A,NÜHSE T S,ASHFORD D A,et al.A proteomic and phosphproteomic analysis of Oryza sativa plasma membrane and vacuolar membrane[J].The Plant Journal,2008,56:146-156.
[9]CHEN Fang,YUAN Yue-xing,LI Qun,et al.Proteomic analysis of rice plasma membrane reveals proteins involved in early defense response to bacterial blight[J].Proteomics,2007,7:1529-1539.
[10]MALAKSHAH S N,REZAEI N H,HEIDARI M,et al.Proteomics reveals new salt responsive proteins associated with rice plasma membrane[J].Biosci Biotechnol Biochem,2007,71(9):2144-2154.
[11]KOMASTU S.Plasma membrane proteome in Arabidopsis and rice[J].Proteomics,2008,8:4137-4145.
[12]HODGES T K,MILLS D.Isolation of the plasma membrane[J].Methods in Enzymology,1986,118:41-54.
[13]CHENG Yan-wei,QI Yao-cheng,ZHU Qian,et al.New changes in the plasma-membrane-associated proteome of rice roots under salt stress[J].Proteomics,2009,9:3100-3114.
[14]王宁,齐耀成,徐朗莱,等.水稻根质膜蛋白质双向电泳水化液的优化[J].西北植物学报,2007,27(12):2371-2378.
[15]ROLAND J C,LEMBI C A,MORRE D J.Phosophotungtic acid-chromic acid as a selective electron-dense stain for plasma membranes of plant cells[J].Stain Technol,1972,47:195-200.
[16]NEUHOFF V,STAMM R,EIBL H.Clear background and highly sensitive protein staining with coomassie blue dyes in polyacrylamide gels:A systematic analysis[J].E-lectrophoresis,1985,6(9):427-448.
[17]YAN J X,WAIT R,BERKELMAN T,et al.A modified silver staining protocol for visualization of proteins compatible with matrix-assisted laser desorption/ionization and electrospray ionization mass spectrometry[J].Electrophoresis,2000,21(17):3666-3672.
[18]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[19]WIDELL S,LARSSON C.Separation of presumptive plasma membranes from mitochondria by partition in an aqueous polymer two-phase system [J].Plant Physiology,1981,51:368-374.
[20]LARSSON C,WIDELL S,KJELLBOM P.Preparation of high-purity plasma membranes[J].Methods in Enzymology,1987,148:558-568.
[21]王细娥,张丽军,谢锦云,等.蛋白质组研究中细胞质膜的纯化和纯度鉴定研究进展[J].生命科学研究,2006,10(2):15-20.
[22]胡章立,荆家海.两相法分离玉米幼苗叶片生长部位质膜[J]. 西北植物学报,1998,18(1):83-89.
[23]TANAKA N,FUJITA M,HANDA H,et al.Proteomics of the rice cell:Systematic identification of the protein populations in subcellular compartments[J].Mol Genet Genomics,2004,271:566-576.
[24]VERONIQUE S,JOELLE V,DELPHINE P,et al.A proteomic study reveals novel insights into the diversity of aquaporin forms expressed in the plasma membrane of plant roots[J].Biochem J,2003,373:289-296.
[25]邱全胜,苏雪峰.小麦根质膜H+-ATPase的部分纯化[J]. 植物学报,1999,41(6):629-632.
[26]BRAUN R J,KINKL N,BEER M.Two-dimensional electrophoresis of membrane proteins[J].Anal Bioanal Chem,2007,389:1033-1045.
[27]LUCHE S,SANTONI V,RABILLOUD T.Evaluation of nonionic and zwitterionic detergents as membrane protein solubilizers in two dimensional electrophoresis[J].Proteomics,2003,3:249-253.
[28]MARMAGNE A,SALVI D,ROLLAND N,et al.Purification and fractionation of membranes for proteomic analyses[J].Methods Mol Biol,2006,323:403-420.
[29]SANTONI V,KIEFFER S,DESCLAUX D,et al.Membrane proteomics:Use of additive main effects with multiplicative interaction model to classify plasma membrane proteins according to their solubility and electrophoretic properties[J].Electrophoresis,2000,21(16):3329-3344.
[30]TWINE S M,MYKYTCZUK N C S,PETIT M,et al.Francisella tularensis proteome:Low levels of ASB-14 facilitate the visualization of membrane proteins in total protein extracts[J].Proteome Res,2005,4(5):1848-1854.

