可可西里-唐古拉山冻土区沉积物样品可培养微生物的研究
杨爱臣,吕杰,鲁建江
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,石河子832000)
冻土是指零摄氏度以下,并含有冰的各种岩石和土壤。一般可分为短时冻土(数小时/数日以至半月)/季节冻土(半月至数月)以及多年冻土(数年至数万年以上)。地球上多年冻土/季节冻土和短时冻土区的面积约占陆地面积的50%,其中,多年冻土面积占陆地面积的25%。冻土是一种对温度极为敏感的土体介质,含有丰富的地下冰[1]。永久冻土区域的环境为该地区的微生物群落提供了一个很特殊的生存环境,比如地质时间,温度,压力和辐射,另外冻土区中水与有机物质的缺少也导致了冻土区的微生物的特殊性。因此,冻土区的微生物曾被Friedmann等[2]比喻为“幸存的菌落”。
早在19世纪末和20世纪初期,俄罗斯科学家在研究西伯利亚猛犸象时,就在多年冻土中发现了微生物的存在。此后,关于多年冻土微生物的研究报道时有出现。直到20世纪90年代,随着低温生物学研究的广泛和深入,冻土微生物的研究再次引起了人们的关注。Omelyansky[3]在1911年曾报道了Siberian发现了存活的微生物。同样,在加拿大,阿拉斯加和南极冰川等地也有冻土区发现微生物的报道[4-5]。1997年,Shi等[6]使用培养微生物的方法并使用16S r DNA的方法鉴定了Kolyma低地永久冻土区的微生物,自此低温培养和寡营养培养基开始用来分析冻土区微生物。青藏高原是地球上最大及最年轻的高原,其上分布有面积达15×105km2的多年冻土,它们是青藏高原自然生态系统的组成部分。开展青藏高原多年冻土中的微生物的研究,对于探讨高原乃至全球气候环境变化、碳循环以及生物多样性均具有重要意义,尤其是在极端环境条件下生命特征和适应机制的探索已成为生命科学和地球科学交叉的一个国际前沿领域,加强不同地质时期和现代极端环境及其生命过程的研究,具有重要的理论和实践意义[7]。
我国多年冻土面积占全国陆地总面积的22.3%,其中,位于青藏高原的中国高海拔多年冻土面积居全球首位,冻土对我国经济建设和人民生活有举足轻重的影响。近40多年来,我国冻土学的研究获得了长足发展,处于国际领先地位[8],然而对青藏高原冻土地区的微生物的分析,尤其是浅层的活动层土壤的分析至今仍然很少。并且由温室效应导致的冻土冻融使对冻土区表层的活动层微生物群落的分析变得迫在眉睫[9]。由于青藏高原的高海拔与低纬度的特性,使得该地区拥有一个很特别的微生物的生长环境。
Susanne[10]在2009年对西伯利亚的勒拿河三角洲地区的冻土活动层进行了微生物的系统多样性分析,杨大群[9]对天山冷环境中微生物系统多样性及分布特征进行了研究,但是青藏高原的冻土活动层到目前为止知之甚少。本文中选取了青藏高原可可西里唐古拉山地区哈达煤矿附近的活动层及冻土层的土壤作为研究材料,通过传统的微生物培养和分离以及16S r DNA的提取和鉴定进行了可培养微生物的多样性的分析。
1 材料与方法
1.1 样品来源及取样方法
取样地点位于青藏高原可可西里-唐古拉山冻土区中的青藏公路沿线上沱沱河附近达哈煤矿中,该地区地理位置34°14′32.2″N,93°21′19.5″E,海拔为4491 m,年均气温为 -6.1~-6.4℃,年降水量为240~320 mm,多年冻土层厚100 m,活动层厚度约为1 m。地层以粘土为主,含水量约为12%~15%。取样通过内径为5 cm的空心人工钻取样,深度最深约为1.5 m。
在如上描述的地点中取冻土区表层土壤样品,深度为20 cm和150 cm,编号为KT1和KT2。为避免污染,在取样操作过程中使用无菌手套取出土壤,并将外围可能受到污染的部分去掉以保证样品的质量,取样过程中铲子等器具在取样前已消毒。
1.2 微生物的分离及测序
1.2.1培养基和培养过程
土壤浸出液:土壤50g,无菌水50m L,配制完毕后静置1 d。
培养基选用寡营养的PYGV和常用富营养的LB培养基分别培养。PYGV培养基适于嗜冷微生物的寡营养生长,LB培养基则适于常规微生物的富营养培养。
PYGV培养基:矿质元素溶液20.00 m L,蛋白胨0.25 g,酵母提取物0.25 g,琼脂15.00 g,无菌水965.00 m L,混合在115℃下灭菌20 min,冷却后加无菌的葡萄糖溶液10.00 m L,再加入10 m L的青藏高原冻土土壤浸出液,最后体积补至1000 m L。
矿质元素溶液(100m L):NTA,1 g;MgSO4·7 H2O,2.97 g;CaCl2,0.252 g;Na2MoO4·2 H2O,1.267 mg;FeSO4·7 H2O,0.01 g,去离子水90 m L,微量元素溶液5 m L。(配置时先加入NTA,再加入其它盐,用KOH和H2SO4,调整p H值7.2,体积补至100 m L)。
微量元素溶液(100 mL):Na-EDTA,0.025 g;Zn-SO4·7H2O,0.1095 g;FeSO4·7H2O,0.05 g;MnSO4·H2O,0.0154 g;CuSO4·5H2O,0.00392 g;Co(NO3)2·6H2O,0.00248 g;Na2B4O7·10H2O,0.00177 g;去离子水100 mL。配制完毕后静置2 d溶解。
葡萄糖水溶液:葡萄糖:2.5 g,去离子水100 m L。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,无菌水965 m L(配置时用 KOH 和H2SO4,调整p H 值7.2,体积补至1000 m L)。
将从青藏高原冻土区取来的样品在不同浓度梯度下涂布,并于于10℃、25℃下恒温培养,将灭过菌的土壤稀释后涂布在10℃和2℃温度下做对照试验。分别在25℃下培养1个月与在10℃下培养3个月后记录实验数据。所有样品分别培养3次以排除偶然因素。
将样品土壤进行涂布后,25℃下培养30 d后进行菌落计数,10℃下培养90 d后进行菌落计数,并计算菌落形成单位(CFU),总共分离出46株微生物的纯培养。
1.2.2 16S rDNA的分析
将培养得到的菌落挑取少许高温破壁后提取出16S r DNA并使用引物27F和1492R进行扩增。PCR反应体系:0.25μL EX Taq DNA聚合酶,10×Taq buffer 5μL,d NTP 4μL,引物1μL,水38 μL,模板1μL。反应:94℃预变性5 min,30次循环(95℃变性30 S,55℃复性30 S),72℃1 min 30 S延伸,最后延伸为72℃10 min。引物分别是27F,5′-AGAGTTTGATCCTGGCTCAG-3′(Escherichia coli positions 8-27)和1492R,5′-GGTACCTTGTTACGAC TT-3′(1492-1509)。将 PCR 反应所得 PCR 反应原液进行测序(华大基因公司测序),得到菌株的16S r DNA。
1.2.3系统发育树的建立
将PCR反应得到的16S r DNA测序后在NCBI数据库中与已知菌种进行比对,得出与培养得到的菌种相似度最高的已知菌种的16S r DNA。将得到所有的序列用CLUSTAL X进行比对,比对结果中模糊信息和空白比对用软件seaview4编辑并删除。使用CLUSTAL X将编辑过的比对结果做系统发育树并对其分析[11-15]。
2 结果及分析
2.1 可培养微生物分布分析
对所采土壤样品进行微生物培养,利用PYGV、LB培养基获得的可培养微生物数量如表1和表2所示。

表1 PYGV培养基下得出微生物Tab.1 Microbes incubated in PYGV medium

表2 LB培养基下得出微生物Tab.2 Microbes incubated in LB medium
由表1、表2可知,LB培养基,可可西里-唐古拉山冻土地区表层土壤中的微生物在PYGV培养基上更容易生长,并且呈现出更好的多样性。由于PYGV培养基属于寡营养培养基,在PYGV培养基中含有较少的营养物质。对可培养的微生物的分析可推测该地区表层土壤中的微生物更适应在寡营养的环境下生长。
在PYGB培养基培养中,样品KT1和KT2在10℃的培养环境下得到了更多的菌株,都在低温环境下表现出来更多的微生物多样性。因此可推断出样品中的微生物在低温条件下有更好的生长趋势,说明了冻土区土壤中含有较多的耐冷或嗜冷微生物。在LB培养基中,在10℃的培养环境下KT1样品得到了5条菌株,而KT2样品中未得到菌株,此现象说明冻土区浅层的活动层土壤中存在较多的正常温度下可以生长的微生物,而冻土区深层的土壤中更多微生物是耐冷或嗜冷微生物。而且在LB培养基中在25℃温度条件下比10℃的培养环境下得到更多的菌株说明在LB培养基中能够生长的微生物属于非耐冷或嗜冷微生物。
2.2 可培养微生物多样性分析
将分离得到的微生物培养测序后与GENE bank中的数据进行比对并进行系统发育分析(图1),这些细菌在系统进化树上分为3大类群:放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)其中丰度和多样性最高的为放线菌门,其次为变形菌门。其中放线菌门的细菌是优势菌,其次变形菌门较多。
2.2.1表层土中可培养微生物多样性分析
由表3可知,样品KT1中有13条菌株属于变形菌门(Proteobacteria),其中7条属于α-变形菌门(Alphaproteobacteria),6条属于γ-变形菌门(Gammaproteobacteria)。7条属于厚壁菌门(Firmicutes),14条菌株属于放线菌门(Actinobacteria)。
菌株 KT1_21,KT1_25,KT1_31,KT1_27,KT1_13,KT1_4,KT1_32这7条菌株属于α-变形菌门(Alphaproteobacteria)。菌株KT1_33,KT1_9,KT1_15,KT1_12,KT1_2,KT1_1这6条菌株属于 γ-变形菌门(Gammaproteobacteria)。菌株KT1_28,KT1_10,KT1_7,KT1_20,KT1_23,KT1_22,KT1_3这7条菌株属于厚壁菌门(Firmicutes)。菌株 KT1_34,KT1_19,KT1_18,KT1_35,KT1_14,KT1_24,KT1_26,KT1_5,KT1_29,KT1_30,KT1_11,KT1_17,KT1_8,KT1_6这14条菌株属于放线菌门(Actinobacteria)。
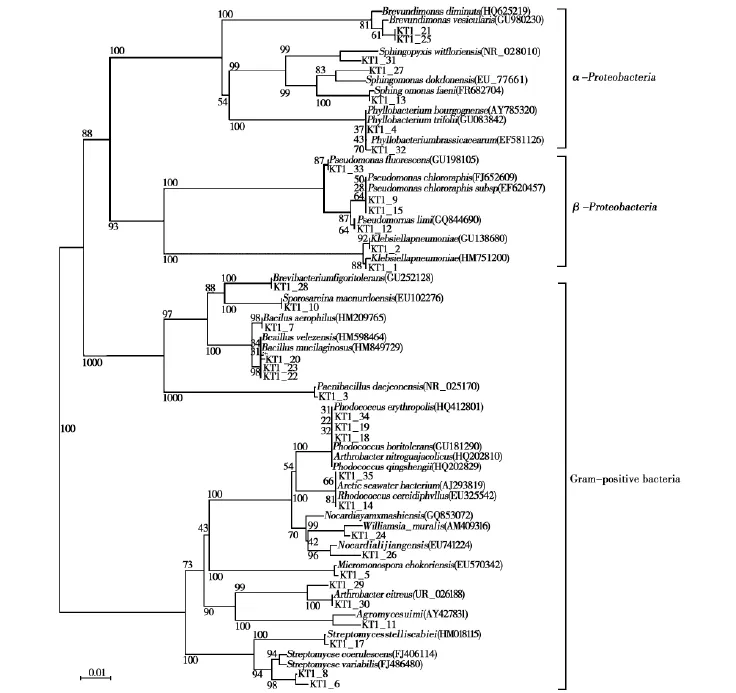
图1 可可西里-唐古拉山冻土区活动层土壤样品KT1中分理出菌种的16S rDNA的系统发育树Fig.1 Phylogenetic dendrogram based on the comparison of the 16S rDNA sequences of microbes isolated from sample KT1 of Hoh Xil-Tanggula mountains permafrost active layer soil

表3 与样品KT1分离出的菌株的相似序列的相似度Tab.3 Sequences compared with isolates of Sample KT1

续表3
2.2.2深层土壤中可培养微生物多样性分析
由图2可知,样品KT2中有4条细菌属于变形菌门(Proteobacteria),其中3条属于α-变形菌门(Alphaproteobacteria),1条属于β-变形菌门(Betaproteobacteria)。六条菌株属于放线菌门(Actinobacteria),1条属于厚壁菌门(Firmicutes)。菌株KT2_3,KT2_2,KT2_1,这三条菌株属于α-变形菌门(Alphaproteobacteria)。菌株 KT2_4属于β-变形菌门(Betaproteobacteria),也是本研究结果中唯一一株属于β-变形菌门的菌株。该菌株与种Massilia niastensis(HM209779)中的菌株有最高为99%的相似度。菌株 KT2_6,KT2_7,KT2_8,KT2_9,KT2_10,KT2_5,这6条菌株属于放线菌门(Actinobacteria)。菌株KT2-11是样品KT2中唯一1株属于厚壁菌门(Firmicutes)的菌株,该菌株与种Exiguobacterium sibiricum(GQ869573)中的菌株有最高为100%的相似度(表4)。
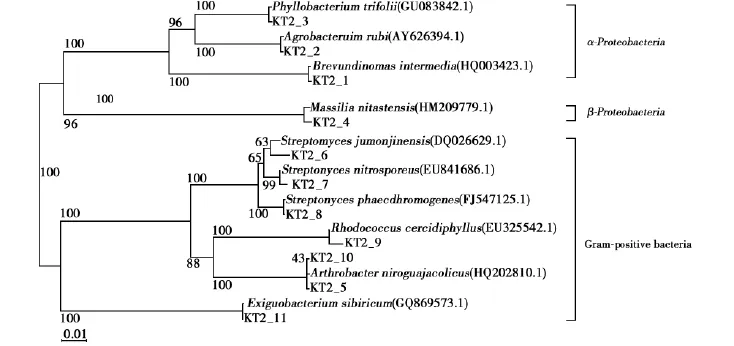
图2 可可西里-唐古拉山冻土区活动层土壤样品KT2中分理出菌种的16S rDNA的系统发育树Fig.2 Phylogenetic dendrogram based on the comparison of the 16S rDNA sequences of microbes isolated from sample KT2 of Hoh Xil-Tanggula mountains permafrost active layer soil
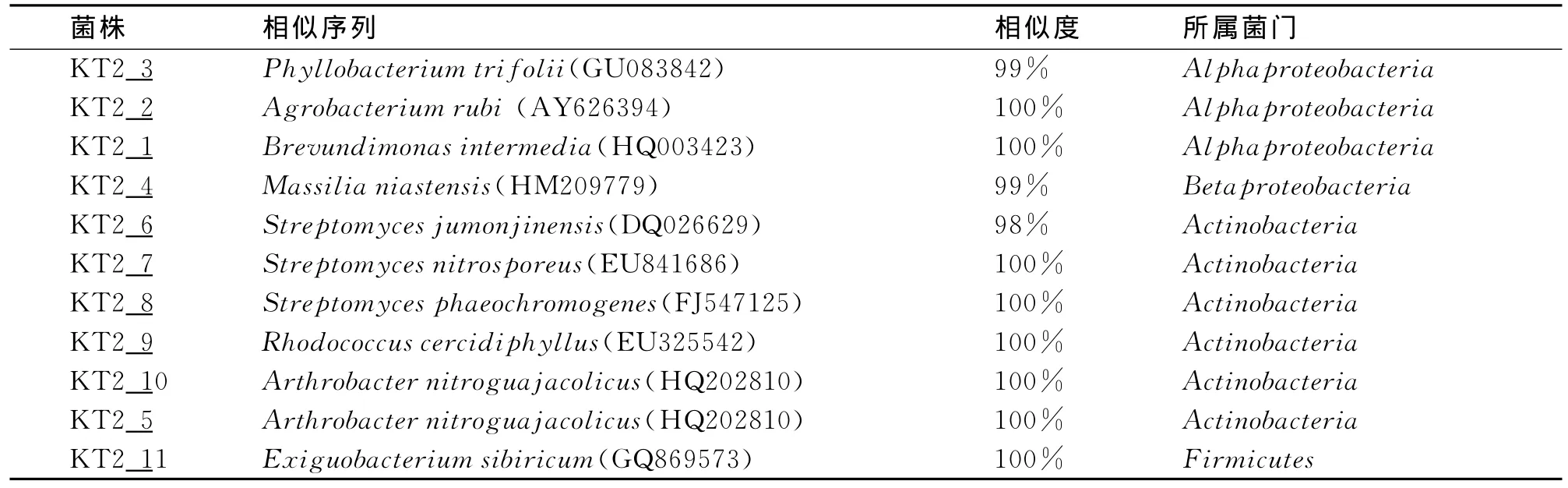
表4 与样品KT2分离出的菌株的相似序列的相似度Tab.4 Sequences compared with isolates of Sample KT2
3 结论
本文对从青藏高原可可西里地区达哈煤矿附近的冻土环境中的土壤样品进行分析和研究,总共分离出的46条菌株中,29条菌株(63.0%)分离于PYGV培养基,表明冻土微生物更适于在寡营养环境中生长。在PYGV培养基中分离的29条微生物中有17(58.6%)条分离于10℃的低温环境,表明在寡营养环境中分离出的微生物更易生存与低温环境,而在LB培养基中分离的17条微生物中有12条(70.1%)分离于25℃的常温环境,表明在富营养环境中分离出的微生物更易于在常温中生存。在冻土区的活动层中,由于冻融以及植被的原因,该层突然中微生物的生存的平均温度和营养成分均高于永久冻土层,因此,浅层土壤中微生物比深层永久冻土层微生物更易于生长才常温及富营养的环境中。从筛选结果还可得青藏高原冻土区的土壤中含有较多的耐冷及嗜冷微生物,反映其具有特殊的生理活动机制,也表明微生物种群的变异与所处的环境有关。在这46株被发现的菌株中,通过系统发育树分析以及16S r DNA相似度的详细比对,这些菌株属于:放线菌门、厚壁菌门、变形菌门,其中变形菌门和放线菌门占优势地位,并且从系统发育树上可以看出青藏高原上可以分离的微生物数量和多样性随土壤中深度的增加急剧减少。
[1]Muller S.Permafrost or permanently frozen ground and related engineering problems[M].New York:Strategic Eng,1943:231-232.
[2]Friedmann E I.Permafrost as microbial habitat.In:Gilinchisky DA[M].Moscow:Academy of Science,1994:21-26.
[3]Omelyansky V L.Bakteriologicheskoe issledovanie Sanga mamonta Prilegayushchei pochvy Bacteriological investiga-tion of the Sanga mammoth and surrounding soil[M].Moscow:Arkhiv Biologicheskikh Nauk,1911:335-340.
[4]James N,Sutherland M L.Are there living bacteria in permanently frozen subsoil[J].Can J Res Sect C Bot Sci,1942,20(6):228-235.
[5]Cameron R E,Morelli F A.Viable microorganisms from ancient Ross Island and Taylor Valley drill core[J].Antarct J US,1974,9(3):113-116.
[6]Shi T,Reeves R H,Gilichinsky D A,et al.Characterization of viable bacteria from Siberian permafrostby 16S rDNA sequencing[J].Microb Ecol,1997,33(3):169-179.
[7]程国栋.中国冰川学和冻土学研究40年进展和展望[J].冰川冻土,1998,20(3):213-226.
[8]杨思忠,金会军,魏智,等.微生物对冻土生境的适应以及对全球变化和寒区工程扰动的响应:进展与展望[J].冰川冻土,2007,29(2):280-283.
[9]杨大群.天山冷环境中微生物系统多样性及分布特征的研究[D].兰州:兰州大学,2008.
[10]Susanne L,Katja R,Torben S,et al.Diversity of aerobic methanotrophic bacteria in a permafrost Active layer soil of the lena delta,siberia[J].Microb Ecol,2009,57(6):25-35.
[11]Thompson,J D,Gibson T J,Plewniak F,et al.The ClustalX windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Res,1997,25(6):4876-4882.
[12]Saitou N,Nei M.The neighbor-joining method:a new method for reconstructing phylogenetic trees[J].Mol Biol Evol,1987,4(3):406-425.
[13]Felsenstein,J.Confidence limits on phylogenies:an approach using the bootstrap[J].Evolution,1985,39(3):783-791.
[14]Kumar S,Tamura K,Jakobsen I B,et al.MEGA2:molecular evolutionary genetics analysis software[J].Bioinformatics,2001,17(6):1244-1245.

