IL-17在结直肠癌中的表达及其意义
地力下·司马义,李峰,张文杰
(石河子大学医学院病理系/新疆地方病与民族高发病教育部重点实验室,石河子832002)
结直肠癌是一种常见的消化道恶性肿瘤,局恶性肿瘤发病率第三位[1]。结直肠癌发病率较高的地区为欧美发达国家,澳大利亚男性和女性发病率分别为48.2/万和36.9/10万[2],北美发病率为44/10万,随着我国工业化程度的增加,我国的结直肠癌发病率出现增长趋势,男性发病率为15/10万,女性发病率为9.7/10万;病死率为8.6/10万和5.4/10万[3]。结直肠癌的发病危险因素主要包括:饮食和生活方式——高脂肪、高热量和缺乏运动;肠道的慢性炎症,目前已经证实肠道的长期慢性炎症可以进展为癌[4];Crohn病;非甾体类抗炎药的过量使用及遗传背景。结直肠癌的治疗主要是手术切除辅以放疗和化疗,手术切除肠内息肉可以有效的预防结直肠癌的发病。近年的研究发现IL-17在多种自身免疫性疾病及肿瘤中发挥重要作用,对IL-17的研究可以为结直肠癌的分子靶向治疗提供新的思路。
IL-17的发现已有二十年,IL-17作为一种促炎症因子发现参与多种自身免疫性疾病以及某些肿瘤的发病过程。在IL-17敲除的小鼠黑色素瘤及膀胱癌模型中肿瘤的生长速度明显低于野生型小鼠[5]。TH 细 胞 在IL-6,IL-23,TGF-β 的 作 用 下 分 化 为TH17细胞,分泌IL-17,通过激活IL-17下游靶基因及信号通路,可以促进成纤维细胞,巨噬细胞,内皮细胞和上皮细胞增殖,促进炎症细胞浸润并且扩大炎症反应,最终促进上皮细胞内瘤变而导致肿瘤的发生。同时TH17细胞分泌的IL-17具有促血管生成作用,与以上作用一起促进肿瘤的发生。肿瘤组织通过释放前列腺素2(PGE2)可以增加TH17细胞的分化,使整个过程不断放大。但是IL-2,IL-4,IL-10,IFN-γ又可以抑制 TH17细胞的分化,从而对抗IL-17的促肿瘤作用[6-8]。由此得出,对IL-17的研究可以为肿瘤特异性分子靶向治疗提供一个新思路,提示阻断IL-17可以抑制肿瘤的发生及进展。
1 材料与方法
1.1 材料
收集我院2004年1月1日至2008年12月31日手术切除的结直肠癌组织石蜡标本95例,年龄范围33岁至85岁,年龄中位数66岁。其中结肠癌43例,直肠癌42例。淋巴结转移37例,无淋巴结转移58例。按照2000年版世界卫生组织消化系统肿瘤分类标准对癌组织进行组织学分型。其中中分化腺癌79例,低分化腺癌15例,未分化癌1例。并且取癌旁组织(切缘距离癌灶边缘5cm以外的组织)90例作为对照组。所有患者术前均未接受放疗、化疗及免疫治疗。
1.2 方法
采用免疫组织化学S-P法。组织标本经过10%福尔马林固定,常规石蜡包埋,5μm连续切片。脱蜡水化后,用p H6.0枸橼酸盐缓冲液中高压热修复。首先将枸橼酸盐修复液在高压锅中煮沸,再放入切片,盖上锅盖,高火烧至冒气,再调至低火,电磁炉功率800W,130℃煮2 min。随后打开锅盖,自然冷却30 min。
随后在每张切片上滴加IL-17抗体(Sant Cruz,美国,兔抗人多克隆抗体,SC-7927,稀释比例1∶200),过夜后用PBS泡洗,滴加二抗和三抗(Ivitrogen,美国),DAB(中杉金桥)显色,复染。
1.3 结果
光学显微镜(400倍)下观察切片,抗体染色评分标准为:组织切片以细胞浆染色浅棕黄色至棕褐色为阳性。阳性细胞百分率<5%为0分,6%~25%记为1分,26%~50%为2分,51%~75%为3分,≥75%记4分;着色强度,无着色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分;评分结果计算为:阳性细胞百分率分数×着色强度分数,所得分数为0~1分时,分级为(-);2~4分为(+);5~8分为(++);9~12分为(+++)。400倍光学显微镜下观察切片,随机取3个视野计数细胞浆阳性细胞数,取其平均值来判断IL-17的表达情况。
1.4 统计学分析
统计学分析 使用SPSS17.0统计软件,各组数据均以均数+标准差表示。两组间比较使用非参数检验,P<0.05差异有统计学意义。
2 结果
通过对95例结直肠癌组织和90癌旁组织的IL-17含量的检测,我们发现在癌组织中IL-17的含量明显高于癌旁组织,在癌组织中有2例IL-17表达阴性,47例阳性,46例强阳性;而在癌旁组织中有33例IL-17的表达为阴性,48例为阳性,没有强阳性表达。差异有统计学意义(P<0.05)(表1)。随后我们对37例淋巴结转移和58例无淋巴结转移的癌组织进行分析,发现在有淋巴结转移和没有淋巴结转移的组之间P>0.05,IL-17的表达含量没有明显差异(表2)。另外,我们又按照分化程度,对中分化癌和低分化癌进行比较,P>0.05结果显示IL-17的表达含量与分化程度没有相关性(表3)。
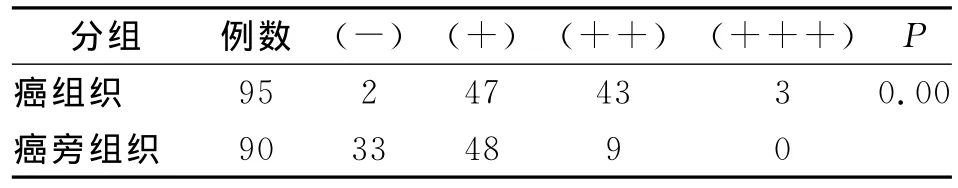
表1 癌组织和癌旁组织IL-17含量对比Tab.1 Contents of IL-17 in Cancerous and paracancerous tissues
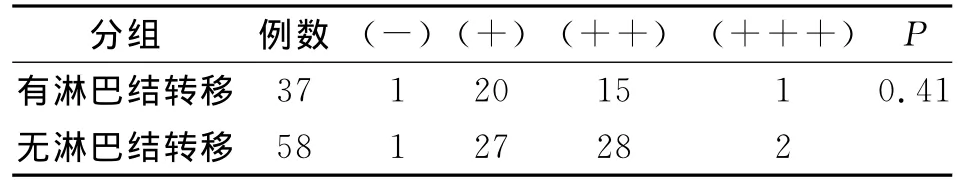
表2 淋巴结转移和无淋巴结转移组织IL-17含量对比Tab.2 Contents of IL-17 in lymph node meta static and non-metastatic tissues
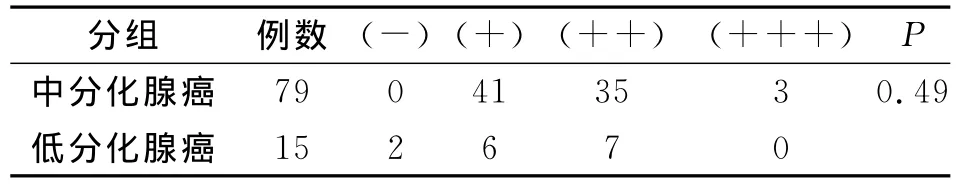
表3 中分化腺癌与低分化腺癌IL-17含量对比Tab.3 Contents of IL-17 in moderately and poorly differentiated adenocarcinome
结肠癌组织中IL-17主要表达在细胞浆,并且IL-17的表达量与病人年龄,分化程度等并无相关性。
3 讨论
IL-17作为一种促炎症因子,于1993年首次被克隆出来,随后被命名为IL-17[7,9-11],后续的研究发现IL-17可以促进自身免疫性疾病,并且促进由炎症介导的促肿瘤效应。IL-17及其信号通路在乳腺癌,宫颈癌及结直肠癌中可以促进这些肿瘤的发生过程。IL-17由CD4+T细胞分泌,有六个亚型,分别 为 IL-17A,IL-17B,IL-17C,IL17-D,IL-17E,IL-17F。人类的IL-17A是由150个氨基酸编码的蛋白质,其分子量为15k Da,借助二硫键结合形成分子量为30-35k Da的同源二聚体[7]。IL-17A 与IL-17F有60%的同源性,编码IL-17A和IL-17F的基因位于6号染色体[7]。IL-17A 和IL-17F 都是由TH17细胞分泌的,TH17细胞还分泌IL-21,IL-10,IL-22在机体各个组织器官中起重要作用[12]。
IL-17的分化过程为:TNF-α通过刺激APC细胞分泌IL-6及IL-23,TGF-β与IL-23作用于TH17细胞通过活化的STAT3通路分泌IL-17。STAT3通路的活化诱导肿瘤相关巨噬细胞(TAM)经由NF-κB/Rel A直接转录活化IL-23p19基因分泌IL-23,并且STAT3的可以活化抑制肿瘤相关的DC细胞 中 NF-κB/c-Rel 依 赖 的 IL-12p35 基 因 的 表达[13]。另一方面,TH2细胞通过活化的STAT6通路分泌IL-4,IL-12,两者作用于TH1细胞通过活化STAT4通路分泌IFN;一同抑制TH17细胞通过活化的 STAT3 通 路 分 泌IL-17[5,14-16]。同 时 肿 瘤 组织释放的PGE2也能促进TH2细胞分泌IL-4,同时PGE2也可以促进TH17的分化过程。肿瘤组织释放的TGF-β作用于Treg细胞抑制TH17的分化。IL-17刺激中性粒细胞和巨噬细胞分泌IL-1,IL-6等细胞因子来促进肿瘤血管生成,促进肿瘤侵袭以及促进肿瘤的远处转移。同时IL-17作用于炎症局部可以促进局部组织增生[5]。
目前的研究均证实,IL-17及其信号通路可以促进肿瘤的发生与进展。TH1细胞通过分泌IFN-γ来发挥抗肿瘤免疫功能,并且可以抑制TH17细胞的分化。从而抑制IL-17的促肿瘤作用。在敲除IFN-γ的小鼠黑色素瘤、膀胱癌模型中,IL-17的表达明显增高,而且肿瘤生长大小也明显大于IFN-γ+/+的小鼠。在IL-17-/-的小鼠模型中,肿瘤生长速度及肿瘤大小均小于IL-17+/+的小鼠,说明IL-17的过量表达可以促进结直肠癌的发生。而且在IL-17-/- 的小鼠中,磷酸化的 Stat3(p-Stat3)的表达量也明显低于野生小鼠;而IFN-γ对Stat3的活化起抑制作用。并且IL-17对Stat3的下游靶基因Bcl-2和Bcl-XL有正调节作用[5]。同时,随着肿瘤组织中IL-17的表达增加可以促进如血管内皮生长因子,MMP9的表达增加,这些因子直接参与了肿瘤血管生成作用,对肿瘤的生长有重要意义。肿瘤组织中IL-17的过量表达也可以促进炎症细胞的浸润,促进成纤维细胞增殖,同时肿瘤组织中通过释放PGE2对TH17细胞的分化有正反馈调节作用,使IL-17的促肿瘤作用不断放大。
在IL-17的促肿瘤作用中有一个不可忽视的因素,信号传导与转录因子3。Stat3是Stat家族成员,具有很强的促肿瘤增殖,抗凋亡,促肿瘤血管生成作用。在肿瘤细胞中激活的Stat3促进抗肿瘤免疫分子的表达,肿瘤组织自身也可以上调Stat3的表达,增加免疫抑制因子的表达如IL-6,IL-10,TGF-β,FOXP3 和 VEGF[17-19]。Stat3的持续高表达会抑制抗肿瘤免疫分子的表达。但是IL-17并不是直接激活Stat3,体外实验已经证实,IL-17在肿瘤组织中首先是促进IL-6的表达,随后再经由IL-6激活Stat3[15]。IL-6激活肿瘤组织中的Stat3后,可以增强肿瘤细胞抗凋亡能力,促进肿瘤转移,促进肿瘤血管生成作用,并且能够抑制局部的促炎症反应。IL-17诱导的IL-6的高表达同时又可以促进肿瘤组织中TH17细胞的分化,从而使整个促肿瘤反应不断放大反复循环。
本研究通过检测人类结直肠癌石蜡标本中的IL-17含量进一步证实,IL-17可以通过其信号通路来促进肿瘤的发生及进展,我们的结果显示,在癌组织中IL-17的含量要明显高于癌旁组织,而且IL-17的表达增加并不是整个机体的表达水平增加,而是癌组织中的IL-17表达增加。这正说明在癌组织中IL-17大量积聚,通过IL-17诱导的IL-6的表达使Stat3磷酸化,磷酸化的Stat3(p-Stat3)具有较强的促肿瘤细胞增殖,抗凋亡,促进肿瘤转移,促进肿瘤血管生成作用,并且可以促进上皮内瘤变的发生,并且促进上皮内瘤变向癌的进展[4]。由此我们推测,通过在癌组织内增加IL-2,IL-4,IL-10,IFN-γ的含量以此来抑制TH17细胞的分化,还可以通过特异性阻断癌组织中的IL-17,从而对抗IL-17的促肿瘤作用。从而为结直肠癌的分子靶向治疗提供新的思路。
[1]Parkin D M.Global cancer statistics in the year 2000[J].Lancet Oncol,2001,2(1):533-543.
[2]Parkin D M,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA:a cancer journal for clinicians,2005,55(10):74-108.
[3]杨玲,李连弟,陈育德,等.中国2000年及2005年恶性肿瘤发病死亡的估计与预测[J].中国卫生统计,2005,6(2):22-27.
[4]Wu S,Rhee K-J,Albesiano E,et al.A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses[J].Nature medicine,2009,15(7):1016-1022.
[5]Wang L,Yi T,Kortylewski M,et al.IL-17 can promote tumor growth through an IL-6-Stat3 signaling pathway[J].Journal of Experimental Medicine,2009,206(2):1457-1464.
[6]Aujla S J,Chan Y R,Zheng M,et al.IL-22 mediates mucosal host defense against Gram-negative bacterial pneumonia[J].Nat Med,2008,14(3):275-281.
[7]Fossiez F,Djossou O,Chomarat P,et al.T cell interleukin-17 induces stromal cells to produce proinflammatory and hematopoietic cytokines[J].J Exp Med,1996,183(20):2593-2603.
[8]Guzzo C,Che Mat N F,Gee K.Interleukin-27 induces a STAT1/3-and NF-B-dependent proinflammatory cytokine profile in human monocytes[J].Journal of Biological Chemistry,2010,285(37):24404-24411.
[9]Rouvier E,Luciani M,Mattei M,et al.CTLA-8,cloned from an activated T cell,bearing AU-rich messenger RNA instability sequences,and homologous to a herpesvirus saimiri gene[J].The Journal of Immunology,1993,150(20):5445.
[10]Yao Z,Fanslow W,Seldin M,et al.Herpesvirus Saimiri encodes a new cytokine,IL-17,which binds to a novel cytokine receptor[J].Immunity,1995,3(1):811-821.
[11]Yao Z,Painter S L,Fanslow W C,et al.Human IL-17:a novel cytokine derived from T cells[J].J Immunol,1995,155(26):5483-5486.
[12]Chang S H,Dong C.A novel heterodimeric cytokine consisting of IL-17 and IL-17F regulates inflammatory responses[J].Cell Research,2007,15(9):30-32.
[13]Xu M,Mizoguchi I,Morishima N,et al.Regulation of antitumor immune responses by the IL-12 family cytokines,IL-12,IL-23,and IL-27[J].Clinical and Developmental Immunology,2010,27(2):1-9.
[14]Wei L,Laurence A,Elias K M,et al.IL-21 is produced by th17 cells and drives IL-17 production in a STAT3-dependent manner[J].Journal of Biological Chemistry,2007,282(40):34605-34610.
[15]Yu H,Kortylewski M,Pardoll D.Crosstalk between cancer and immune cells:role of STAT3 in the tumour microenvironment[J].Nature Reviews Immunology,2007,13(7):41-51.
[16]Agache I,Ciobanu C,Agache C,et al.Increased serum IL-17 is an independent risk factor for severe asthma[J].Respir Med,2010,104(29):1131-1137.
[17]Kasprzycka M,Marzec M,Liu X,et al.Nucleophosmin/anaplastic lymphoma kinase(NPM/ALK)oncoprotein induces the T regulatory cell phenotype by activating STAT3[J].Proc Natl Acad Sci U S A,2006,103(30):9964-9969.
[18]Sumimoto H,Imabayashi F,Iwata T,et al.The BRAFMAPK signaling pathway is essential for cancer-immune evasion in human melanoma cells[J].The Journal of experimental medicine,2006,203(7):1651.
[19]Zorn E,Nelson E A,Mohseni M,et al.IL-2 regulates FOXP3 expression in human CD4+ CD25+regulatory T cells through a STAT-dependent mechanism and induces the expansion of these cells in vivo[J].Blood 2006,108(24):1571.

