基于八羧基酞菁铝近红外荧光检测铜(Ⅱ)离子
刘 峰,夏新泉,陈 灵,张海丽
(湖北师范学院 化学与工程学院, 湖北 黄石 435002)
铜是动植物体内一种必需的微量重金属元素,参与体内20多种重要酶的构成,如细胞色素氧化酶,过氧化物歧化酶,酪氨酸酶等,这些酶大多与人体的氧化还原反应有关[1]。研究表明,体内铜含量过低会导致贫血,但过量的铜也会导致机体功能紊乱产生许多疾病,如:老年痴呆症[2],威尔森氏症[3],门克氏综合症[4]及肌萎缩性侧索硬化症[5]等, 同时过量的铜对水生生物的毒性较强。所以,检测生物体和环境水样中的铜离子有着重要的意义。
目前检测铜离子的方法有原子吸收光谱法[6],电感耦合等离子体原子发射光谱[7],电感耦合等离子体质谱[8], 循环伏安法[9]和荧光分析法等。与其他方法相比荧光分析法因为灵敏度较高,不需要复杂的样品处理,仪器操作简单等优点而得到广泛应用。
检测铜离子的荧光染料发射波长大多在紫外区,在测定样品尤其是生物样品时存在较大的背景干扰。酞菁是一类具有18电子的大π共轭体系配合物,在结构上类似与卟啉类化合物。酞菁和金属酞菁对光、热及各种有机溶剂的高度稳定性[10],使得其在催化、有机半导体、光导体、彩色照相、激光、液晶、LB膜、光动力治疗[11]等方面有着广泛的应用。水溶性金属酞菁具有高的摩尔吸光系数,良好的量子产率[12],并且荧光发射在近红外区,因而大大减小了背景荧光的干扰,已应用在金属离子的检测[13]和空气中酸类物质的检测[14]。本文目的是利用Cu2+能使八羧基酞菁铝(octa-carboxylic pthalocyanine aluminum, AlC8Pc)的荧光猝灭,且在一定浓度范围内其荧光强度的变化与Cu2+浓度成良好的线性关系,建立一种灵敏的检测Cu2+的新方法。
1 实验部分
1.1 仪器与试剂
F-4500荧光分光光度计(日本日立公司),Model pHs-3C酸度计(中国 上海)。八羧基酞菁铝(AlC8Pc) 的合成参照文献[15]进行,其红外光谱,紫外光谱,荧光光谱与文献报道相符[16]。CuCl2·2H2O(分析纯),其他试剂均为分析纯,实验用水为二次蒸馏水。AlC8Pc以0.2 mol·L-1NaOH溶液配成1.0×10-3mol·L-1储备液,使用时用二次水稀释至所需浓度。Cu2+配成5.0×10-3mol·L-1储备液。Britton-Robison缓冲溶液:(0.04 mol·L-1磷酸、硼酸、醋酸)用0.2 mol·L-1NaOH进行调节,配成不同pH的缓冲溶液。
1.2 实验方法
在10 mL 比色管中依次加入一定量的B-R 缓冲溶液、八羧基酞菁铝(1.0×10-3mol·L-1)、Cu2+(5.0×10-3mol·L-1),用水稀释至刻度,混合均匀。荧光激发波长为620 nm,发射波长为698 nm,室温下测定空白和含有Cu2+溶液的荧光强度F0和F.
2 结果与讨论
2.1 AlC8Pc荧光光谱特性
图1 是AlC8Pc的荧光发射光谱,可以看到八羧基酞菁铝的发射光谱位于近红外区,当加入Cu2+时,八羧基酞菁铝荧光猝灭,但峰位置不发生变化,在一定浓度范围内,Cu2+的含量与八羧基酞菁铝荧光强度变化成线性关系。
2.2 AlC8Pc紫外可见-吸收光谱特性
图2 是AlC8Pc的紫外-可见吸收光谱,由图可以看到AlC8Pc有两个吸收峰,分别在356 nm(B带),692 nm(Q带)并且在620 nm附近有酞菁二聚体的特征峰。加入Cu2+时,位于近红外区的Q带逐渐减降低,但峰的位置并没有移动,同时620 nm 处的特征峰消失,说明铜离子与八羧基酞菁铝发生了强烈的作用。综合铜离子与AlC8Pc作用的荧光光谱及紫外-可见吸收光谱性质,可以推断铜离子与AlC8Pc作用的荧光猝灭机理为静态猝灭[17]。
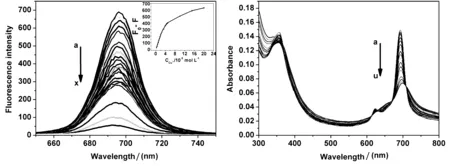
图1 八羧酞菁铝在不同浓度Cu2+下荧光发射光谱图 图2 八羧酞菁铝在不同浓度Cu2+下吸收光谱
2.3 pH值的影响
图3是在Cu2+存在下,AlC8Pc荧光强度变化随pH变化曲线。可以看出,当溶液pH=4.5时,八羧基酞菁铝荧光猝灭程度最大,实验表明以B-R缓冲溶液调节溶液pH效果最好,故实验选择在pH为4.5的B-R缓冲溶液中测定。
2.4 AlC8Pc浓度的影响
图4是八羧基酞菁铝浓度对荧光强度变化的影响,固定Cu2+浓度为1.0×10-5mol·L-1,溶液的pH为4.5,研究了八羧基酞菁铝浓度在3.0×10-6mol·L-1~1.0×10-5mol·L-1范围内对荧光强度变化的影响,发现当八羧基酞菁铝浓度在5.0×10-6mol·L-1时,Cu2+与八羧基酞菁铝的荧光强度猝灭程度最大,所以实验选择AlC8Pc的浓度为5.0×10-6mol·L-1.
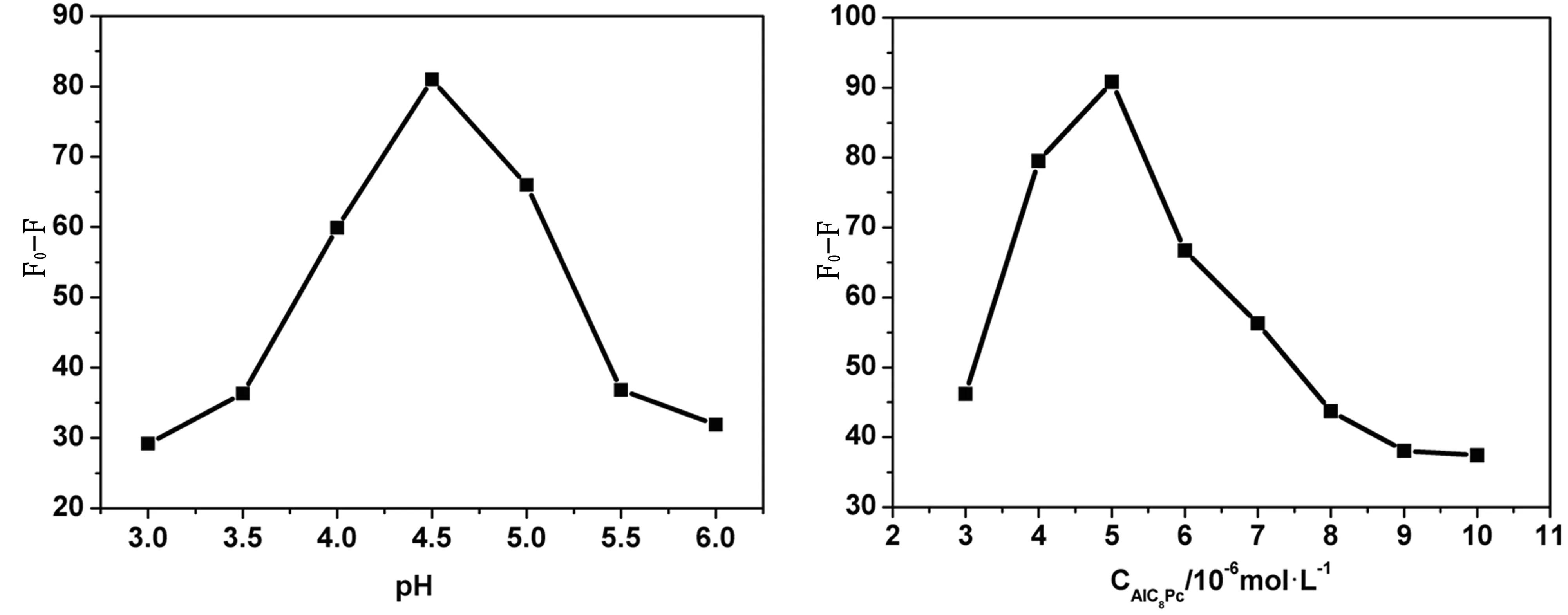
图3 酸度的影响 图4 八羧酞菁铝浓度的影响
2.5 反应时间和温度的影响
考察了反应时间对体系的影响,图5是反应时间的影响,可以看出当加入Cu2+后,AlC8Pc的荧光强度立即减小到480后基本不变,并随着时间增加保持稳定,由此可知Cu2+与AlC8Pc很快发生反应,本实验选择反应5min后进行测定。
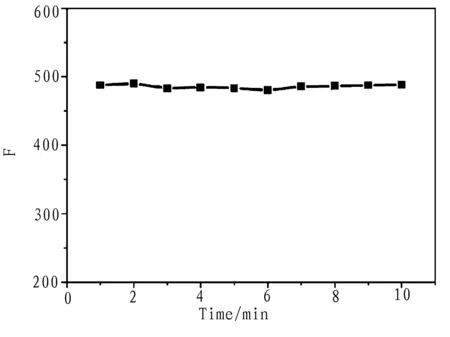
图5 时间的影响
在17℃~37℃温度范围内研究了温度对体系的影响,发现温度对AlC8Pc与Cu2+作用的荧光强度变化影响很小,因此本实验选择在室温下进行。
2.6 选择性实验
图 6是分别加入浓度与Cu2+浓度相同的其它常见金属离子、几种氨基酸和牛血清白蛋白(BSA)后八羧基酞菁铝荧光强度的变化关系图。可以看出Ni2+、BSA与八羧基酞菁铝有作用,但荧光强度变化没有铜离子与八羧基酞菁铝作用显著。加入其它常见金属离子,八羧基酞菁铝荧光变化很小。所以本实验选择八羧基酞菁铝与Cu2+作用体系作为研究对象。
图7是常见金属离子、几种氨基酸和牛血清白蛋白(BSA)和相同浓度的Cu2+同时加入时,八羧基酞菁铝荧光强度的变化关系图。当Cu2+与其它物质同时存在时,Cr3+、BSA对Cu2+与八羧基酞菁铝的相互作用有影响,其它物质影响很小,说明该方法的选择性较好。
2.7 标准曲线
在上述优化实验条件下绘制标准曲线。在Cu2+浓度2.5×10-6mol·L-1~3.0×10-5mol·L-1范围内,八羧基酞菁铝荧光强度变化与Cu2+浓度呈良好的线性关系。线性方程为:△F=-0.46+1.05×107c(mol·L-1) (n=11),相关系数R为0.9974,检出限为8.3×10-7mol·L-1.
2.8 样品的测定
取50 mL体积的黄石青山湖水样,滤去漂浮物,加5mL浓硝酸,加热,消解到10mL 左右,稍冷却,再加入5mL浓硝酸和2 mL H2O2,继续加热消解,蒸至近干,冷却后,加水40mL,加热煮沸3min,冷却后,将溶液转入50 mL容量瓶中,用水稀释至标线,按实验方法进行分析。表1是实际水样的检测结果,结果表明:该湖泊水样中未检出Cu2+,且加标回收率较好,说明该方法准确度较好。
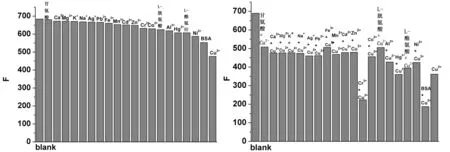
图6 加入不同金属离子八羧基酞菁铝的荧光强度 图7 同时加入铜离子和其他金属离子,氨基酸,BSA,八羧基酞菁铝荧光强度的分析

表1 青山湖水样中Cu2+含量的检测
3 结 论
建立了一种近红外荧光猝灭法检测Cu2+的新方法,可以大大减小背景荧光和散射光的干扰,提高了测定的灵敏度和准确度。实验结果表明,该方法选择性好,反应时间快,操作简单,灵敏度较高。
参考文献:
[1]Mashraqui S H, Poonia K, Betkar R, et al.A novel retro-reaction strategy toward designing a selective fluorescence Cu (II) chemodosimeter [J].Tetrahedron Lett, 2010, 51: 4336~4339.
[2]Hung Y H, Bush A I, Cherny R A.Copper in the brain and Alzheimer's disease [J].J Biol Inorg Chem, 2010, 15: 61~76.
[3]Bull P C, Thomas G R, Rommens J M, et al.The Wilson disease gene is a copper transporting ATPase with homology to the Menkes disease gene [J].Nat Genet, 1993, 5(4): 327~337.
[4]Vulpe C, Levinson B, Whitney S, et al.Isolation of a candidate gene for Menkes disease and evidence that it encodes a copper-transporting ATPase [J].Nat Genet, 1993, 3(1): 7~13.
[5]Valentine J S, Hart P J.Misfolded CuZnSOD and amyotrophic lateral sclerosis [J].Proc Natl Acad Sci U S A, 2003, 100(7): 3617~3622.
[6]Chan M S, Huang S D.Direct determination of cadmium and copper in seawater using a transversely heated graphite furnace atomic absorption spectrometer with Zeeman-effect background corrector [J].Talanta, 2000, 51(2): 373~380.
[7]Fodor P, Bertenyi-Divinyi Z.Uncertainty in environmental ICP-AES measurements [J].Microchim J, 1995, 51:151~158.
[8]Wu J F, Boyle E A.Low blank preconcentration technique for the determination of lead, copper, and cadmium in small-volume seawater samples by isotope dilution ICP-MS [J].Anal Chem, 1997, 69 (13): 2464~2470.
[9]Collado-Sanchez C, perz-pena J, Gelado-Caballero M D, et al.Rapid determination of copper, lead and cadmium in unpurged seawater by adsorptive stripping voltammetry [J].Anal Chim Acta, 1996, 320(1): 19~30.
[10]沈永嘉.酞菁的合成和应用[M].北京: 化学工业出版社, 2000.
[11]Longo J P F, Leal S C, Simioni A R, et al.Photodynamic therapy disinfection of carious tissue mediated by aluminum-chloride-phthalocyanine entrapped in cationic liposomes: an in vitro and clinical study [J].Lasers Med Sci, 2012, 27: 575~584.
[12]Nesterova V I, Erdem S S, Pakhomov S, et al.Soper S A Phthalocyanine dimerization-based molecular beacons using Near-IR fluorescence [J].J Am Chem Soc, 2009, 131 (7): 2432~2433.
[13]Saka E T, Ocak M, Kantekin H.Phthalocyanine-based fluorescent chemosensor for the sensing of Zn (II) in dimethyl sulfoxide-acetonitrile [J].J Incl Phenom Macrocycl Chem, 2012, 72:443~447.
[14]Norena-Franco L E,Kvasnik F.Near-infrared optical detection of acids in atmospheric air by phthalocyanine dyes in polymer films [J].Analyst 1996, 121: 1115~1118.
[15]Song X F, She Y B, Ji H B, et al.Highly efficient, mild, bromide-free and acetic acid-free dioxygen oxidation of p-nitrotoluene to p-nitrobenzoic acid with metal phthalocyanine catalysts [J].Org Process Res Dev, 2005, 9: 297~301.
[16]潘 勇, 陈文兴, 余志成.八羧基金属酞菁衍生物的合成及其催化氧化性能研究[J].浙江工程学院学报,2002, 19(3): 141~144.
[17]武汉大学.分析化学(下册)[M].北京: 高等教育出版社, 2007.

