金属硫蛋白在参环毛蚓不同组织中的表达研究Δ
吴波,李薇,江庆萍,喻良文,张惠球(.广州医学院药学系,广州508;.广州中医药大学中药学院,广州 50006)
参环毛蚓Pheretima aspergillum(E.Perrier)属钜蚓科动物,药材习称“广地龙”,在《中国药典》收载的4个地龙来源中被认为品质最优,也是广东省著名的道地药材。目前,参环毛蚓仍主要依靠野生资源,加上不同环境条件以及采收加工技术的影响,造成药材质量极不稳定,其中重金属超标问题一直难以控制。目前,国内、外学者大多从生态毒理学的角度研究不同种系的毛蚓对土壤重金属的生物特性变化,并着眼于将毛蚓当作环境污染的指示生物或作为生态修复的工具,较少以改善药用资源为目的,进行重金属污染对药用毛蚓的相关研究[1]。笔者拟应用免疫组化研究金属硫蛋白(Metallothionein,MT)在参环毛蚓不同组织中的表达,以评价重金属镉的污染对参环毛蚓的影响,探索参环毛蚓对重金属镉在体内的生物富集机制,并为控制参环毛蚓体内重金属离子富集或加速其排泄提供依据。这对于从源头上解决参环毛蚓的重金属超标问题具有重要意义。
1 仪器与材料
1.1 仪器
CX31型显微镜、FE5000型数码相机(日本Olympus公司);HM 355 S型全自动轮转切片机(德国Microm公司)。
1.2 试药
嗜铬素A(英国Novocastra公司,批号:14301305);Chem-MateTMEnVision+/HRP Detection Kit(基因科技(上海)有限公司,批号:25 J1776647490013);二氨基联苯胺(DAB,包含B、C液,上海工硕生物技术有限公司);福尔马林、氯化镉、过氧化氢、二甲苯、柠檬酸三钠、柠檬酸、无水乙醇、氯化钠、氯化钾、磷酸氢钠、磷酸二氢钠、乙二胺四乙酸(EDTA)等试剂均为分析纯。
1.3 动物
参环毛蚓采自广东省从化市,由广州中医药大学中药学院喻良文教师提供,经广州中医药大学吴文如讲师鉴定为真品。选择体型健壮、活力较强,性成熟、体表具有明显生殖环带,平均湿重约1300~1500 mg的健康蚯蚓。在清洁的土壤中饲养24 h后,投入重金属诱导养殖条件下土壤中,饲养于温度25℃、空气湿度为70%~80%的人工气候箱中。
1.4 土壤
选择从化田间参环毛蚓的原生长地较为肥沃的土壤,以生长有较为肥大的蚯蚓土壤作为选择标准,经测定,含水量为15.4%,pH值为4.40,镉离子含量为0.28 mg·kg-1。
2 方法
2.1 DAB工作液的配制
试验前,每1 mL DAB的B液中加20µL DAB的C液,按此比例配制所需用量,混匀,贮藏,备用;PBS缓冲液(pH 7.2~7.4):NaCl 137mmol·L-1,KCl 2.7mmol·L-1,Na2HPO44.3 mmol·L-1,KH2PO41.4 mmol·L-1;0.01 mol·L-1柠檬酸盐缓冲液(CB,pH 6.0):柠檬酸三钠 3g,柠檬酸 0.4g,加水至1000 mL;0.5mol·L-1EDTA缓冲液(pH 8.0):700mL水中溶解186.1 g EDTA·2 H2O,用10 mmol·L-1NaOH调pH值至8.0,加水至1000 mL。
2.2 试验土壤的配制和重金属诱导养殖试验
2.2.1 镉浓度的设定 根据《中华人民共和国国家标准土壤环境质量标准》(GB15618-1995),以Ⅱ类土壤(适用于一般农田、蔬菜地、茶园、果园、牧场等土壤,土壤质量基本上对植物和环境不造成危害和污染)中所含镉离子浓度0.6 mg·kg-1为基数,加入土壤中镉离子浓度为基数浓度的5、10、20、30、40、50倍,共6个组。诱导培养基的镉浓度见表1。
2.2.2 含重金属离子土壤的处理 称取适量的氯化镉用研钵研磨均匀,再与适量的土壤混合,研钵研磨均匀后,以等量递增法进行重金属离子在土壤中含量的稀释,加入氯化镉(以重金属镉离子计算,即为污染组)浓度分别为3、6、12、18、24、30 mg·kg-1,每1个浓度设1个重复,同时设立空白对照组(未加入氯化镉的土壤),然后土壤放至不同的培养箱中,并标记,详见表1。
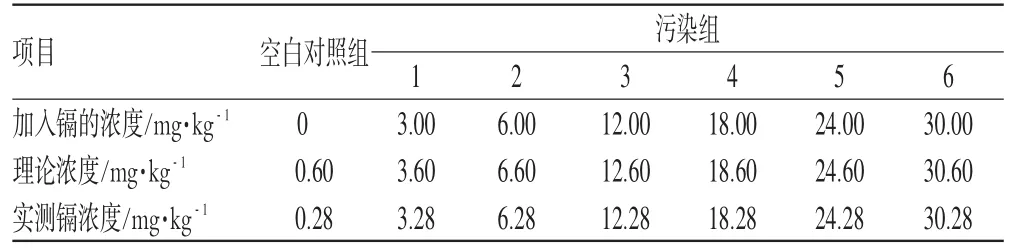
表1 诱导培养基的镉浓度Tab 1 Cd concentration of induction culture medium
2.2.3 重金属诱导养殖试验 在每个培养箱中随机加入10条健康的参环毛蚓,将培养箱置于室内阴凉地方,拉上窗帘,以避免阳光直射,室温保持在25~30℃,空气湿度为70%~80%,土壤含水率为40%,pH 6.5,常规饲养,连续培养14d。其间于每天上午10时和下午16时各观察1次,记录参环毛蚓的活动状况。24、30 mg·kg-1组于培养9、7 d后死亡。
2.3 所用标本的前期处理
取各组参环毛蚓分别置于广口瓶中,先用清水冲洗泥土,再用吸饱清水的滤纸覆盖蚓体,将瓶口用纱布包好,保持室温25℃,滤纸湿润,饥饿48 h后,使消化道内泥沙排泄干净。再一次用清水冲洗泥土,然后用蒸馏水冲洗干净,投入20%的乙醇溶液中麻醉15 min,用pH 7.4、0.1 mol·L-1PBS洗去参环毛蚓体表的黏液,然后解剖,获取体壁和表皮、胃、肠、体腔标本。将以上标本置于10%甲醛溶液中固定,常规石蜡包埋,4 μm切片。切片用二甲苯脱蜡,乙醇梯度洗脱、苏木素染色5 min,自来水冲洗,盐酸、乙醇分化30 s,蒸馏水浸泡15 min,置伊红液中2 min,常规脱水,透明,封片,置于光学显微镜下观察组织和细胞形态。
2.4 免疫组化反应
4 μm石蜡切片,用二甲苯脱蜡,乙醇梯度洗脱,加3%过氧化氢避光室温孵育15 min,用0.01 mol·L-1(pH 6.0)柠檬酸缓冲液高压修复抗原2 min,滴加50~100 μL一抗嗜铬素A,室温孵育30 min,再滴加50~100 μL ChemMateTMEnVision+/HRP,室温孵育30 min,DBA显色,苏木素复染,盐酸乙醇分化液分比,乙醇梯度脱水,二甲苯透明,中性树胶封片。显微镜下观察,细胞胞浆显棕黄色颗粒为阳性。
3 结果
3.1 MT在肠道中的表达
从空白对照组参环毛蚓的肠道和整个体壁的组织切片染色中可看出,在肠腔和肌肉层均未检测出MT表达。从污染组的肠道和整个体腔的组织切片染色中可看出,3 mg·kg-1浓度下,MT表达并不明显,但随着镉浓度的增加,MT的表达越来越强(阳性细胞的数量不断增加)。当染毒浓度达到18mg·kg-1时,其染色强度特别强,但染毒浓度在24 mg·kg-1(染毒时间为9 d)和30 mg·kg-1(染毒时间为7 d)时,其染色强度又明显下降,这可能与其染毒时间相对较短有关。HE染色见图1。
3.2 MT在表皮中的表达
在参环毛蚓各污染组的表皮层中,即角质层和肌肉层之间,均可检测到类似于MT表达的棕黄色颗粒,但是此棕褐色颗粒在空白对照组的表皮层也可检测到,且与18 mg·kg-1组比较,没有发现染色强度有明显不同,这些棕黄色颗粒同样可以在参环毛蚓表皮层切片的HE染色中发现。其它切片中(前列腺和素囊)未检测到明显的棕褐色颗粒。免疫组化图片见图2。
4 讨论
MT是一类广泛存在于生物中的低分子量、富含半胱氨酸、能被金属诱导的金属结合蛋白。1957年,Margoshes和Vallee首先于马肾脏里分离出MT,后经过大量临床试验证明,它具有调节生物体内微量元素浓度的作用。它可由金属、糖皮质激素、某些毒物、细胞因子以及应激因素诱导合成。已有研究结果表明[2~5],MT的诱导作用主要是通过调节转录水平来实现的。金属离子诱导MT合成的能力极强,给实验动物ip镉时,其肝、肾、脾、肠等器官内MT的含量均增加。MT的浓度增加有时可达40倍,不同金属离子在不同组织中诱导MT合成的能力不同:在肝脏中镉和锌是最好的诱导剂,高浓度铜诱导效果也较好,汞则最弱;在肾脏中镉最好,锌则需高浓度,汞次之,铜最弱;已知的诱导金属元素有铜、银、金、锌、镉等。MT的产生与动物体内重金属的富集在一定范围内呈现平行关系,它可直接反映重金属在动物体内富集的部位和浓度。

图1 HE染色Fig 1 HE staining
本研究通过MT与特异性的一抗相结合,产生抗体,再与二抗反应以及一系列显色反应,在显微镜下清晰表达了MT在参环毛蚓体内的分布。免疫组化观察表明,MT主要在参环毛蚓的肠道中表达,虽然在其表皮中有类似于MT表达的棕黄色颗粒,但是在其空白对照组的试验和HE染色中,均有此类似的棕黄色细胞,说明它不是MT的表达,而是参环毛蚓本身的色素细胞所形成的黑色素,这与Morgan AJ等[6]和StÜrzenbaum SR等[7]研究粉蚯蚓的结果一致。由于参环毛蚓表皮的角质层是高渗透性的,可能有少量的重金属通过被动扩散进入体表,但是在其表皮层和肌肉层均未发现明显的MT表达,而在其肠道的黏膜下腺细胞质均有明显的棕黄色颗粒,且随着镉浓度的增加,MT的表达越来越强,说明参环毛蚓对重金属的富集是通过其黏膜下层肠上皮细胞来完成的。这为进一步研究参环毛蚓对重金属的转录调控以及重金属的解除提供了依据。
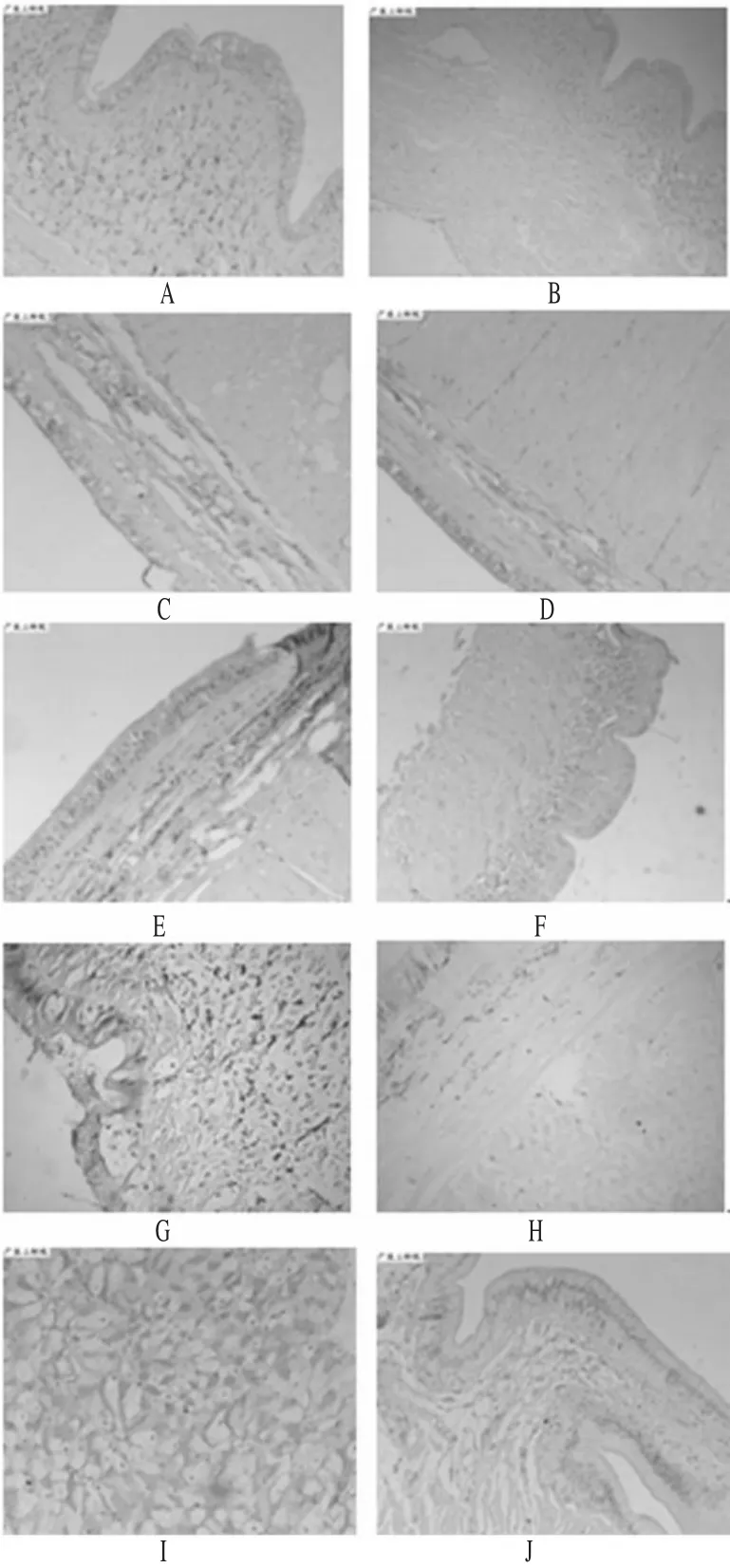
图2 免疫组化图片Fig 2 Immunohistochemistry photography
[1]李 薇,肖翔林,吴文如.药用动植物重金属富集作用的利与弊[J].中国药房,2007,18(12):954.
[2]于福刚.金属硫蛋白生物学特性及功能浅析[J].科技咨讯,2007,16:2.
[3]田晓丽,郭军华.金属硫蛋白的研究进展[J].国外医学药学分册,2005,32(2):119.
[4]McKenna IM,Bare RM,Waalkes MP.Metallothionein gene expression in testicular interstitial cells and liver of rats treated with cadmium[J].Toxicology,1996,107(2):121.
[5]Jourdan E,Emonet-Piccardi N,Didier C,et al.Effects of cadmium and zinc on solar-stimulated light-irradiated cells:potential role of zinc-metallothionein in zinc-induced genoprotection[J].Arch Biochem Biophys,2002,405(2):170.
[6]Morgan AJ,Stürzenbaum SR,Winters C.et al.Differential metallothionein expression in earthworm(Lumbricus rubellus)tissues[J].Ecotoxicol Environ Saf,2004,57(1):11.
[7]Stürzenbaum SR,Kille P,MorganAJ.The identification,cloning and characterization of earthworm metallothionein[J].FEBS Lett,1998,431(3):139.

