秦皮乙素对小鼠皮下Hepa1-6肝癌移植瘤凋亡基因Bcl-2、Bax表达的影响Δ
王丽红,伟忠民(1.辽宁医学院,辽宁锦州121001;2.辽宁医学院附属第一医院,辽宁锦州121000)
秦皮为常用中药,始载于《神农本草经》,列为中品,以后历代主要本草均有记载。2010年版《中国药典》收载了4种秦皮,视为正品,来源为木犀科植物苦枥白蜡树Fraxinus rhynchophylla Hance、白蜡树F.chinensis Roxb.、尖叶白蜡树F.szaboana Lingelsh.或宿柱白蜡树F.stylosa Lingelsh.的干燥枝皮或干皮[1]。秦皮乙素(Esculetin)为秦皮的有效成分之一。现代药理学研究表明,秦皮有抗病原微生物、抗炎、镇痛和抗肿瘤等作用[2]。前期体外细胞试验证明,秦皮乙素对人肝癌细胞有杀伤作用,笔者进一步研究秦皮乙素对小鼠肝癌皮下瘤生长的抑制和对相关凋亡基因的影响,探讨其抗癌的相关机制。
1 仪器与材料
1.1 仪器
Napro-6100型CO2培养箱(美国杜邦公司);YG-875 B型无菌超净工作台(上海医疗器械厂);KA-1000 C型飞鸽离心机(上海安亭科学仪器厂);CX21型双目生物显微镜(日本Olympus公司);WD-9413 B型凝胶成像分析仪(上海圣科仪器设备有限公司);DYY-7 C型电泳仪(北京六一仪器厂);Life Express PCR仪(杭州四格生物有限公司);NANO 2000型紫外分光光度计(美国Thermo公司)。
1.2 试药
秦皮乙素(笔者自制,含量:94.47%,平均收率:96.35%);注射用环磷酰胺(CTX,江苏恒瑞医药股份有限公司,批号:09031521,规格:0.2 g/支);DMEM培养基(美国Sigma公司);胎牛血清(杭州四季青生物工程有限公司);兔抗鼠B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)单克隆抗体(北京博奥森生物技术有限公司);逆转录试剂盒、PCR试剂盒(北京天根生化科技有限公司);Bcl-2、Bax引物由上海生工生物工程有限公司设计合成;其余试剂均为国产分析纯。
1.3 动物与细胞株
C57 BL/6 J小鼠60只,6~8周龄,♂,体重20~22 g,由中国医科大学动物实验中心提供(动物生产许可证号:SYXK(辽)2008-0005)。Hepa1-6细胞株购于中国科学院上海分院细胞库。
2 方法
2.1 复制模型与分组、给药
Hepa1-6细胞、DMEM(高糖)90%、胎牛血清10%置于37℃、5%CO2培养箱中培养,细胞处于对数生长期时,0.2%台昐蓝染色,活细胞密度>95%。收集细胞于PBS中,制成单细胞混悬液,参照文献[3]每只小鼠右腋sc 0.2 mL(约1×107个)。模型复制成功后,小鼠随机分成5组,即模型(生理盐水0.2 mL)、CXT(100 mg·kg-1)和秦皮乙素高、中、低剂量(700、400、200 mg·kg-1)组。复制模型3 d后ip给药,每天1次,连续15 d。
2.2 抑瘤率的计算
于末次给药24 h后,麻醉小鼠取出瘤组织,称重。抑瘤率(%)=(1-给药组平均瘤重/模型组平均瘤重)×100%。
2.3 秦皮乙素对Bax mRNA、Bcl-2mRNA表达的影响
按照试剂盒说明提取总RNA,提取的RNA经紫外分光光度仪分别测量260、280 nm波长处吸光度,由260 nm波长处吸光度计算出RNA浓度。按照RT-PCR试剂盒说明进行PCR扩增。凝胶电泳观察可见18、28S RNA带。Bax上游引物:5′-CCAGGATGCGTCCACCAAGAA-3′,下游引物:5′-AGCA AAGTA-AAGAGGGCAACCAC-3′;Bcl-2上游引物:5′-CTCTGGTTGGGATTCCTACGG-3′;下游引物:5′-CGGCATGATCTTCTGTCAAGTTTA-3′;GAPDH 上游引物:5′-TGTTCCTACCC-CCAATGTGTCCGTC-3′,下游引物:5′-CTGGTCCTCAGTGTAGCC-CAAGATG-3′。反转录条件:95℃ 加热5 min终止反应,置冰上进行后续实验或冷冻贮藏。然后进行30个周期的PCR扩增反应,PCR扩增反应参数设置如下:95℃、5min预变性1个循环,每个周期为95℃变性20s,60℃退火20 s,72℃延伸30 s。取PCR产物10µL与2µL的上样缓冲液混合,用1×TAE缓冲液配制2%琼脂糖进行水平平板电泳,电压5 V·cm-1,电泳40 min,在紫外光灯下观察,应用凝胶成像系统进行统计学处理。分别以Bax、Bcl-2与GAPDH比值作为其相应的表达参数,对Bax mRNA、Bcl-2 mRNA产物相对定量。
2.4 秦皮乙素对Bax、Bcl-2蛋白表达的影响
将存于-80℃冰箱中的组织解冻,加入裂解液制成匀浆,高速离心后取上清液,测出蛋白含量后加入上样缓冲液混匀,水浴加热5 min后-20℃冰箱中保存。灌制10%SDS-PAGE分离胶与浓缩胶于电泳液中进行上样,电泳后采用半干法将蛋白转印于PVDF膜上,TBS冲洗,封闭液封闭0.5h加入一抗,4℃过夜,洗膜。加入二抗,室温下在摇床上杂交1 h,洗膜3次。NBT/BCIP显色,应用凝胶成像分析系统进行扫描照相。以四星图像处理系统测定各组蛋白表达量与内参GAPDH表达量的比值作为各自表达水平的参数。
2.5 统计学方法
3 结果
3.1 秦皮乙素对小鼠皮下肝癌瘤的抑制作用
秦皮乙素高、中、低剂量组抑瘤率分别为55.42%、40.37%、20.33%,各组瘤重指数(瘤重指数=各组瘤重/小鼠体重)均显著低于模型组(P<0.01)。秦皮乙素对模型小鼠肿瘤生长的抑制作用见表1。
表1 秦皮乙素对模型小鼠肿瘤生长的抑制作用(±s,n=8)Tab 1 Inhibition effects of aesculetin on tumor growth of model mice(±s,n=8)

表1 秦皮乙素对模型小鼠肿瘤生长的抑制作用(±s,n=8)Tab 1 Inhibition effects of aesculetin on tumor growth of model mice(±s,n=8)
与模型组比较:*P<0.01vs.model group:*P<0.01
组别模型组秦皮乙素低剂量组秦皮乙素中剂量组秦皮乙素高剂量组CTX组n 88888剂量/mg·kg-1-200400700100瘤重指数1.358±0.13021.039±0.0029*0.772±0.0065*0.589±0.0013*0.487±0.0047*抑瘤率/%-20.33*40.37*55.42*65.03*
3.2 秦皮乙素对Bax mRNA、Bcl-2mRNA表达的影响
按照实验方法中的步骤进行提取的RNA经紫外分光光度计测量260和280 nm吸光度的比值均为1.8~2.0。与模型组比较,Bax mRNA表达随着秦皮乙素剂量的增高荧光强度逐渐增强,显著高于模型组(P<0.01),Bcl-2 mRNA的表达随着秦皮乙素剂量的增高荧光强度逐渐减弱,显著低于模型组(P<0.01)。结果表明,秦皮乙素对小鼠皮下肝癌瘤组织Bax基因表达起到促进作用,对Bcl-2基因表达起到抑制作用。mRNA表达见图1。

图1 mRNA表达Fig 1 The mRNAexpression
3.3 秦皮乙素对Bax、Bcl-2蛋白表达的影响
分别检测不同组中Bax蛋白和Bcl-2蛋白的表达量(条带灰度值),其与内参β-actin表达量的比值为相对表达量。与模型组比较,秦皮乙素高、中、低剂量组Bax蛋白表达受到明显激活,而Bcl-2蛋白表达受到明显抑制,与模型组比较均有显著性差异(P<0.01)。蛋白表达见图2。
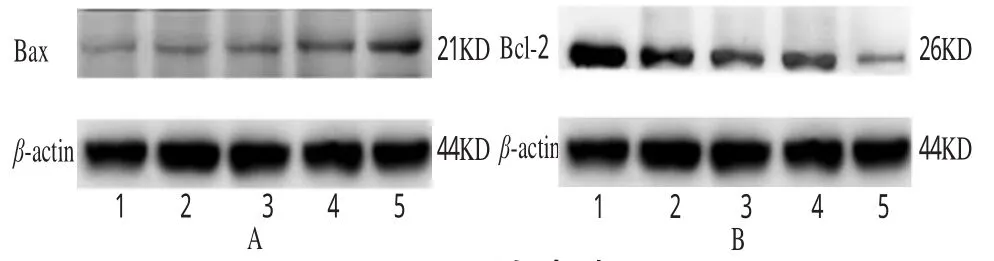
图2 蛋白表达Fig 2 The protein expression
4 讨论
近年来,从天然动、植物中寻找毒性低、疗效高的抗肿瘤药物已成为当前国内、外研究的热点和共识[4]。目前,诱导肿瘤细胞凋亡已成为治疗肿瘤的一个重要途径[5]。中药的抗肿瘤机制之一就是诱导肿瘤细胞凋亡,许多中药的有效成分或其提取物具有诱导肿瘤细胞凋亡的作用[6]。Bcl-2家族是细胞凋亡过程中起重要作用的一类蛋白,分为抗凋亡蛋白和促凋亡蛋白。Bcl-2是重要的抗凋亡蛋白,Bax是广泛的促凋亡蛋白。大多数恶性肿瘤细胞凋亡发生异常时,Bcl-2表达升高,Bax表达下降。过高的抑凋亡蛋白表达打破了正常细胞凋亡机制,使癌症细胞获得了生长的优势,对凋亡信号表达不敏感[7]。在促凋亡因素的刺激下,抑制Bcl-2的表达,促进Bax的表达。通过上调Bax与Bcl-2比值,诱发肿瘤细胞发生凋亡。体外细胞试验发现,秦皮乙素能抑制人肝癌细胞增殖,阻滞于S期,诱导肝癌细胞凋亡[8]。体内抑瘤实验结果是评价抗肿瘤药物有效性的重要指标,其中移植性动物肿瘤模型具有接种成功率高、实验周期短、重复性好等优点[9]。所以,本研究选用近交系C57 BL/6 J小鼠sc鼠源Hepa-6细胞复制模型。结果表明,秦皮乙素对小鼠肝癌皮下瘤生长起到不同程度的抑制作用,并呈现剂量依赖性,各剂量组瘤重均低于模型组,差异有统计学意义(P<0.01)。CTX组抑瘤率高于秦皮乙素各剂量组,但与秦皮乙素各组相比小鼠严重消瘦,毛色无光泽,食欲、活动力均下降,出现了化疗药物的不良反应。秦皮乙素各组小鼠状态良好,其中高剂量组抑瘤率与CTX组相近。RT-PCR、Western blot检测结果表明,秦皮乙素促进了Bax基因与蛋白的表达,降低了Bcl-2基因与蛋白的表达。综上所述,秦皮乙素可促进肿瘤细胞的凋亡,其诱导小鼠肝癌瘤细胞凋亡的机制之一可能是调节凋亡基因Bax/Bcl-2的表达水平,但具体是哪一种凋亡途径启动Bax、Bcl-2基因的表达,还有待进一步研究。
[1]国家药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:245.
[2]方莲花,吕 杨,杜冠华.秦皮的药理作用研究进展[J].中国中药杂志,2008,33(23):2773.
[3]周忠信,吕明德,殷晓熠,等.C57 BL/6 j小鼠接种Hepa1-6细胞诱导皮下肝癌模型的建立[J].广东医学,2007,28(2):178.
[4]刘明华,肖 顺,任美萍,等.克癌新及其拆方对荷瘤小鼠肿瘤生长和细胞因子的影响[J].时珍国医国药,2010,21(12):3150.
[5]吴 剑,滕国英.中药诱导肿瘤细胞凋亡的研究进展[J].国际医药卫生导报,2007,13(8):114.
[6]陈香涛.中药抗肿瘤机制研究进展[J].中国实用医药,2010,5(14):238.
[7]李晓琦,原继荣.Bcl-2/Bax在宫颈癌诊断中的研究进展[J].中国优生与遗传杂志,2010,18(8):468.
[8]王 晶,王洪新,李红玉,等.秦皮乙素的制备及对人肝癌细胞SMMC-7721体外增殖的影响[J].中国现代应用药学,2009,26(6):439.
[9]战晓农,余卫华,刘 恋,等.双氢青蒿素干预结直肠癌模型动物肿瘤生长的实验研究[J].广东中医药大学学报,2009,26(5):465.

