魏氏梭菌α毒素基因的克隆表达及其间接ELISA方法的建立
宋 宇,黄 勇
(1.四川省乐山市市中区畜牧食品局,四川 乐山 614000;2.四川农业大学动物医学院,四川 雅安 625014)
魏氏梭菌病是危害养兔业的重要疾病,α毒素是该菌的主要致病因子且具有较好的免疫原性。目前关于魏氏梭菌α毒素抗体的间接ELISA检测方法报道较少,本文在对家兔魏氏梭菌分离鉴定的基础上,对该菌主要的毒素——α毒素进行基因扩增、克隆和表达,并以表达产物为抗原,建立检测抗α毒素抗体的间接ELISA方法,为家兔魏氏梭菌疫苗的评价提供实验室检测手段。
1 材料
1.1 病料来源 四川省某养殖场饲养的300只家兔,突然发病,发病兔为35~115日龄,以急性腹泻、排黑色水样或带血的胶冻样粪便、盲肠浆膜出血斑和胃黏膜出血、溃疡为主要特征,并出现死亡。
1.2 试剂 革兰氏染色液、PCR反应试剂、DNA Marker、T4DNA 连接酶、溶菌酶、EcoRI、HindⅢ,均购自大连宝生物工程公司;药敏试纸购自杭州微生物试剂有限公司;低分子质量蛋白Marker购自博瑞克公司;其他常规试剂均为国内生产;辣根过氧化物酶标记羊抗兔IgG购自博瑞克公司;牛血清蛋白(BSA)为美国Sigma公司产品。
1.3 载体 PMD19-T载体购自大连宝生物工程公司;大肠杆菌感受态细胞 E.coli DH5α、BL21(DE3)、表达载体PET-32a(+),由川农大动物学院实验室保存。
1.4 仪器 恒温摇床、厌氧培养箱、显微镜、PCR仪、核酸电泳槽、台式离心机、超净工作台、BIO RAD凝胶成像系统,mini涡旋振荡器等,恒温水浴锅(±0.5℃),台式冷冻离心机、96孔ELISA酶标板,均购自Bio Rad公司。
2 方法
2.1 染色镜检 将无菌采取的病料触片,进行革兰氏染色、镜检。
2.2 细菌分离培养 无菌操作,取病死兔肝脏病料划线接种于鲜血琼脂平板上,37℃厌氧培养24~48h,观察菌落特征。挑选疑似菌落进行革兰氏染色。
2.3 细菌的纯化 在鲜血琼脂平板上钓取魏氏梭菌的可疑菌落接种于厌氧肉肝汤中,进行可疑魏氏梭菌的进一步纯化。将纯化后的菌种放入-20℃冰箱中冻干保存。
2.4 生化试验鉴定 挑选纯化后的鲜血琼脂平板上的单个典型菌落,接种于各糖发酵培养基中,37℃培养24~48h后,观察发酵情况。另外,挑选纯化后的鲜血琼脂平板上单个典型菌落,接种于含铁牛乳培养基中,观察牛乳“暴烈发酵”现象。生化结果判定参照《常见细菌系统鉴定手册》进行。
2.5 PCR鉴定
2.5.1 细菌模板DNA的提取 将待鉴定的菌株于LB液体培养基中过夜振荡培养16~18 h,取1 mL细菌的过夜培养物至离心管,13000r/min离心30s,弃去上清,再加入100 μL灭菌双蒸水混匀,煮沸15 min,13 000r/min离心30s后取上清作模板。
2.5.2 半套式PCR引物设计 运用DNAstar软件,根椐GenBank发表的α毒素基因序列自行设计3条引物,由北京赛百盛基因技术有限公司合成,引物序列如下:
引物1:TGTTACTGCCGTTGATAGCG,位于α毒素基因 501~520nt位;引物 2:TTGTCCATTTCCCATTC TTG,位于α毒素基因946~965nt位;引物3:CCTCTG ATACATCGTGTAAG,位于α毒素基因801~820nt位。
先用引物1和引物2扩增α毒素基因,然后用引物1和引物3对该PCR产物进行鉴定。引物1和引物2扩增长度为464 bp,引物1和引物3扩增长度为319 bp。
2.5.3 PCR反应体系 PCR反应体系为50μL,基本反应体系如下:10×PCR buffer 5.0μL;引物(25μmol/L)各1.0μL;dNTP(2.5 mM)4.0μL;MgCl2(25 mM)4.0μL;rTaq酶(5U/μL)0.25μL;模板DNA 5.0μL;双蒸水29.75μL。基本反应程序如下:94℃ 5min、94℃ 30s、56℃ 30s、72℃ 1min,30 个循环,最后 72℃延伸 10min。PCR反应结束后,于0.8%琼脂糖凝胶(含0.5μg/mL Gold View)中电泳检测结果。
先用引物1和引物2扩增α毒素基因,然后以该PCR产物为模板,取1μL用于引物1和引物3的半套式PCR鉴定。
2.6 耐药性鉴定 选用临床常用药物对分离菌株进行药物敏感性试验(12种临床常用药物),方法采用药敏纸片法进行。
2.7 α毒素基因的扩增
2.7.1 引物合成 用primer premier 5.0软件设计一对表达用的引物。在α毒素基因的上、下游引物间分别引入EcoRI和HindⅢ酶切位点,由北京赛百盛基因技术有限公司合成,表达引物如下:
上游引物:5′-CCGGAATTCACTCAAGGGGTTTCA ATCT-3′;下游引物:5′-CCCAAGCTTTTAGTTGTCCAT TTCCCATTCTTG-3′。
2.7.2 细菌的增殖及细菌基因组提取 取1 mL细菌的过夜培养物至离心管,13000r/min离心30s,弃去上清,再加入100 μL灭菌双蒸水混匀,煮沸15 min,13 000r/min离心30s后取上清作模板。
2.7.3 α毒素基因片段的PCR扩增 PCR反应体系为 50 μL,基本反应体系如下:10×PCR buffer 5.0μL,dNTP mixture(2.5mmol/L)4.0μL,MgCl2(25mmol/L)4.0 μL,Taq plus DNA 聚合酶 (5.0 U)0.5 μL,DNA 2.0μL,引物(20mmol/L)各 2.0μL,灭菌 dH2O 30.5μL。基本反应程序如下:94℃预变性5min,94℃变性45s、51℃退火 1min、72℃延伸 3min,33个循环,72℃延伸10min。PCR完成后,于0.8%琼脂糖凝胶(含0.5μg/mL Gold View)中电泳检测结果。
2.7.4 α毒素基因片段的克隆及鉴定
2.7.4.1 α毒素基因 PCR产物的回收与纯化 按上海生物工程有限公司DNA胶回收试剂盒的说明书进行。
2.7.4.2 α毒素基因PCR产物和PMD19-T载体的连接 参照大连宝生物公司的连接试剂盒方法进行。
2.7.4.3 转化感受态大肠杆菌E.coli DH5α 取感受态细胞,置于冰上融化后,加入10μL连接产物,混匀后,冰浴30min。42℃热冲击90s,冰浴2min,使之冷却。加入600μL LB混匀,220r/min、37℃摇床培养1h。吸取200μL培养液,涂布在对应的抗性平板上。37℃培养12~16h至单菌落出现。
2.7.4.4 转化子的筛选及提取 参照北京赛百盛基因技术有限公司的质粒DNA小量提取试剂盒上的方法提取阳性菌株的质粒。
2.7.4.5 重组质粒的PCR鉴定 PCR反应体系如下:10×PCR Buffer 5.0μL,4×dNTP(2.5mmol/L)4.0 μL,引物(20 mmol/L)各 1.0 μL,重组质粒 DNA 1.0 μL,Taq plus DNA 聚合酶(5U)0.5μL,灭菌水 37.5μL,总体积50.0μL。按照2.7.3条件进行PCR扩增,然后于0.8%琼脂糖凝胶(含0.5 μg/mL Gold View)中电泳检测结果。
2.7.4.6 重组质粒的双酶切鉴定 10μL的反应体系:重组子 1.0 μL,10×M Buffer 0.5 μL,HindⅢ 0.5 μL,EcoRI 0.5μL,超纯水 7.5μL。37℃温浴 2h,然后终止反应,取 5 μL酶切产物与 5 μL Maker DL2000经0.8%琼脂糖凝胶电泳检查酶切片段大小。将鉴定为阳性的重组质粒命名为PMD19-T-α。
2.7.4.7 目的基因的序列测定 阳性重组质粒PMD19-T-α的序列测定交由上海生物工程有限公司完成。
2.8 α毒素基因原核表达载体的构建
2.8.1 α毒素基因片段与PET-32a(+)载体的酶切回收 双酶切反应体系为40μL,其组成如下:10×限制性内切酶缓冲液(buffer M)4.0 μL,EcoRI(12 U/gL)2.0 μL,HindⅢ(12U/pL)2.0μL,灭菌水 20.0 μL,质粒12.0μL。将各成分加好后离心混合均匀,置37℃水浴消化 2 h,加 10×loading buffer 2.0 μL,用 1.0 g/L 琼脂糖凝胶电泳重组质粒和载体酶切产物,切下所需的目的条带,用Agarose Gel DNA extraction kit回收纯化目的片段和载体片段(按上海生物工程有限公司DNA胶回收试剂盒的说明书进行),电泳观察回收情况。
2.8.2 α毒素基因片段与表达载体的连接与转化 参照文献进行。
2.8.3 重组表达质粒的提取 参照北京赛百盛基因技术有限公司的质粒DNA小量提取试剂盒上的方法提取阳性菌株的质粒。
2.8.4 重组表达质粒的PCR鉴定 重组表达质粒按1∶10倍稀释后,进行PCR扩增鉴定。
2.8.5 重组表达质粒的酶切鉴定 α毒素基因的重组表达质粒用EcoRI和HindⅢ进行双酶切,酶切产物以1.0g/L琼脂糖凝胶电泳鉴定。
2.8.6 重组表达质粒的序列测定 重组表达质粒的测序:将鉴定为阳性克隆的菌液送到上海生物工程公司测序确证,并将鉴定为阳性的重组表达质粒命名为PET-32a(+)-α。
2.9 重组表达质粒菌株的构建 将鉴定后的重组表达质粒 PET-32a(+)-α 转化为表达菌株 BL21(DE3),并进行阳性转化重组子的鉴定。
2.10 重组表达质粒的诱导表达 分别将各重组表达菌在37℃振摇过夜,取过夜培养物200 μL接种于20 mL LB培养基(含氨苄青霉素100μg/mL)中,剧烈振摇至OD600为0.6~1.0时,取1mL另行培养不进行诱导;其余菌液加入IPTG至终浓度 0.6mmol/L,37℃继续剧烈振荡培养4~6h左右。取IPTG诱导后的菌液1mL,离心,弃上清,沉淀用灭菌双蒸水洗涤,然后加入100μL灭菌双蒸水及5×SDS上样缓冲液25μL,100℃煮沸10min,离心,取上清进行SDS-PAGE;对未诱导菌液亦作同样处理,观察表达情况。同时,以LB液体培养空载体 PET-32a(+)转化的 BL21(DE3)作为对照,具体操作同上。
2.11 表达产物的检测
2.1 1.1 SDS-PAGE电泳 参照文献进行。
2.1 1.2 Western blotting分析 参照文献步骤进行。
2.1 1.3 PET-32a(+)-α表达蛋白产物的初步纯化 参照文献进行。
2.12 魏氏梭菌类毒素疫苗的制备及检验
2.1 2.1 α毒素的粗提 魏氏梭菌复壮:将已鉴定保存的兔魏氏梭菌菌株接种于鲜血琼脂平板,使其复活,37℃厌氧培养24h。然后挑取典型单个菌落接种于厌氧肉肝汤中进行增菌培养,42℃厌氧振荡培养18~24 h。此菌液作为制备疫苗的菌种。疫苗菌液的制备:将复壮后的魏氏梭菌按3%~4%接种于肉肝胃膜汤(按培养基总量的1%加入10%硫乙醇酸钠溶液,并按总量的 5%加入 7.5%碳酸氢钠溶液,调 pH 至 7.8~8.0),37℃厌氧振荡培养5~6h,收获菌液。α毒素的提取:取上述培养液在4℃下4000r/min离心30min,取上清液,再经0.22μm孔径滤膜过滤,去除菌体,即得到粗制魏氏梭菌α毒素,4℃保存。
2.1 2.2 毒素的活性测定 用灭菌生理盐水将毒素按100、10-1、10-2、10-3进行倍比稀释,然后每只小白鼠腹腔注射1 mL。小鼠分5组(对照组注射生理盐水),3只/组,注射后观察72h,记录死亡情况,然后计算LD50。结果得出LD50为101.83 mL。
2.1 2.3 毒素的灭活 将制取好的毒素用1M NaOH调pH至7.2,然后加入0.3%甲醛,充分振荡混匀,然后置37℃,进行32h灭活,期间每隔5~6h振摇一次。
2.1 2.4 氢氧化铝胶佐剂的制备 参照文献进行。
2.1 2.5 类毒素疫苗的制备 将灭活后的类毒素按9∶1的比例加入灭菌5%Al(OH)3胶,充分混合摇匀后,置4℃冰箱中自然沉淀10d,然后弃去1/3上清液进行浓缩,并加入0.01%硫柳汞,混匀后4℃保存待检。
2.13 基于α毒素基因重组蛋白检测魏氏梭菌α毒素抗体的ELISA方法的建立
2.1 3.1 抗原浓度及一抗浓度的选择 将纯化的重组蛋白用包被液作 1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1280 稀释,按方阵滴定式排列,微孔板每孔加100 μL,4℃包被过夜;甩弃液体,每孔加入封闭液100 μL,37℃封闭 30min;洗涤后,将制备的类毒素疫苗免疫的兔阳性血清及相应的阴性血清分别用稀释液作 1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640 稀释上样,在方阵滴定孔中每孔加100 μL,37℃封闭30min;洗涤液洗涤4次,拍干,每孔加入HRP标记的山羊抗兔IgG(作 1∶10000稀释)100μL,37℃封闭 30min,洗涤液洗涤4次,拍干,每孔加入TMB 100 μL,避光显色10min,加入终止液50 μL,轻拍混匀,用酶标仪测OD450值。
2.1 3.2 临界值的确定 随机选取10份健康兔阴性血清按照上述确定好的重组蛋白抗原浓度和一抗浓度用包被液稀释,步骤按照2.13.1,最后用酶标仪测定OD450值。将阴性血清OD450值的平均值设为X,求其标准差(设为S),取X+3S作为阳性血清的临界值。当被检血清OD450值≥X+3S时,判定为阳性;被检血清OD450值<X+3S时,判定为阴性。其中标准阳性和阴性血清之差必须高于某定值,否则无效。
2.1 3.3 敏感性试验 表达蛋白按最佳包被浓度进行包被,将制备的类毒素疫苗免疫的兔阳性血清作1∶640、1∶1280、1∶2560、1∶5120、1∶10240 共 5 个稀释度,其余条件按最适反应条件进行ELISA试验,观察敏感性。
3 结果与分析
3.1 染色镜检 将病死兔的肝脏触片、染色,在显微镜下可观察到粗大、两端钝圆的杆菌,多单个存在,有明显的荚膜,革兰氏染色呈阳性。
3.2 细菌分离培养 在鲜血琼脂平板上可见灰白色、圆形、隆起的菌落,周围有绿色溶血区,双溶血环直径一般在7~11mm,在鲜血琼脂平板上能够形成双溶血环。
3.3 细菌的纯化 在鲜血琼脂平板上钓取魏氏梭菌的可疑菌落接种于厌氧肉肝汤中,可见病原菌繁殖非常迅速,采用厌氧肉肝汤快速移植法完成了疑似魏氏梭菌的进一步纯化。
3.4 生化试验 将病料中分离出的细菌进行生化鉴定,结果表明:该细菌与魏氏梭菌的生化特性一致;将分离出的细菌接种于含铁牛乳培养基中,可观察到“暴烈发酵”现象。
3.5 PCR鉴定 对样品进行检测,先后用外侧和内侧引物进行PCR反应,分别扩增出1条近500bp的特异性扩增条带(见图1)和1条300bp左右的特异性扩增条带(见图2)。
3.6 耐药性测定 分离出的菌株对先锋霉素和丁胺卡那比较敏感。
3.7 α毒素基因的扩增、克隆和序列测定
3.7.1 α毒素基因的扩增 PCR扩增的结果与预期结果一致,其长度为837bp,与预期大小一致(见图3)。
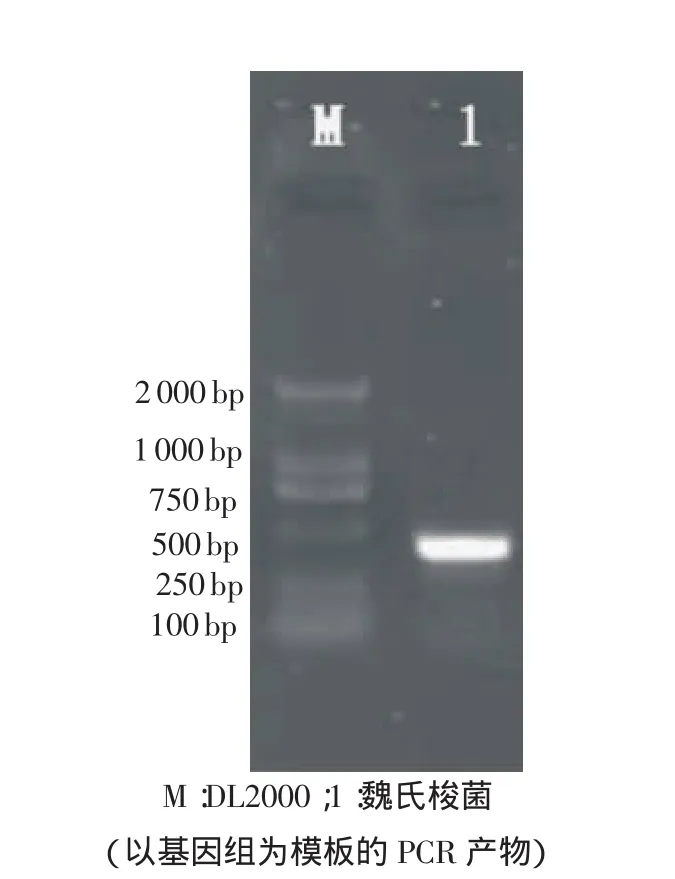
图1 魏氏梭菌 PCR扩增产物(外侧引物)
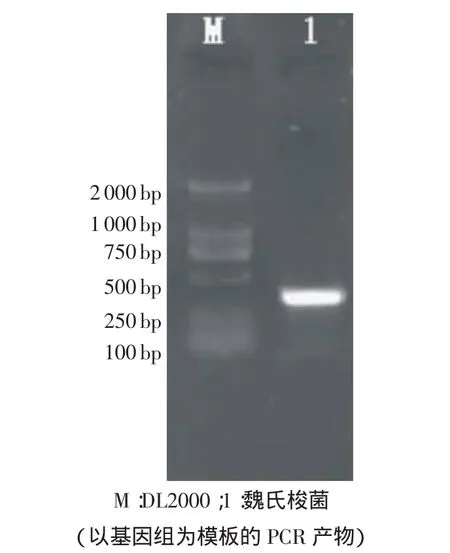
图2 魏氏梭菌PCR扩增产物(内侧引物)
3.7.2 α毒素基因的克隆与序列同源性分析 样品测序得到α毒素基因837bp的序列片段。经同源性分析,该序列与GenBank中的其他魏氏梭菌菌株的α毒素基因同源性高达99%。
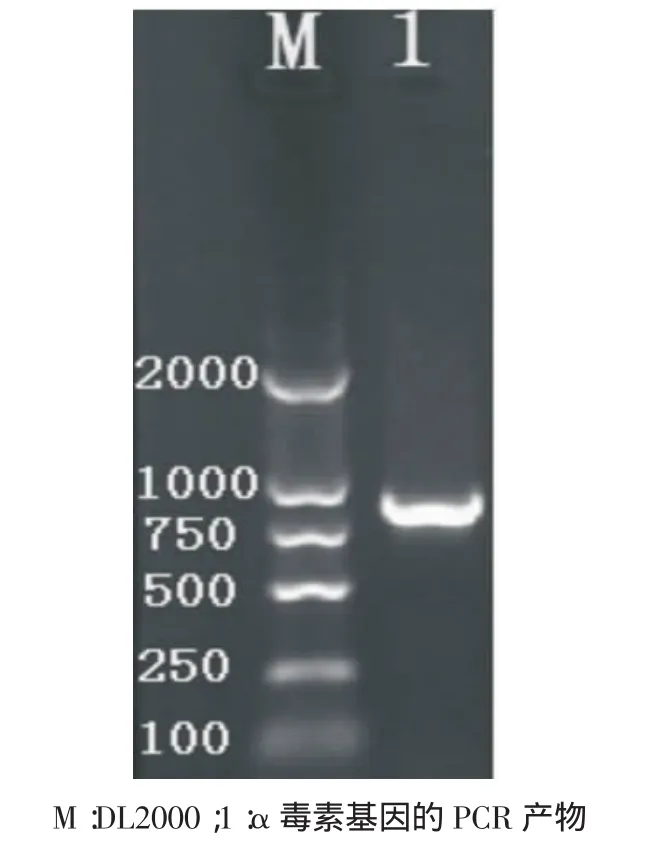
图3 α毒素基因PCR产物的扩增结果
3.7.3 生物信息学分析
3.7.3.1 二级结构、疏水性、抗原决定簇以及表面抗原的预测 应用DNAstar软件对α毒素基因目的片段进行分析,结果表明:α毒素基因目的片段的蛋白结构主要呈无规则卷曲,并且这段目的片段蛋白集中了较多疏水区、抗原决定簇和表面位点,具有较强的抗原性。
3.7.3.2 蛋白跨膜区预测 用在线网站htpp://www.ch.embnet.org/software/TMPRED_form.html分析全序列,得出α毒素基因目的片段的蛋白结构没有跨膜区,该基因亲水性比较强。
3.7.3.3 抗原决定簇的预测 该蛋白序列在http://bio.dfci.harvard.edu/Tools/antigenic.pl上分析,可预测出其上含有11个抗原决定簇,分布于19~247aa之间,反导出α毒素基因目的片段上的抗原决定簇应该位于57~741bp之间,且该段都具有较强的免疫原性。
3.8 α毒素基因在大肠杆菌中的原核表达
3.8.1 α毒素基因表达质粒在大肠杆菌中不同时间段的诱导表达 在诱导1h时该基因就开始表达,在诱导4h后表达的量趋于稳定。
3.8.2 α毒素基因表达质粒在大肠杆菌中不同温度下的诱导表达 结果表明该基因在30℃时表达量达到最高。
3.8.3 α毒素基因表达质粒在大肠杆菌中不同IPTG浓度下的诱导表达 该基因在0.4 mmol时表达量趋于稳定,从节约成本考虑,本实验采用IPTG的浓度为0.4mmol。
3.9 重组蛋白可溶性与不可溶性分析及初纯结果 上清中很少看见目的蛋白,在沉淀中出现大量的目的蛋白,说明该蛋白主要以包涵体的形式存在。
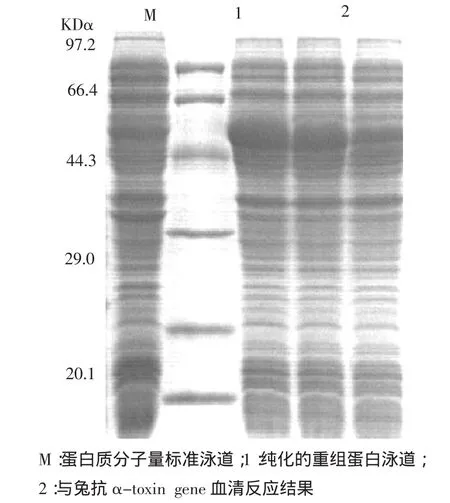
图4 Western blotting分析结果
3.10 Western blotting分析 转印膜上可以看见一条和目的蛋白大小一致的条带,见图4。
3.11 基于α毒素基因重组蛋白检测魏氏梭菌α毒素抗体的ELISA方法的建立
3.1 1.1 抗原浓度与一抗的选择 根据抗原的某一稀释孔P/N值最大的原则确定抗原最佳稀释度,计算结果显示:当抗原稀释度为1∶640时P/N值最大,故最佳抗原包被浓度为1∶640。根据血清的某一稀释孔P/N值最大的原则确定血清最佳稀释度,计算结果显示:当血清稀释度为1∶80时P/N值最大,故最佳血清稀释度为 1∶80。
3.1 1.2 临界值的确定 用确定好的抗原浓度进行包被,然后再通过对10份阴性血清进行检测,求得其平均值X为0.19,标准差S为0.038,确定阳性临界值点为X+3S=0.30,即待检测样品的OD450值≥0.30为阳性,<0.30则为阴性。
3.1 1.3 敏感性试验 采用已建立好的间接ELISA方法,以重组蛋白包被ELISA酶标板,将阳性血清作1∶640、1∶1 280、1∶2 560、1∶5 120、1∶10 240 共 5 个稀释度,其余条件按最适反应条件进行ELISA试验,结果当阳性血清稀释到 1∶5120 时,OD450>0.30。
4 结论
兔魏氏梭菌的诊断可根据兔群发病情况、临床症状和病理变化作出初步诊断,但要确诊需结合实验室诊断。通过病料的触片镜检、病原的分离、病原的培养特性观察和生化鉴定可对魏氏梭菌进行鉴定,但是PCR方法在魏氏梭菌的鉴定中更具有特异性。
在间接ELISA方法建立之前,必须先确定魏氏梭菌α毒素抗原和抗体的最佳结合浓度。本试验选取的抗原稀释度为1∶640,蛋白质含量为0.241 mg/mL。酶标二抗浓度和工作时间采用的是二抗说明书所推荐的。用确定好的最佳抗原和一抗结合浓度进行临界值测定最终确定0.30为临界值,即检测待检样品时,用重组蛋白建立的ELISA方法去检测,若所测定的OD450≥0.30,则可判断为阳性。
[1]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].北京:科学出版社,2002:822-844.
[2]Brinkmann U,Mattes R E,Buckel P.Optimizing the expression in E.coli of a synthetic gene[J].Gene,1989,85(21):109.
[3]汪家政,范 明.蛋白质技术手册[M].北京:科学出版社,2001:166-183.
[4]刘文波.A型魏氏梭菌类毒素疫苗与抗毒素的研究[J].中国预防兽医学报,2004,14(3):13-16.
[5]王海林,高向阳.包涵体纯化技术[J].生物技术通报,2007,14(1):78-81.

