Sonic hedgehog 信号通路在单侧输尿管梗阻大鼠肾组织中的表达变化及意义*
白永恒, 陆 红, 周 琴, 林成成, 梁 勇, 洪炜龙, 郑少玲, 陈必成△
(温州医学院附属第一医院1外科实验室,2实验诊断中心,3移植中心,浙江 温州325000)
肾小管间质纤维化(tubulointerstitial fibrosis,TIF)几乎是所有慢性肾脏疾病发展到后期的病理学特征,TIF 程度是反映肾功能下降严重程度和判断预后最重要的指标。因此,研究TIF 的分子机制,探索有效的防治措施,对延缓终末期肾病的进程,延长患者寿命意义重大。最近研究显示,Sonic hedgehog(Shh)信号在胆管、肝脏纤维化过程中均存在异常活化现象,阻断Shh 信号的传递可抑制纤维化的形成[1-2]。然而,Shh 通路是否参与TIF 进程目前尚不清楚。因此,本研究通过建立单侧输尿管梗阻大鼠肾纤维化模型(unilateral ureteral obstruction,UUO),以探讨Shh 信号通路在TIF 形成中的作用及其分子机制。
材 料 和 方 法
1 材料
48 只雄性SD 大鼠(体重180 ~200 g)购于温州医学院动物实验中心,饲养于SPF 级环境,给予标准的饮食和饮水,于实验前1 d 开始禁食。
2 方法
2.1 动物模型及分组 将大鼠随机分为假手术组(n=24)和单侧输尿管结扎组(UUO,n =24)。假手术组开腹后游离左侧输尿管随即缝合皮肤,UUO 组进行左侧输尿管结扎。模型标准化关键在于无菌操作和结扎位置靠近肾盂并与肾盂的距离固定。2 组大鼠分别于术后第3、7 和14 d 在10%水合氯醛的麻醉下行腹腔静脉放血,然后取肾脏标本。
2.2 病理检查 梗阻侧肾脏取出后,进行纵轴和横轴测量。横截面切割切开后加入10%多聚甲醛固定,按常规方法进行组织脱水、透明、浸蜡和包埋。切成约4 μm 厚的切片,经脱蜡、梯度乙醇和苏木精-伊红染色(碧云天生物公司),中性树胶封片。通过显微镜观察肾脏切片,按肾小管损伤程度给出评价。同时通过图像分析系统,量取扩增肾小管最长径代表肾小管扩张程度,分析各组肾小管的扩增程度。
2.3 Masson 染色 石蜡切片脱蜡后,按Masson 试剂盒说明书操作(上海源叶生物公司)。Harris's 苏木素液染核10 min;丽春红酸性染液染色10 min,0.2%醋酸速洗2 次;1%磷钼酸作用5 min,直接用1%亮绿SF 染色3 min;直接95%乙醇分化30 s;脱水、透明、封片、镜检。
2.4 肾脏总RNA 提取 将大鼠新鲜肾脏组织置于液氮中保存。采用Trizol 试剂(Invitrogen)提取大鼠肾脏RNA,并于260/280 nm 测定吸光度值,分析样本纯度。根据试剂说明书(Toyobo)将RNA 逆转录成cDNA,-20 ℃保存,备用。
2.5 Real -time RT -PCR 检测Shh 信号和纤维化相关分子的表达 应用Primer 5.0 软件设计针对Shh 信号通路分子Shh、Smo、Ptch1 和Gli1,纤维化指标TGF-β1、I 和III 型胶原(Col I、Col III)mRNA 特异性引物,以β-actin 作为内参照,采用相对定量法计算获得结果。引物序列见表1 所示,由上海生工公 司 合 成。相 对 表 达 量 = 2-ΔΔCt,ΔΔCt =[Ct目的基因(待测样品)-Ct内参照(待测样品)]-[Ct目的基因(校正样品)-Ct内参照(校正样品)]。PCR 程序为:95 ℃3 min 预变性,1 个循环;95 ℃5 s,60/62 ℃35 s,40 个循环。同时采用熔解曲线分析来评价PCR 结果可靠性。

表1 Shh 信号和纤维化相关基因的mRNA 特异性引物Table 1. Specific mRNA primers for Shh signaling and fibrosis-related genes
2.6 免疫组织化学染色检测Shh 信号分子和Ⅲ型胶原的表达 用免疫组织化学链霉菌抗生物素蛋白连接的过氧化酶(SP)法(中杉金桥生物公司)。所有标本用10%甲醛溶液固定,石蜡包埋后连续切片,厚4 μm。羊抗鼠Shh、Ptch1 和Smo 多克隆抗体、Gli1 单克隆抗体购自Santa Cruz,III 型胶原多克隆抗体购自Bioword。Ⅰ抗稀释度:Ptch1 为1∶200,其余均为1∶100,柠檬酸盐微波辐射进行抗原修复,二氨基联苯胺(DAB)显色后经苏木精复染。以Ⅰ抗稀释液代替Ⅰ抗作为阴性对照,用小鼠胃组织切片作为阳性对照[3]。细胞内或胞膜出现棕黄色颗粒为阳性表达。应用Image -Pro Plus 6.0 软件分析各组别免疫组化切片的平均吸光度值。
2.7 ELISA 检测肾组织中TGF -β1和Shh 含量
取200 mg 组织,用2 mL PBS 进行匀浆溶解,TGF -β1和Shh 含量的检测采用双抗体夹心ABC -ELISA法(上海西唐生物),450 nm 处测A 值,通过绘制标准曲线求出浓度。
3 统计学处理
采用SPSS 13.0 软件包进行统计学分析,数据以均数±标准差(±s)表示,组间均数比较采用t 检验或单因素方差分析,评价Shh 蛋白与TGF -β1含量的关系采用直线相关分析。以P <0.05 为差异有统计学意义。
结 果
1 UUO 大鼠的肾间质纤维化程度
如图1 所示,大鼠肾组织石蜡切片经HE 染色,镜下观察肾组织常规病理,结果显示对照组肾脏结构正常,肾小管排列紧密、整齐,小管基底膜光滑、连续,小管间质区无炎症细胞浸润。UUO 组术后7 d,肾间质炎症细胞局灶或弥漫性浸润,肾小管轻度扩张,小管间质区面积增大。Masson 染色显示,UUO大鼠肾间质胶原相对面积增大,胶原纤维增多。此外,免疫组织化学及real -time RT -PCR 检测的结果也显示,TGF-β1含量、I 型和III 型胶原mRNA 和蛋白表达水平也明显上调(P <0.05),见图2、3。
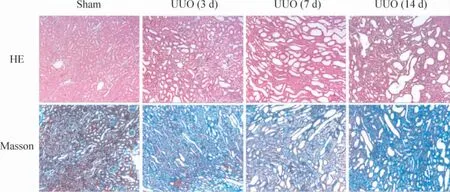
Figure 1. Evaluation of renal fibrosis in UUO rats (HE and Masson staining,×50).图1 HE 和Masson 染色法检测UUO 大鼠肾间质纤维化程度
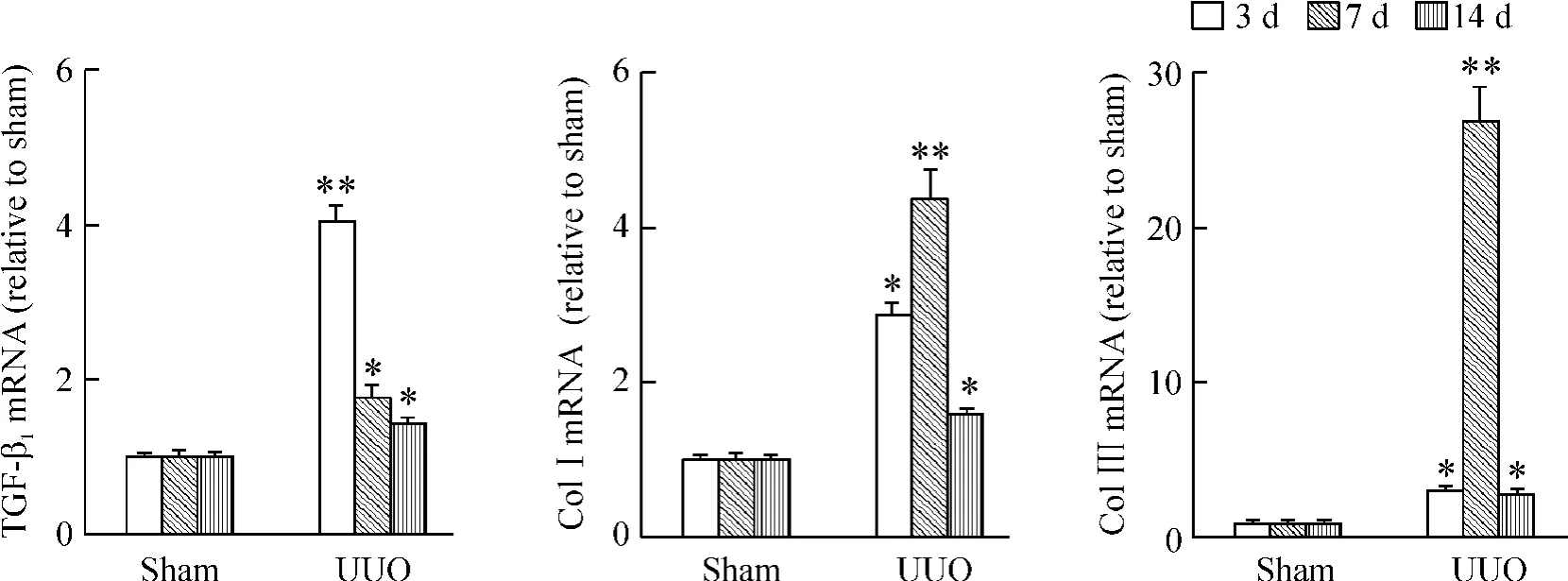
Figure 2. The mRNA expression of TGF -β1,type I and III collagen were detected by real -time RT -PCR. ±s. n =6. * P <0.05,**P <0.01 vs sham group.图2 Real-time RT-PCR 检测I 型和III 型胶原mRNA 的表达情况

Figure 3. Expression of type III collagen detected by immunohistochemical analysis (×200).图3 免疫组织化学检测III 型胶原蛋白的表达
2 Shh 通路在UUO 大鼠中的表达情况
免疫组织化学染色和real -time RT -PCR 的结果显示,UUO 大鼠中Shh 信号通路抑制分子Ptch1表达明显下调(P <0.01),而信号活化相关蛋白Shh、Smo 和Gli1 表达升高(P <0.05),提示梗阻肾纤维化发生过程中Shh 信号被激活,见图4、5。

Figure 4. Expression of Shh signaling proteins in UUO rats (immunohistochemical staining,×100). ±s.n=6. * P <0.05,**P <0.01 vs sham group.图4 Shh 信号分子在UUO 大鼠肾间质纤维化中的表达
3 UUO 大鼠Shh 信号起始信号蛋白与TGF -β1的关系
ELISA 结果显示,UUO 大鼠在泌尿管梗阻后的不同时点(3、7 和14 d),Shh 信号起始信号蛋白Shh分泌水平和促纤维因子TGF-β1含量之间呈现明显正相关(r =0.982,P <0.05),提示活化的Shh 信号通路诱导TGF-β1表达和释放,导致肾间质纤维化。
讨 论

Figure 5. The mRNA expression of Shh signaling-related genes detected by real-time RT-PCR. ±s.n=6. * P <0.05,**P <0.01 vs sham group.图5 Real-time RT-PCR 检测Shh 信号相关基因mRNA的表达
Shh 通路是一条进化保守的信号通路,在从低等动物(果蝇)到高等动物(人类)中普遍存在。Shh 通路主要由Hedgehog 配体(Shh)、2 个膜受体Ptch、Smo 及下游的转录因子Gli 组成[4]。感受器蛋白Ptch 和信号开关蛋白Smo 是位于细胞膜上的跨膜蛋白,其中Ptch 为Shh 蛋白的受体。当不存在Shh 蛋白时,Ptch 抑制Smo 的活性,进而抑制下游基因的转录表达。当存在Shh 蛋白并与Ptch 结合时,Smo 的抑制效应被解除,便可激活下游的转录调节因子Gli,进而诱导目标基因的表达。这些目标基因中包含与细胞增殖相关的基因,如c-myc、cyclin C 和cyclin D 等。正常表达的Shh 信号在人类发育过程中起着重要作用,如参与神经管分化、血管生成及牙齿发育等[5]。但持续异常激活的Shh 信号可导致不同类型增殖性疾病的发生,包括诱发胰腺癌、胃癌等肿瘤的发生[6]。此外,最近的研究也显示,活化的Shh信号也与组织纤维化的发生密切相关[1-2]。
然而,尚不清楚活化的Shh 信号通过何种机制影响纤维化进程。有研究显示,活化的Shh 信号通路可诱导TGF -β1高表达[7]。高TGF -β1表达不仅促进促进上皮细胞转分化为成纤维细胞(epithelial-mesenchymal transition,EMT),参与局部的炎症反应[8-9],同时,也大量分泌表达细胞外基质(extracellular matrix,ECM),包括I 型胶原和III 型胶原。遭受EMT 后形成的成纤维细胞也可分泌表达多种炎症因子和ECM 成分,这些ECM 成分在细胞间质持续不断的累积是导致纤维化发生的直接原因。因此,通过分析Shh 信号与TGF-β1的关系,可以在深入认识信号转导在纤维化发生过程中的作用。
本研究通过建立单侧输尿管梗阻大鼠肾纤维化模型,发现了梗阻侧肾组织出现明显的纤维化病变,且随梗阻时间延长而加剧。与此同时,TGF -β1含量也明显升高。TGF-β1含量的增加推测可能与泌尿管梗阻后局部低氧、细胞表面压力增大导致局部肾小管上皮细胞损伤有关[10]。在这种微环境中,我们发现Shh 信号通路被激活。这种活化可能是反馈性,也可能是主动的,并且信号的活化是通过旁分泌或自分泌途径产生Shh 蛋白得以实现的。我们的实验结果显示,Shh 信号起始信号蛋白Shh 含量与TGF-β1明显相关,在梗阻早期呈现低表达,而随着梗阻时间延长,表达量明显呈现同步性提高,提示活化的Shh 信号通路诱导TGF -β1表达和释放,导致肾间质纤维化。这一结果与其它文献报道的Shh 信号参与肝脏、胆管纤维化相似。胆汁性肝硬化病人或者人为诱导胆管纤维化动物模型中,均发现Shh 信号存在不同程度的活化[1]。同样,在肝脏纤维化过程中,Shh 信号也被过度活化[2]。敲除Ptch 基因,使Shh 信号过度活化,可促进TGF -β1表达,进而促进胆管上皮细胞EMT 及胆管纤维化的发生[1]。体外实验中,通过外源性激活Shh 信号,也可加快肝细胞EMT,促进肝脏纤维化。采用环杷明(cyclopamine)特异性抑制Shh 信号,可抑制TGF-β1表达,能有效减轻甚至逆转纤维化[2,11]。
因此,来自体内实验的结果显示,活化的Shh 信号通路诱导TGF -β1表达和释放,导致肾间质纤维化。然而,Shh 信号各分子在肾纤维化中的具体功能和定位,及信号干预措施尚还需体外实验来研究和证实。因此,下一阶段,调控Shh 信号通路的研究,尤其是核转录基因Gli1 靶向性基因治疗的开展,可能为治疗肾间质纤维化开辟一条崭新的途径。
[1] Omenetti A,Porrello A,Jung Y,et al. Hedgehog signaling regulates epithelial - mesenchymal transition during biliary fibrosis in rodents and humans[J]. J Clin Invest,2008,118(10):3331 -3342.
[2] 刘 珺,徐选福,王兴鹏,等. Hedgehog 通路与肝纤维化及肝星状细胞活化的关系研究[J]. 中华消化外科杂志,2009,29(2):101 -104.
[3] Dimmler A,Brabletz T,Hlubek F,et al. Transcription of sonic hedgehog,a potential factor for gastric morphogenesis and gastric mucosa maintenance,is up - regulated in acidic conditions[J]. Lab Invest,2003,83(12):1829 -1837.
[4] Ingham PW,McMahon AP. Hedgehog signaling in animal development paradigms and principle[J]. Genes Dev,200l,15(23):3059 -3087.
[5] Lavine KJ,Omitz DM. Rebuilding the coronary vasculature:hedgehog as a new candidate for pharmacologic revascularization[J]. Trends Cardiovasc Med,2007,17(3):77 -83.
[6] Pasca di Magliano M,Hebrok M. Hedgehog signalling in cancer formation and maintenance[J]. Nat Rev Cancer,2003,3(12):903 -911.
[7] Eichenmüller M,Bauer R,Von Schweinitz D,et al.Hedgehog - independent overexpression of transforming growth factor - beta1 in rhabdomyosarcoma of Patched1 mutant mice[J]. Int J Oncol,2007,31(2):405 -412.
[8] Samarakoon R,Overstreet JM,Higgins SP,et al. TGFβ1→SMAD/p53/USF2 →PAI -1 transcriptional axis in ureteral obstruction-induced renal fibrosis[J]. Cell Tissue Res,2012,347(1):117 -128.
[9] Meng XM,Huang XR,Xiao J,et al. Disruption of Smad4 impairs TGF-β/Smad3 and Smad7 transcriptional regulation during renal inflammation and fibrosis in vivo and in vitro[J]. Kidney Int,2012,81(3):266 -279.
[10] 黄海长,于 迎,梁 燕,等. 低氧刺激结缔组织生长因子表达与肾间质纤维化[J]. 中国病理生理杂志,2005,21(3):432 - 435.
[11] Syn WK,Jung Y,Omenetti A,et al. Hedgehog-mediated epithelial-to -mesenchymal transition and fibrogenic repair in nonalcoholic fatty liver disease[J]. Gastroenterology,2009,137(4):1478 -1488.

