盐酸椒苯酮胺对豚鼠耳蜗缺血再灌注损伤的听力保护作用*
李永贺 李威 陈浩 吴剑 万良财
盐酸椒苯酮胺(piperphentonamine hydrochloride,PPTA)是由中国医学科学院药物研究所合成筛选出来的化学创新药。研究表明盐酸椒苯酮胺计心肌缺血再灌注损伤有保护作用,具有增强心脏功能并降低心肌耗氧量的双重作用,它能增加收缩蛋白对Ca2+的敏感性,而不增加心肌细胞内[Ca2+]超载,是钙增敏剂类强心药及心肌保护剂[1]。目前,国内外尚无盐酸椒苯酮胺对内耳缺血再灌注损伤保护作用的研究,本研究通过豚鼠耳蜗缺血再灌注损伤造模,同时应用PPTA,探讨PPTA对内耳缺血再灌注的保护作用及可能机制,以扩大盐酸椒苯酮胺的临床适应症,为盐酸椒苯酮胺用于缺血性内耳疾病的治疗提供药理学依据。
1 材料与方法
1.1实验动物及分组 实验动物为健康纯白红目豚鼠32只,雌雄不拘,体重250~350 g,由南方医科大学实验动物中心提供(动物合格证编码:4402101425),所选豚鼠耳廓反射灵敏,鼓膜完整,标志清楚,均经ABR测试排除听力异常者。动物随机分为4组,每组8只,第1组为正常组(不做任何处理), 第2组为空白对照组(手术切开颈前正中皮肤,分离出双侧椎动脉、双侧颈总动脉,但不做其它处理), 第3组为缺血再灌注对照组(耳蜗缺血再灌注造模成功后,再灌注的同时股静脉给予与PPTA同等剂量的生理盐水), 第4组为缺血再灌注实验组(耳蜗缺血再灌注造模成功后,再灌注的同时静脉给予PPTA 10 mg/kg)。本动物实验经南方医科大学动物实验伦理委员会批准。
1.2实验方法
1.2.1建立右侧耳蜗缺血再灌注动物模型 第3、4组动物进行右侧耳蜗缺血再灌注造模。动物以2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,仰卧位,颈前脱毛,碘伏消毒,做正中切口,逐层分离至气管,正中分离气管周围组织,游离出两侧颈总动脉、椎动脉;向上继续分离至右侧听泡,用耳科显微电钻磨开听泡,暴露耳蜗,棉拭子拭去耳蜗底回外侧壁的黏骨膜,三维固定仪固定激光多普勒血流仪探针型探头于耳蜗底回外侧壁,稳定5分钟后连续记录耳蜗血流量(cochlear blood-flow,CoBF),用无创微动脉夹夹闭双侧椎动脉及右侧颈总动脉,连续记录CoBF变化,CoBF不再下降并稳定时即耳蜗缺血建模成功;耳蜗缺血60分钟后,松开双侧椎动脉及右颈总动脉微动脉夹,连续观察CoBF,至少达缺血前70%水平并保持稳定后即耳蜗再灌注建模成功。
1.2.2ABR检测 四组动物分别于实验前、缺血再灌注后24小时测量右耳ABR各波波间期及反应阈。检测在隔声屏蔽室内进行,动物经腹腔麻醉后,用短银针(自制,极间阻抗<2 000 Ω)作电极,颅顶双耳连线正中点为记录电极,右耳后乳突皮下为参考电极,左耳后乳突皮下为接地电极,耳机离右外耳道口0.5 cm,左耳加低强度白噪声(低于刺激声20 dB SPL)掩蔽。用短声(click)为刺激声,由TDH-39P耳塞输出,采样重复频率11.1次/s(刺激间隔90 ms),交替起始位相以消除伪迹,滤波带通100~3 000 Hz,叠加次数256~512次,分析时程20 ms,声刺激重复率15 Hz,放大倍数100 000倍。测试时给声强度由100 dB SPL开始,以5 dB SPL递减诱发ABR波形,以能引出波Ⅲ的最小声强记录其反应阈(统计学分析时选择刺激声压级90、60、30 dB SPL为记录点)。
1.2.3耳蜗扫描电镜标本及透射电镜标本制备 扫描电镜标本制备:各组造模成功24小时分别完成ABR测试后,每组取4只豚鼠断头取右侧听泡,于显微镜下用分离针取出镫骨底板并挑破圆窗,沿耳蜗底回挑开蜗窗下缘骨壁,再在耳蜗顶部钻一小孔,用配置好的0.01 M PBS缓冲液缓慢灌注,冲洗出内、外淋巴液,将耳蜗组织浸入2%戊二醛固定液,在4 ℃冰箱内固定12小时以上取出耳蜗组织,漂洗后自耳蜗底层逐层剥离蜗壳,完整暴露出内耳膜迷路。经锇酸及漂洗后,将样品依次浸入不同浓度的乙醇中,然后予纯丙酮置换,转入中间液醋酸异戊酯中,再将移至临界点干燥仪的样品室内干燥,喷金后扫描电镜下观察标本。 透射电镜标本制备:取各组剩余4只豚鼠,断头后迅速取右侧听泡,同扫描电镜制备方法首先予戊二醛将耳蜗组织固定,0.1 M pH 7.4 PBS缓冲液反复冲洗后移入10% EDTA(PH7.4)中脱钙7天,双蒸水清洗标本,按顺序浸入不同浓度的乙醇中梯度脱水,然后再浸入不同浓度的丙酮中。环氧树脂包埋,超薄切片,厚度50~70 nm。枸缘酸铅染色,1%NaOH溶液洗一次,水洗二次,干燥后透射电镜观察。
1.3统计学方法 实验结果均采用SPSS13.0统计软件以协方差分析+配比样本t检验进行统计学分析(α=0.05)。
2 结果
2.1实验前后各组豚鼠的ABR反应阈比较 实验前4组动物ABR波Ⅲ反应阈差异无统计学意义(P>0.05),缺血再灌注24 h后第3组ABR波Ⅲ反应阈显著高于第1组和第2组(P<0.05),第4组ABR波Ⅲ反应阈比第3组明显降低(P<0.05)(表1)。
2.2耳蜗组织扫描电镜观察 扫描电镜下观察各组耳蜗第二回和底回,第1、2组内、外毛细胞排列有序,细胞形态正常,无缺失,细胞间连接完整,可见外毛细胞静纤毛成“W”型由低到高的整齐排列,内毛细胞静纤毛呈弓字形整齐排列,静纤毛顶部有横链相互联系(图1,2);第3组耳蜗底回外毛细胞纤毛倒伏、脱落,部分外毛细胞融合成团块状,内毛细胞纤毛散乱,呈团状改变(图3);第4组偶有外毛细胞纤毛倒伏、缺失、融合成束状,内毛细胞纤毛排列规整、无缺失、倒伏,各层细胞形态清楚,未见明显缺失、瘢痕形成(图4)。
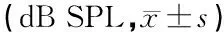
表1 各组豚鼠ABR反应阈比较
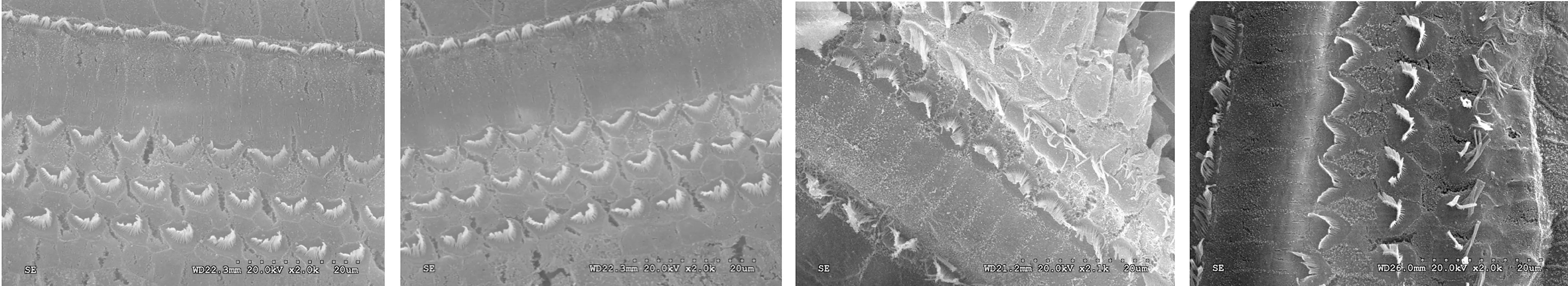
图1第1组耳蜗底回扫描电镜图三排外毛细胞及内毛细胞形态正常,细胞边界清晰,细胞间连接完整,纤毛排列整齐,无倒伏、缺失
图2第2组耳蜗底回扫描电镜图三排外毛细胞及内毛细胞排列整齐,纤毛无倒伏、缺失,细胞形态正常
图3第3组耳蜗底回扫描电镜图外毛细胞纤毛倒伏、脱落,部分外毛细胞融合成团块状,内毛细胞纤毛散乱,呈团状改变
图4第4组耳蜗底回扫描电镜图第一排外毛细胞纤毛倒伏、缺失、融合成束状,第二、三排外毛细胞及内毛细胞纤毛排列规整、无缺失、倒伏,各层细胞形态清楚,未见明显缺失、瘢痕形成
2.3耳蜗组织透射电镜观察 第1、2组毛细胞细胞核呈圆形,边界清晰,无固缩及边集,线粒体无肿胀,分布均匀,突触结构完整(图5,6);第3组毛细胞细胞核膜溶解,边界不清,线粒体肿胀、边集,突触结构消失,可见纤毛缺失(图7);第4组毛细胞胞核圆,未见固缩、边集,线粒体分布均匀,无明显肿胀,突触结构尚清晰(图8)。第3组动物耳蜗血管纹内皮细胞细胞核固缩、边集,细胞内和细胞间有空泡形成,螺旋神经节神经元胞核轻度固缩、边集,神经元髓鞘可见脱髓鞘改变(图9,10)。而第4组血管纹及螺旋神经节的损伤轻于第3组(图11,12)。
图5第1组毛细胞透射电镜图细胞核呈圆形,边界清晰,无固缩及边集,线粒体无明显肿胀,分布均匀,毛细胞突触结构完整
图6第2组毛细胞透射电镜图细胞核呈圆形,无固缩及边集,线粒体无明显肿胀,分布均匀,突触结构完整
图7第3组毛细胞透射电镜图细胞核膜溶解,边界不清,线粒体肿胀、边集,突触结构消失,可见纤毛缺失
图8第4组毛细胞透射电镜图细胞核圆,未见固缩、边集,线粒体分布均匀,无明显肿胀,突触结构尚清晰
图9第3组螺旋神经节神经元透射电镜图像可见胞核轻度固缩、边集,神经元髓鞘可见大量脱髓鞘改变
图10第3组血管纹血管内皮细胞透射电镜图像可见细胞核固缩、边集,血管呈充血改变,结构疏松,细胞内和细胞间有空泡形成
图11第4组螺旋神经节神经元透射电镜图像可见细胞核无固缩及边集,神经元髓鞘可见少量脱髓鞘改变
图12第4组血管纹血管内皮细胞透射电镜图像可见胞核核膜完整,无固缩、边集现象
3 讨论
目前,国内外研究者建立了诸多不同的豚鼠耳蜗缺血再灌注模型[2~6]。为构建豚鼠耳蜗缺血再灌注模型,预实验时发现如永久阻断椎动脉不但易致动物死亡,而且不易保证足够的血液再灌注流量,所以本实验时改良了永久结扎双侧椎动脉的方法,通过暂时性微动脉夹夹闭双侧椎动脉及右侧颈总动脉60分钟制造缺血模型,然后松开三条动脉制造再灌注模型,这样既有效地形成耳蜗的缺血损伤,又能保证在复流后动物较高的存活率,从文中结果看,本研究采用的耳蜗缺血再灌注方法是可行的,且造模是成功的。
有研究指出缺血后再灌注造成的损伤大于单纯缺血造成的损伤[7],缺血再灌注损伤(ischemia reperfusion injury, IRI)是指缺血的组织、器官恢复血液灌注后不但不能使其结构和功能恢复,反而加重其结构损伤和功能障碍的现象。
耳蜗对内耳血流和氧供应的降低或中断极为敏感,缺血再灌注损伤导致内耳结构和功能改变的机制复杂,可能与钙超载和炎症介质的释放等有关。当耳蜗发生缺血再灌注损伤时,耳蜗细胞内Na+/Ca2+交换异常,细胞内钙离子迅速增加;钙离子超载可使细胞膜受损、破裂,线粒体损伤抑制氧化磷酸化过程,ATP 生成减少,同时耳蜗内氧自由基生成增多[8],破坏包膜,导致细胞凋亡、坏死;钙超载、氧自由基增多可使生物膜受损,细胞肿胀,线粒体功能受损,能量生成减少,耳蜗无能量供应。兴奋性中毒损伤螺旋神经节,导致传入神经纤维肿胀[9],听觉传导通路受阻,发生听力障碍。从文中结果看,第3组动物因耳蜗缺血再灌注使其耳蜗螺旋神经节神经元发生脱髓鞘改变,缺血再灌注后因多种机制相互作用,导致耳蜗毛细胞肿胀、破裂,细胞凋亡、坏死;该组动物ABR反应阈明显较实验前及其他各组升高,与Alonso的研究结果相似[10]。研究表明PPTA{(E)-5-[(3,4-亚甲二氧基苯乙基)甲氨基]-1-(4)-羟基苯基-1-戊烯-3-酮盐酸盐;分子式C21H24O4NCl}可能通过改善脑缺血再灌注损伤后引起的炎症及凋亡反应,增加脑组织对缺血再灌注损伤应激的耐受性,从而发挥神经保护作用。在对局灶性脑缺血再灌注损伤的研究中,PPTA可能通过抑制脂质过氧反应和清除自由基等机制,发挥神经保护作用[11,12]。本研究第4组豚鼠经早期使用PPTA,其ABR反应阈虽较正常组升高,但明显低于第3组(即缺血再灌注对照组),表明PPTA对再灌注后耳蜗功能有保护作用,可能在缺血再灌注的早期PPTA发挥了抗钙超载的作用,减轻了钙超载引起的细胞损伤,同时有可能减少了自由基的释放,从而减轻线粒体损伤,保护了毛细胞的功能。
Tabuchi等[13]认为在缺血15分钟和30分钟,分别可以观察到耳蜗外毛细胞和内毛细胞肿胀,随着缺血时间延长,细胞会发生核溶解,细胞膜断裂,柯蒂器崩解,毛细胞缺损,血管纹出现水肿变性,继而崩解;Watanabe等[14]认为外毛细胞更易耐受缺血损伤。从本研究结果可见,豚鼠耳蜗缺血再灌注后外毛细胞形态破坏,部分缺失,细胞间连接破坏,静纤毛倒伏、脱落、缺失或融合成束状,第一、二排尤为明显,底回比其它各回明显,内毛细胞结构基本正常,与Watanabe等[14]与所报导的结果有所不同;另外,透射电镜下可见第3组毛细胞、螺旋神经节及血管纹血管内皮细胞的病变明显较第4组严重,可能PPTA通过清除耳蜗组织的氧自由基、对抗钙超载等机制抑制了缺血再灌注对耳蜗组织带来的损害,能快速而有效的治疗缺血再灌注对耳蜗造成的损伤;但由于缺血损伤会部分造成耳蜗功能的不可逆损害,扫描电镜观察第4组仍有毛细胞缺失,说明再灌注时虽应用了PPTA,但并不能改善这部分损伤,故该组动物ABR反应阈虽较第3组低,但仍较实验前升高。
综上所述,缺血再灌注早期应用PPTA对豚鼠耳蜗的缺血再灌注导致的听功能损伤有保护作用,但PPTA对抗耳蜗缺血再灌注损伤的具体机制,以及给药的最佳时机与剂量需要进一步探索。
4 参考文献
1 宾娟,王茜,卓烨烨,等.椒苯酮胺对全脑缺血/再灌注损伤大鼠的保护作用[J].中国新药杂志,2012,21:366.
2 Okada M, Kawaguchi AT, Hakuba N, et al.Liposome-encapsulated hemoglobin alleviates hearing loss after transient cochlear ischemia and reperfusion in the gerbil[J].Artif Organs,2012,36:178.
3 张学渊, 汪吉宝. 光化学建立豚鼠耳蜗微循环障碍模型的初步报告[J]. 中华耳鼻咽喉科杂志, 1995, 30:285.
4 Hakuba N, Matsubara A, Hyodo J,et al.AMPA/kainate-type glutamate receptor antagonist reduces progressive inner hair cell loss after transient cochlear ischemia[J]. Brain Res,2003,979:194.
5 Tabuchi K, Ito Z, Wada T, et al.Effect of 7-nitroindazole upon cochlear dysfuction induced by transient local anoxia[J].Ann Otol Rhino Laryngol,2000,109:715.
6 Tabuchi K, Ito Z, Tsuji S, et a..Poly(adenosine diphosphate-ribose) synthetase inhibitor 3-aminobenzamide alleviates cochlear dysfuction induced by transient ischemia[J].Ann Otol Rhino Laryngol,2001,110:118.
7 Nakashima T, Naganawa S, Sone M, et al. Disorders of cochlear blood flow[J] . Brain Research Reviews, 2003, 43: 17.
8 Morizane I, Hakuba N, Hyodo J, et al. Ischemic damage increases nitric oxide production via inducible nitric oxide synthase in the cochlea[J]. Neurosci Lett,2005,391:62.
9 Puel JL, Pujol R, Tribillac F, et al. Excitatory amino acid antagonists protect cochlear auditory neurons from excitotoxicity[J]. J Comp Neurol,1994,341:241.
11 朱汉祎,宾娟,王闯,等,椒苯酮胺对缺血再灌注大鼠认识障碍的影响[J].南方医科大学学报, 2011,31: 1 858.
12 朱汉祎,林焕冰,陈玉嫔,等,椒苯酮胺对局灶性脑缺血再灌注损伤大鼠的神经保护作用[ J]. 军事医学,2011,35:286.
13 Tabuchi K,Tsuji S, Fujihira K,et al. Outer hair cells functionally and structurally deteriorate during reperfusion[J]. Hear Res,2002,173:153.
14 Watanabe F, Hakuba N, Gyo K.Measurement of DPOAE after ischemia/reperfusion injury of the cochlea in gerbils. Neurosci Lett,2009,467:135.

