草质素体外清除自由基及抑制蛋白质氧化的作用
乔 燕,刘学波*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
活性氧(ROS)是需氧有机体细胞正常代谢所伴随的副产物,正常生物体具有维持活性氧平衡生理浓度的功能,但当机体内过多的ROS与抗氧化物质不足同时存在时,机体将处于一种不平衡代谢状态,造成机体氧化应激而损伤生物大分子,如蛋白质、核酸和脂类等,引起其结构和功能的改变,最终导致机体生理和病理的改变[1]。蛋白质占细胞和组织干质量的68%,是生物功能的主要体现者,因此成为ROS在生物体内的主要攻击标靶[2]。从生化机制方面来看,ROS可以通过直接诱导蛋白质主链和侧链氧化,也可通过脂质过氧化和糖基化等过程间接诱导蛋白质氧化,而蛋白质羰基化则是蛋白质直接和间接氧化的结果之一,是蛋白质分子被自由基氧化修饰的一个重要标记[3]。研究表明,蛋白质的氧化损伤可造成许多重大疾病,如帕金森(PD)、阿尔茨海默(AD)和肌萎缩侧索硬化(ALS)等衰老相关疾病[4],肿瘤[5]及其他疾病[6]。因此抗氧化剂的开发以及对机体生物大分子的保护成为国内外研究的热点。近年,大量研究已证实,黄酮类物质,如黄芩黄素、黄芩苷、槲皮素、假荆芥属苷等[7-11],具有较强清除自由基的能力及抗衰老、抗癌、消炎、抑制糖尿病并发症等功能。
草质素(herbacetin)是3,4’,5,7,8-五羟基取代的黄酮类物质(图1),主要存在于笔筒草、红景天、棉花等植物中[12-13]。目前,国内外鲜有对草质素生物活性及药理活性的研究报道,而研究表明,酚羟基官能团的位置及个数对抗氧化性起重要的作用[14-15],鉴于草质素的结构中含有5个酚羟基,推测其可能具有较强的体外抗氧化性[16]。因此本实验拟初步探讨草质素清除自由基及预防蛋白氧化、减少蛋白羰基化,以期为草质素在天然抗氧化剂和功能性食品领域的开发应用提供依据。
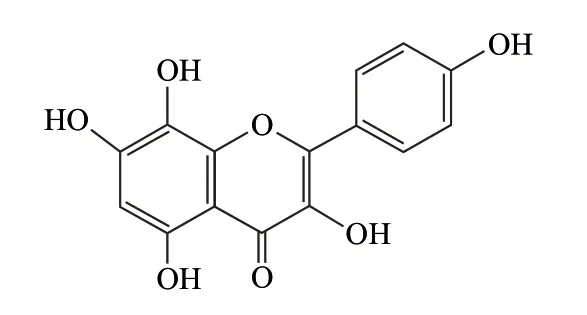
图1 草质素结构Fig.1 Chemical structure of herbacetin
1 材料与方法
1.1 材料与试剂
草质素(纯度>98%) 上海永恒生物技术有限公司;牛血清白蛋白(BSA)、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)、1,1-二苯基-2-三硝基苯肼(DPPH)美国Sigma公司;Anti-DNP、Anti-Rabbit 美国Santa Cruz公司;噻唑兰(MTT)、2,4-二硝基苯肼(DNPH) 美国Amresco公司。
1.2 仪器与设备
680酶标仪、165-8001垂直电泳槽 美国Bio-Rad公司;QYC110台式恒温振荡器 上海福玛公司;AUY220万分之一天平 日本岛津公司;微量移液枪德国Eppendorf公司。
1.3 方法
1.3.1 试剂配制
草质素溶液(50mmol/L):称取草质素粉末0.00302g,溶于200μL甲醇(纯度95.5%)中,-20℃避光保存,用甲醇稀释成不同浓度的草质素工作液。
DDPH溶液(1mmol/L):称取0.00786g DPPH溶于20mL 甲醇(纯度95.5%),避光保存。
DNPH溶液(20mmol/L):0.39628g DNPH溶于100mL 0.2mol/L HCl中,避光保存。
1.3.2 DPPH自由基清除能力测定
参考Mishra等[17]的方法略有改动。向离心管中加入49μL甲醇及1μL不同浓度的草质素溶液,再分别加入50μL DPPH溶液,混合均匀,室温下避光反应30min,点样于96孔板,517nm波长处测定吸光度,记为Ai;同时以99μL的甲醇与1μL草质素溶液混合后的吸光度记为Aj;以50μL的DPPH溶液与50μL的甲醇混合后的吸光度记为A;以100μL甲醇的吸光度记为A0。DPPH自由基清除率计算如公式(1)。
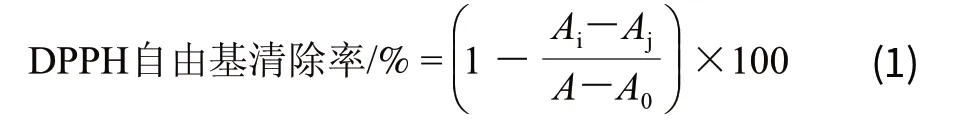
1.3.3 羟自由基(·OH)清除能力测定
参照陈金娥等[18]的方法略有改动。向离心管中加入96μL超纯水、4μL不同浓度草质素溶液以及100μL 6mmol/L FeSO4、100μL 2.4mmol/L H2O2溶液,混合均匀,在室温下静置10min,再加入100μL水杨酸,37℃水浴反应30min,点样于96孔板,510nm波长处测定吸光度,记为Ai;同时以296μL超纯水与4μL甲醇、100μL 6mmol/L水杨酸混合后的吸光度记为A。羟自由基清除率计算如公式(2)。
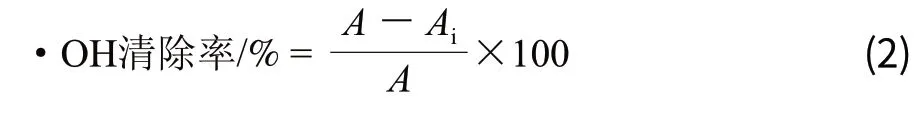
1.3.4 Cu2+/H2O2诱导BSA蛋白氧化损伤
向离心管中加入97μL BSA蛋白溶液(本反应体系BSA蛋白溶液质量浓度均为0.6mg/mL)和1μL草质素溶液,混合均匀,室温孵育30min,再分别加入1μL 100 mol/L Cu2+和2.5mmol/L H2O2,37℃水浴90min;同时以97μL BSA蛋白溶液与1μL甲醇、2μL 10mmol/L PB缓冲液(pH 6.0)混合液作为阳性对照;以97μL BSA蛋白溶液、1μL甲醇、1μL Cu2+和1μL H2O2(Cu2+和H2O2的浓度同上)的混合液作为阴性对照。反应结束后,加入25μL SDS,95℃水浴5min,使蛋白充分变性。同体积的蛋白样品经10%聚丙烯凝胶电泳后,0.15%的考马斯亮蓝R-250染色30min,脱色过夜,蛋白含量由Quantity One 4.6.2软件分析。草质素对Cu2+/H2O2诱导BSA蛋白氧化损伤的保护率计算如公式(3)。
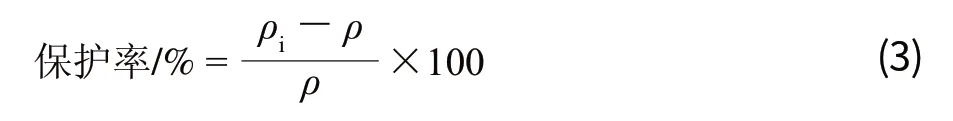
式中:ρ表示Cu2+/H2O2单独处理后,剩余BSA蛋白密度;ρi表示不同浓度草质素预处理,再经Cu2+/H2O2处理后,剩余BSA蛋白密度。
1.3.5 Cu2+/H2O2诱导BSA蛋白羰基化
将1.3.4节中制备好的蛋白样品经10%聚丙烯凝胶电泳后,10V 25min转印,使凝胶上的蛋白转移到PVDF膜上。膜再与DNPH溶液衍生30min,2mol/L HCl洗涤3次,每次5min,甲醇洗涤5次,每次5min。5%脱脂乳室温封闭2h,TBST洗涤。用抗DNP抗体4℃孵育过夜,TBST洗涤,Anti-Rabbit抗体室温孵育2h,TBST洗涤,化学成像系统检测蛋白质羰基化的产生。草质素对Cu2+/H2O2诱导BSA蛋白羰基化的抑制率计算如公式(4)。
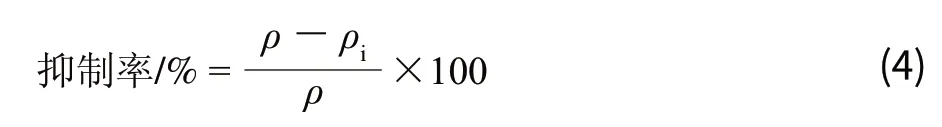
式中:ρ表示Cu2+/H2O2单独处理后,剩余BSA蛋白密度;ρi表示不同浓度草质素预处理,再经Cu2+/H2O2处理后,剩余BSA蛋白密度。
1.3.6 AAPH诱导BSA蛋白氧化损伤
向离心管中加入50μL BSA蛋白溶液(本反应体系中BSA蛋白溶液质量浓度均为1.2mg/mL,PB浓度同上),1μL草质素溶液和29μL PB溶液,混合均匀,室温孵育30min,再分别加入20μL 500mmol/L AAPH溶液,37℃反应6h;同时以50μL BSA蛋白溶液、1μL甲醇及49μL PB混合液作为阳性对照组;以50μL BSA蛋白溶液、1μL甲醇、29μL PB和20μL 500mmol/L AAPH的混合液作为阴性对照。反应结束后,加入25μL SDS,95℃反应5min,使蛋白充分变性。同体积的蛋白样品经10%聚丙烯凝胶电泳后,0.15%的考马斯亮蓝R-250染色30min,脱色过夜,蛋白含量由Quantity One 4.6.2 软件分析。
1.3.7 AAPH诱导BSA蛋白羰基化
将1.3.5节中制备好的蛋白样品经10%聚丙烯凝胶电泳后,10V 25min转印,使凝胶上的蛋白转移到PVDF膜上。膜再与DNPH衍生30min,2mol/L HCl洗涤3次,每次5min,甲醇洗涤5次,每次5min。5%脱脂乳室温封闭2h,TBST洗涤。用抗DNP抗体4℃孵育过夜,TBST洗涤,Anti-Rabbit抗体室温孵育2h,TBST洗涤,化学成像系统检测蛋白质羰基化的产生。
1.4 数据处理
所有实验数据用Microsoft Excel 2007处理,DPS 7.05软件进行统计学分析,显著水平P<0.05。
2 结果与分析
2.1 草质素对DPPH自由基清除能力
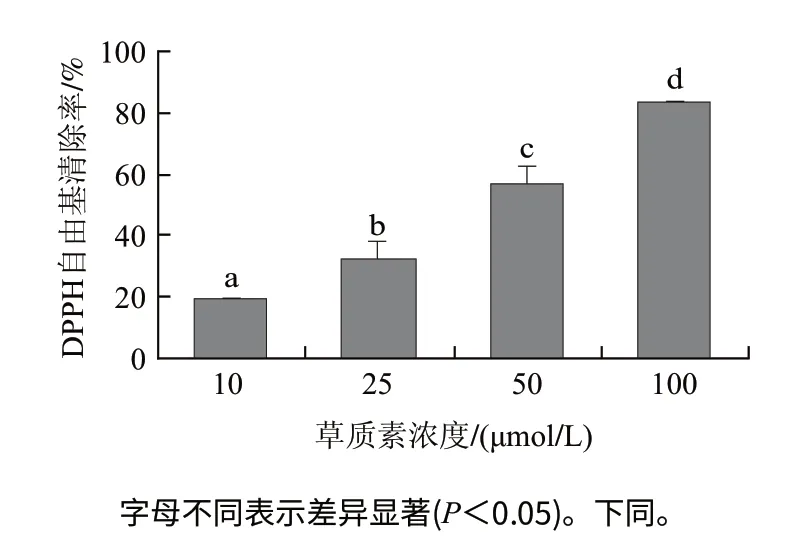
图2 草质素对DPPH自由基清除的作用Fig.2 Scavenging effect of herbacetin on DPPH radical
由图2可知,不同浓度草质素对DPPH自由基均有显著的清除作用。在浓度10~100μmol/L的范围内,草质素对DPPH自由基的清除率随着其浓度增大而增大,依次为19.14%、32.00%、56.98%、83.22%,其IC50值为49.28μmol/L,即14.88μg/mL。与江岩等[19]测定的VC清除DPPH自由能力相比(IC50=4.09μg/mL),草质素清除DPPH自由基能力略弱于VC。
2.2 草质素对·OH清除能力
由图3可知,草质素能够显著地清除·OH,在10~50μmol/L浓度范围内,其清除能力没有明显变化。浓度为100、250、500μmol/L时,清除率分别达到35.97%、52.66%、62.61%,其清除·OH的IC50值为219.20μmol/L,即66.20μg/mL,参照郭松年[20]的研究可知,草质素清除·OH的能力略高于VC(IC50=89μg/mL)。由清除DPPH自由基和·OH的IC50值可知,草质素清除DPPH自由基的能力明显强于·OH,而VC清除DPPH自由基的能力强于草质素,清除·OH的能力略低于草质素。

图3 草质素对羟自由基清除的作用Fig.3 Scavenging effect of herbacetin on hydroxyl radical
2.3 草质素对Cu2+/H2O2诱导的BSA蛋白氧化损伤的保护作用
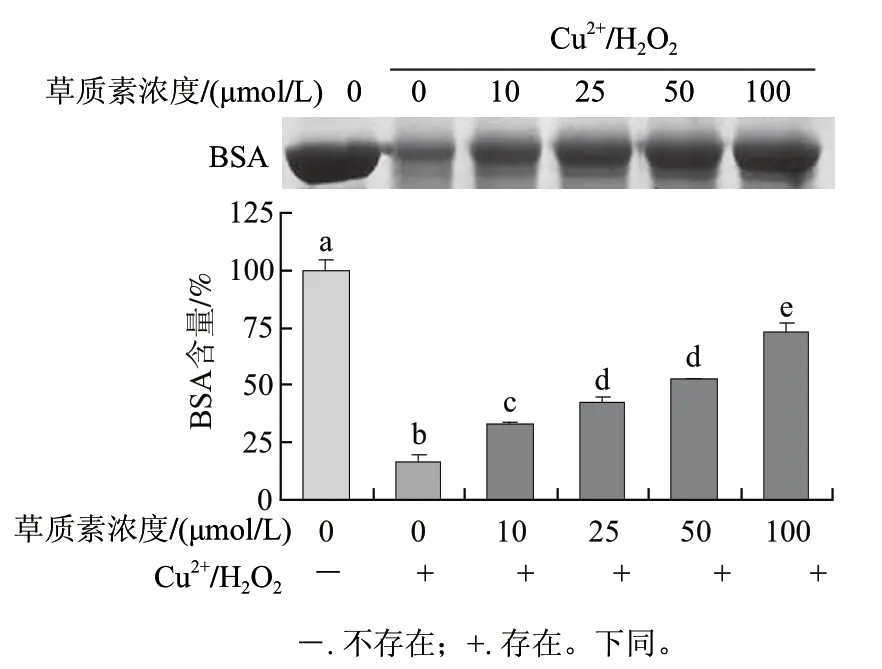
图4 草质素对Cu2+/H2O2诱导的BSA蛋白氧化损伤的保护作用Fig.4 Protective effect of herbacetin against oxidative damage of BSA induced by Cu2+/H2O2
由图4可知,不同浓度草质素均可显著保护Cu2+/H2O2诱导的BSA蛋白氧化损伤。Cu2+催化H2O2产生的·OH可显著的诱导BSA蛋白损伤,经过不同浓度的草质素处理后,可保护蛋白免受·OH的氧化,其保护率分别为55.00%、112.00%、139.00%和252.00%。
2.4 草质素对AAPH诱导的BSA蛋白氧化损伤的保护作用
由图5可知,浓度在10~100μmol/L范围内,草质素均可显著保护AAPH诱导的BSA蛋白氧化损伤。AAPH经热分解产生以碳为中心的自由基,在氧气的参与下,进一步生成·OOH而导致BSA蛋白发生氧化损伤[21],而草质素可防止蛋白损伤。当浓度达到100μmol/L时,其对AAPH诱导的BSA蛋白损伤的保护作用已接近未经AAPH处理组。
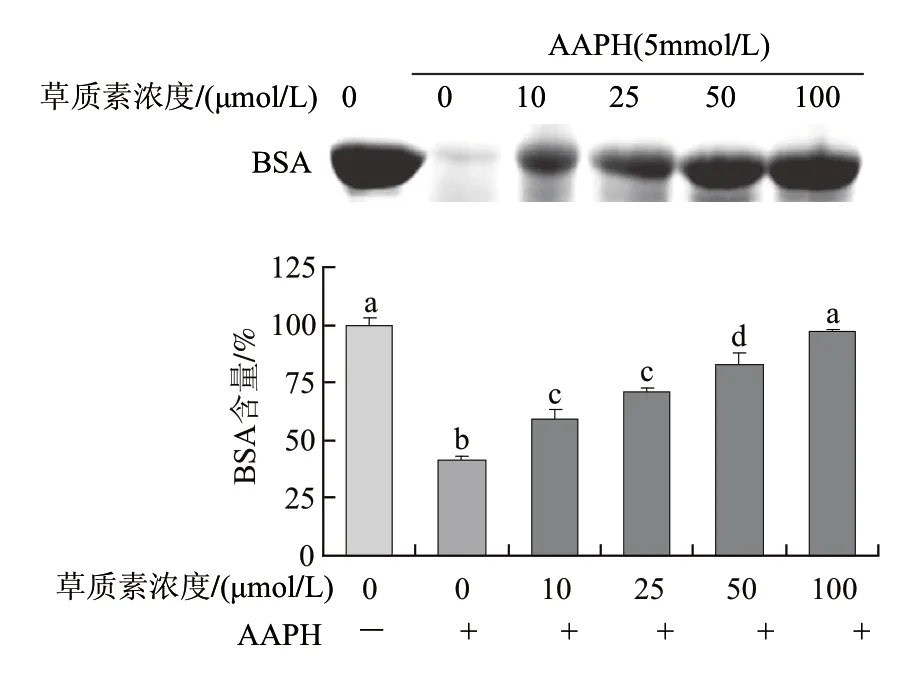
图5 草质素对AAPH诱导的BSA蛋白氧化损伤的保护作用Fig.5 Protective effect of herbacetin against oxidative damage of BSA induced by AAPH
2.5 草质素对Cu2+/H2O2诱导的BSA蛋白羰基化的抑制作用
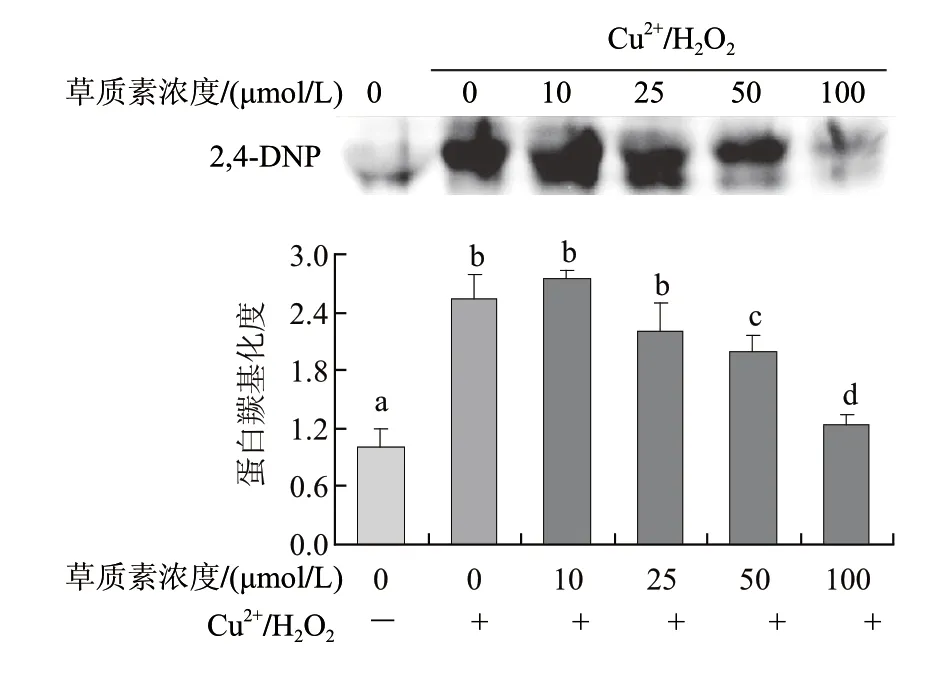
图6 草质素对Cu2+/H2O2诱导的蛋白羰基化的抑制作用Fig.6 Inhibition effect of herbacetin on Cu2+/H2O2-induced protein carbonylation
由图6可知,草质素可抑制Cu2+/H2O2诱导的BSA蛋白羰基化,50、100μmol/L草质素能显著抑制蛋白质羰基化的发生,抑制率分别为21%、50%。但10、25μmol/L组的抑制作用不明显,原因可能是低浓度草质素清除羟自由基的能力较弱,还不能防止羟自由基对蛋白侧链氨基酸的攻击。
2.6 草质素对AAPH诱导的BSA蛋白羰基化的抑制作用
由图7可知,经AAPH处理后,也可显著地诱导BSA发生羰基化,不同浓度的草质素前处理,均可抑制羰基化的发生,且随着草质素浓度的增加,羰基化的程度逐渐减弱。浓度为25、50、100μmol/L时,羰基化程度与AAPH组相比分别降低了1.2、2.1倍和2.9倍。

图7 草质素对AAPH诱导的蛋白羰基化的抑制作用Fig.7 Inhibition effect of herbacetin on AAPH -induced protein carbonylation
3 结 论
蛋白质是生物体的重要组成成分,在生命活动中担负着重要功能。其侧链的赖氨酸、精氨酸、脯氨酸和苏氨酸等残基易受自由基攻击而发生蛋白氧化损伤,蛋白质羰基化则是蛋白质的氨基酸残基受到攻击而生成的NH3和相应羰基衍生物,其含量的多少间接反应了蛋白质的氧化损伤程度[22-25]。本研究通过对DPPH自由基和·OH清除能力的测定,表明草质素能显著清除这两种自由基,但清除DPPH自由基的能力要强于·OH。当BSA蛋白用Cu2+/H2O2或AAPH处理后,可显著的诱导BSA蛋白氧化及羰基化,原因在于Cu2+催化H2O2产生的·OH和AAPH产生的·OOH自由基攻击蛋白质,而导致蛋白质氨基酸残基被修饰,分子构象的改变[26-28]。本研究发现,草质素可使蛋白氧化及羰基化的程度降低,原因可能是草质素能清除自由基,阻止了自由基链式反应导致的对蛋白质的氧化攻击。
综上所述,草质素可显著清除自由基及防止蛋白发生氧化。该研究为草质素预防某些与蛋白氧化损伤有关的疾病及功能性食品的开发提供了一定的理论依据。然而,有关草质素药理及病理活性尚不清楚,还需进一步深入。
[1]许曼音, 陆广华, 陈名道.糖尿病学[M].上海: 上海科学技术出版社,2010: 124-125.
[2]WRIGHT A, BUBB W A, HAWKINS C L, et al.Singlet oxygenmeidated protein oxidation: evidence for the formation of reactive side chain peroxides on tyrosine residues[J].Photochemistry and Photobiology, 2002, 76(1): 35-46.
[3]李国林, 印大中.ROS介导的蛋白质氧化的生化机制[J].生命的化学, 2007, 27(6): 516-520.
[4]SAYRE L M, SMITH M A, PERRY G.Chemistry and biochemistryof oxidative stress in neurodegenerative disease[J].Current Medicinal Chemistry, 2001, 8(7): 721-738.
[5]ISHII T, YASUDA K, AKATSUKA A, et al.A mutation in the SDHC gene of complex increases oxidative stress resulting in apoptosis and tumorigenesis[J].Cancer Research, 2005, 65(1): 203-209.
[6]FENKCI V, FENKCI S, YILMAZER M, et al.Decreased total antioxidant status and increased oxidative stress in women with polycystic ovary syndrome may contribute to risk of cardiovascular disease[J].Fertil Steril, 2003, 80(1): 123-127.
[7]GAO Zhonghong, HUANG Kaixun, LIANG Xianliang, et al.Free radical scavenging and antioxidant activities of flavonoids extracted from the radix ofScutellaria baicalensisGeorgi[J].Biochimica et Biophysica acta-General Subjects, 1999, 1472(3): 643-650.
[8]COSKUN O, KANTER M, KORKMAZ A, et al.Quercetin, a flavonoid antioxidant, prewents and protects streptozotocin-induced oxidative stress and β-cell damage in rat pancreas[J].Pharmacological Research, 2005, 51(2): 117-123.
[9]TERAO J.Dietary flavonoids as antioxidants[J].Forum Nutrition,2009, 61: 87-94.
[10]LOPEZ-LAZARO M.Flavonoids as anticancer agents: structureactivity relationship study[J].Current Medicinal Chemistry-Anti-Cancer Agents, 2002, 2(6): 691-714.
[11]AGARWAL O P.The anti-inflammatory action of nepitrin, a flavonoid[J].Inflammation Research, 1982, 12(3): 298-302.
[12]PANGAROVA T T, ZAPESOCHNAYA G G, NUKHIMOVSKII E L.Flavonoids ofRhodiola algida[J].Chemistry of Natural Compound,1974, 10(5): 685-686.
[13]NEELAKANTAM K, SESHADRI T R.Pigments of cotton flowers.Part IV.Constitution of herbacitrin and herbacetin-new glucoside and aglucone (flavonol)[J].Proceedings Mathematical Sciences, 1937,5(4): 357-364.
[14]FENG Jianying, LIU Zaixun.Phenolic and enolic hydroxyl groups in curcumin: which plays the major role in scavenging radicals[J].Journal of Agriculture and Food Chemistry, 2009, 57(22): 11041-11046.
[15]CHEN Z Y, CHAN P T, HO K Y, et al.Antioxidant activity of natural flavonoids is governed by number and location of their aromatic hydroxyl groups[J].Chemistry and Physics of Lipids, 1996, 79(2): 157-163.
[16]LEE D H, SZCZEPANSKI M, LEE Y J.Role of Bax in quercetininduced apoptosis in human prostate cancer cells[J].Biochemical Pharmacology, 2008, 75(12): 2345-2355.
[17]MISHRA K, OJHA H, CHAUDHURY N K.Estimation of antiradical properties of antioxidants using DPPH· assay: a critical review and results[J].Food Chemistry, 2012, 130: 1036-1043.
[18]陈金娥, 丰慧君, 张海容.红茶、绿茶、乌龙茶活性成分抗氧化性研究[J].食品科学, 2009, 30(3): 62-66.
[19]江岩, 郑力, 克热木江·吐尔逊江.药桑甚花青素的体外抗氧化作用[J].食品科学, 2011, 32(13): 45-48.
[20]郭松年.石榴汁花色苷稳定性、抗氧化性及其组分鉴定[D].杨凌:西北农林科技大学, 2008.
[21]MURAOKA S, MIURA T.Protection by estrogens of biological damage by 2, 2’-azobis(2-amidinopropane) dihydrochloride[J].Journal of Steroid Biochemistry and Molecular Biology, 2002, 82: 343-348.
[22]LEVINE R L, GARLAND D, OLIVER C N, et al.Determination of carbonyl contents in oxidatively modified proteins[J].Methods in Enzymology, 1990, 186: 464-478.
[23]文镜, 张春华, 董雨, 等.蛋白质羰基含量与蛋白质氧化损伤[J].食品科学, 2003, 24(10): 153-157.
[24]DALLE-DONNE I.Protein carbonyl groups as biomarkers of oxidative stress[J].Clinica Chimica Acta, 2003, 329: 23-38.
[25]张文玲, 魏丽勤, 王林嵩, 等.活性氧对生物大分子的氧化性损伤[J].河南师范大学学报, 2000, 28(4): 69-71.
[26]BRAUGHLER J M, DUNCAN L A, CHASE R L.The involvement of iron in lipid peroxidation[J].Journal of Biological Chemistry, 1986,261: 10282-10289.
[27]KANG K A, CHAE S, KOH Y S, KIM J S, et al.Protective effect of puerariae radix on oxidative stress induced by hydrogen peroxide and streptozotocin[J].Biological & Pharmaceutical Bulletin, 2005, 28:1154-1160.
[28]ZHAO Yuling, LI Hailing, GAO Zhonghong, et al.Effects of flavonoids extracted fromScutellaria baicalensisGeorgi on hemin-nitrite-H2O2induced liver injury[J].European Journal of Pharmacology, 2006, 536: 192-199.

