樱桃根际促生细菌YT3 的培养基及发酵条件优化1)
马海林 邢尚军 刘方春 马丙尧 丁延琴 陈 波 杜秉海
(山东省森林植被生态修复工程技术研究中心(山东省林业科学研究院),济南,250014) (山东农业大学)
植物根际促生菌(PGPR)是指生存于植物根际、根表,对植物生长有促进或对病原菌有拮抗作用的有益细菌的统称[1-3]。大量文献证明,PGPR 对植物生长具有显著的促进作用[4-5]。PGPR 菌株产生的植物激素可增强根系吸收矿物营养和水分的能力,从而促进植物生长。同时PGPR 在根围的定殖能力在一定程度上能抑制病原物的定殖和传播。假单胞菌(Pseudomonas spp.)是一类良好的植物根际促生细菌,具有分布广、数量多、营养需要简单、繁殖快、竞争定殖力强的特点。它们可分解葡萄糖、产接触酶、产氧化酶、还原硝酸盐,可通过联合固氮、溶磷、产生铁载体、产植物激素等多种机制促进植物生长[6-7]。
接种土壤微生物,特别是接种PGPR,被普遍认为是一种环境友好经济有效的提高作物产量和品质的方法[2,5]。生物有机肥行业标准要求贮存至第180 天时,有效活菌数>0.2 亿CFU·g-1,水分<30%[8]。若发酵液中的有效活菌数较低,接种时发酵液的用量较大,易导致生物有机肥料的含水量过高。因此,提高发酵液中的有效活菌数是生物有机肥料研制和生产的关键环节。关于不同微生物发酵条件优化的报道很多,雷娟等人筛选出一株对青枯假单胞菌,通过发酵优化试验,确定该菌株的最佳发酵配方为:蔗糖8.00%、大豆粉5.00%、NaNO31.00%、NaCl0.20%、CaCO30.40%、K2HPO40.08%;最佳发酵条件为发酵培养基初始pH 值7.0,30 ℃,恒温摇床200 r/min[9]。韩丽等采用单因素和正交试验相结合的方法研究了生防菌株B26 液体发酵条件[10];郑艳等以选育的洋葱假单胞菌TG -15 -03 为生产菌株,考察了不同发酵条件对乳糖酸产量的影响[11]。本研究选用的假单胞菌YT3(菌种保藏号CGMCC No.5319)筛选于樱桃根系,经试验证明具有较好的促生作用,对于促进植物根系生长、活化土壤养分具有积极作用,具备开发微生物肥料的潜力[12-13],目前还没有关于YT3 的发酵条件优化的研究。因此,笔者采用单因素试验和正交试验对YT3菌株液体发酵条件进行优化,得到其最适培养基和培养条件,以期为该菌株的工厂化生产奠定基础。
1 材料与方法
1.1 菌种
试验用生物材料YT3 是从樱桃根际土壤筛选出的1 株根际促生细菌,通过对其进行形态学观察、生理生化测定以及16S rDNA 序列及系统发育分析,将其鉴定为假单胞菌,已保藏于中国微生物菌种保藏管理中心(CGMCC No.5319)[13]。
1.2 主要培养基
检测培养基:牛肉膏0.3%,蛋白胨1.0%,氯化钠0.5%,琼脂2.0%,pH=7.0 ~7.2。
种子培养基:牛肉膏0.3%,蛋白胨1.0%,氯化钠0.5%,pH=7.0 ~7.2。
基础发酵培养基:葡萄糖1. 00%,硫酸铵0.20%,磷酸氢二钾0.30%,MgSO4·7H2O 0.02%,氯化钙0.01%,pH=7.0 ~7.2。
1.3 主要设备
DPN-9162 型电热恒温培养箱,1 000 倍微生物显微镜(徕卡),PHSJ -4A 型pH 计,THZ -C 恒温振荡器,超净工作台(上海博迅实业有限公司医疗设备厂),TU-1810 型紫外可见分光光度计。
1.4 培养方法
菌种活化:将斜面保存的YT3,转接到NA 固体培养基,37 ℃培养24 h。
YT3 的生长曲线测定:挑菌至含10 mL NA 液体培养基的试管中,调pH 值为7.0,37 ℃、200 r/min,摇床培养。分别于2、4、6、8、10、12、14、16、18、20 h取出,放入冰箱4 ℃保存。用未接种的NA 培养液作空白对照,在600 nm 下测定OD 值。
发酵培养:100 mL 三角瓶中装发酵培养基50 mL,接种量5%(接种量试验除外),37 ℃、200 r/min振荡培养48 h。
1.5 培养基的优化
采用基础培养基,分别以不同碳源(3%蔗糖、3%葡萄糖、3%乳糖、3%可溶性淀粉和3%玉米淀粉)和不同氮源(1.5%蛋白胨、1.5%牛肉膏、1.5%酵母膏、1.5%硝酸钠、1.5%氯化铵和1.5%尿素)替代培养基中的碳、氮源,其他成分不变,测定活菌数。每处理3 个重复。采用正交表L9(34)安排试验进一步优化培养基配方,明确碳源、氮源、K2HPO4和MgSO4·7H2O 的最佳添加量,每处理3 个重复。以正交试验得出的最优培养基作为基础培养基,通过单因子试验,测定不同温度、起始pH、不同转速和接种量对生长量的影响。
1.6 分析方法
活菌计数采用平板计数法;采用TU -1810 型紫外可见分光光度计测定600 nm 下菌悬液的光密度;pH 的测定采用数字式pH 计。
1.7 统计方法
发酵液中的活菌数及600 nm 下的OD 值的显著性检验采用Excel 2007 和SPSS 软件进行相关分析,结果为3 次重复试验的平均值。
2 结果与分析
2.1 YT3 的生长曲线
从YT3 生长曲线(图1)可以看出,YT3 的生长规律可大体分为3 个阶段,生长延滞期,对数期和稳定期。培养初期,镜检菌体数量较少,随着培养时间的延长,镜检菌体数量快速增加,生长后期,菌体数量趋于平稳。为了揭示YT3 的生长规律,用Logistic生长函数对YT3 的生长进行拟合,其拟合方程的线性相关系数为0.9564,达极显著水平,可见,菌株生长的过程呈不对称的S 曲线形状增长。Logistic 生长函数模型的特征值可反映菌株长过程中的一些特征,根据模型系数求得菌株快速生长开始时间(始盛期,Ta)和结束时间(盛末期,Tb)及最大增长速度出现时间(Tm)[14-15]。可以看出,培养初期(0 ~3 h),YT3 处于延滞生长期,镜检菌体数量较少;菌株快速生长的始盛期和盛末期分别为第3 小时和第12 小时,意味着培养至3 ~12 h 时,YT3 处于对数期,镜检菌体数量急剧增多。12 h 以后,菌体数量趋于平稳。生产中通常选用处于对数生长期(快速增长期)的菌体作为种子,此时的种子既保有旺盛的增殖能力,又达到高浓度,以缩短发酵周期。因此,选定YT3 的适宜种龄是12 h。

图1 假单胞菌YT3 生长曲线的Logistic 模型及其特征值
2.2 发酵培养基的优化
2.2.1 碳源和氮源筛选
在基础发酵培养基中碳源分别用3%蔗糖、3%葡萄糖、3%乳糖、3%可溶性淀粉和3%玉米淀粉代替,制成培养基后,调pH 值7.0。接种5%种子液,37 ℃、200 r/min,摇床24 h,测定发酵液中的活菌数(表1)。可以看出,同其他碳源相比,乳糖作为碳源的活菌数显著高于其他碳源,蔗糖次之。

表1 不同碳源对YT3 生长量的影响
将基础发酵培养基中的氮源分别用1.5%蛋白胨、1.5%牛肉膏、1.5%酵母膏、1.5%硝酸钠、1.5%氯化铵和1.5%尿素代替,基本培养条件同上,测发酵液中的活菌数(表2)。可以看出,蛋白胨作为氮源的活菌数显著高于其他氮源,这说明蛋白胨是最适氮源。

表2 不同氮源对YT3 生长量的影响
2.2.2 正交试验结果
在确定了碳源和氮源种类的基础上,为进一步优化培养基配方,培养基本条件不变,以乳糖、蛋白胨、K2HPO4、MgSO4·7H2O 作为培养基的因素,每个因素取3 个水平,设计L9(34)的正交试验(表3)。不同试验处理中培养基的活菌数分别为29. 5 ×108、39.5 ×108、40.0 ×108、16.5 ×108、45.5 ×108、51.5 ×108、14.5 ×108、25.0 ×108、28.0 ×108CFU/mL。通过表4中的R 值可以看出,影响YT3 活菌数的主要因素是蛋白胨,其次为乳糖,K2HPO4和Mg-SO4·7H2O 影响较小。不同试验处理的活菌数差异达显著水平,假单胞菌YT3 发酵的适宜条件为乳糖2. 00%,蛋 白 胨2. 00%,K2HPO40. 15%,Mg-SO4·7H2O 0.02%,CaCl20.01%。在此培养基条件下,YT3 菌株的最高活菌数可达51.5 ×108CFU/mL,显著高于其他试验处理。

表3 不同因素配比对YT3 菌落影响的正交设计 %
2.3 发酵条件优化
温度对生长量的影响:摇床温度分别设为20、25、30、34、37、40 ℃,将培养基的初始pH 调至7.0,200 r/min 摇瓶培养24 h,测定其600 nm 时的OD值。由表5可知,温度对YT3 的菌浓度有着显著影响。随着温度的增加,YT3 的菌浓度先增加后减少,在34 ℃时OD 值最大,菌液浓度最高。

表4 不同因素配比对YT3 菌落影响的正交试验极差分析CFU·mL -1

表5 不同温度对生长量的影响
起始pH 值对生长量的影响:由于摇瓶发酵过程中pH 难以控制,因此只能控制发酵液的初始pH。将培养基的初始pH 分别调至5.5、6.0、6.5、7.0、7.2、7.5、7.8,于37 ℃,200 r/min 摇瓶培养24 h,用分光光度计测定其OD600值(表6)。结果表明,pH 对菌液浓度影响显著,同温度影响基本一致,随着pH 值的增加,YT3 的菌浓度先增加后减少,pH值6.5 时,OD 值显著高于其他处理。

表6 不同pH 对生长量的影响
转速对生长量的影响:YT3 发酵是需氧性发酵过程,通过改变摇床转速来调节通气量。转速太小,通气量小,不利于菌体生长;但转速太大,可能会引起菌体自溶,使生物量减少。摇床转速分别设为150、180、200、220、250 r/min,分别测定不同转速对发酵液活菌数的影响,发酵液初始pH 调至7.0,摇床温度37 ℃,摇瓶培养24 h,用分光光度计在600 nm 测定OD 值(表7)。可以看出,转速同样对YT3菌液浓度影有较大影响,转速为180 r/min 时,OD值最大。当转速低于或高于180 r/min 时,均会导致OD 值的显著下降。
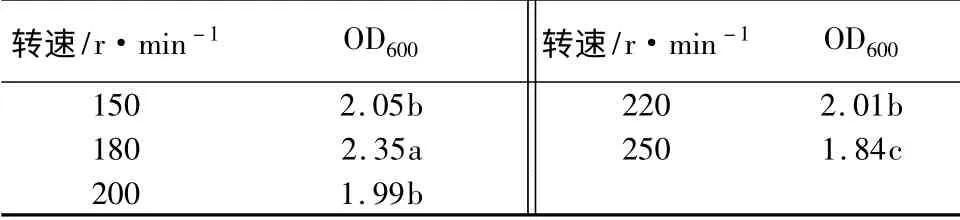
表7 不同转速对生长量的影响
接种量对生长量的影响:在37 ℃,初始pH 值7.0,转速200 r/min 条件下,接种量分别采用1%、3%、5%、7%、9%、11%、13%,用分光光度计在600 nm 测定OD 值(表8)。可以看出,在接种量浓度较低时,菌液浓度随着接种量的增加逐渐增加。方差分析结果显示,当接种量浓度达到9%时,OD 值基本达最大。接种量浓度增加到11%时,OD 值虽然有所增加,但差异不显著。当接种量浓度为13%时开始显著降低。

表8 接种量对生长量的影响
3 结论与讨论
大量研究表明,细菌发酵液中的活菌数主要受发酵培养基成分和发酵条件(温度、pH、接种量和摇床转速等)的影响[13,16-17]。植物根际促生细菌对植物生长具有一定的刺激作用[1-5]。假单胞菌YT3是山东省林科院和山东农业大学从樱桃根际土壤中筛选出的一株植物根际促生细菌,细菌发酵液可产反式玉米素、激动素和吲哚乙酸等不同的植物激素,在生物有机肥的生产与研制过程中具有较大的应用潜力。本研究首次对樱桃根际促生细菌YT3 的培养基及发酵条件优化进行了研究。结果证实不同的发酵培养条件均会影响到细菌发酵液中的活菌数量,这与大量的研究结果相吻合[13,17]。通过单因子试验最终确定最佳培养条件为培养基温度34 ℃,初始pH 值6.5,摇床转速180 r/min,接种量9%。此外,同前人对不同菌株的发酵条件和培养基成分相比较[9-11],不同种类菌株之间差异很大。
细菌培养中,碳源和氮源的种类对细菌生长有着很大影响,这与文献报道的观点相一致[17-18]。YT3 的最佳碳源和氮源分别为乳糖和蛋白胨。同样,碳源和氮源含量对细菌发酵液中的菌液浓度影响很大。过多的速效碳源会加速菌体呼吸,消耗过多氧气而不利于菌体生长,使菌体代谢过快,导致细菌后续生长缺乏营养[18]。研究表明,氮源对次级代谢产物的产生有极显著作用,氮源不足,影响菌体生长[18]。通过正交试验,确定YT3 发酵培养基配方为乳糖和蛋白胨以2%为宜。相对于碳源和氮源而言,MgSO4·7H2O 和CaCl2对发酵产物中活菌数影响较小,其适宜添加比例为MgSO4·7H2O 0.02%和CaCl20.01%。
细菌发酵液中活菌数的高低是研制生物有机肥的关键因素。在适宜条件下,YT3 菌株的最高活菌数可达51.5 ×108CFU/mL,从而确定YT3 完全可用于生物肥料的生产。在有机载体中仅吸附0.5%的YT3 发酵液即可达到生物有机肥的行业标准[10]。因此,即使有机物料的吸水能力较差,也可以作为YT3的吸附载体使用。实际生产中,发酵条件的选择除了考虑有效活菌数的数量以外,还要综合实际生产中能耗、材料消耗量、机器磨损量等方面的考虑。
[1] Verma J P,Yadav J,Tiwari K N,et al. Impact of plant growth promoting rhizobacteria on crop production[J]. International Journal of Agricultural Research,2010,5(11):954 -983.
[2] Abbasi M K,Sharif S,Kazmi M,et al. Isolation of plant growth promoting rhizobacteria from wheat rhizosphere and their effect on improving growth,yield and nutrient uptake of plants[J]. Plant Biosystems,2011,145(1):159 -168.
[3] 康贻军,程洁,梅丽娟,等.植物根际促生菌作用机制研究进展[J].应用生态学报,2010,21(1):232 -238.
[4] Egamberdiyeva D. The effect of plant growth promoting bacteria on growth and nutrient uptake of maize in two different soils[J]. Appl Soil Ecol,2007,36:184 -189.
[5] Karakurt H,Kotan R. Effects of plant growth promoting rhizobacteria on fruit set,pomological and chemical characteristics,color values,and vegetative growth of sour cherry (Prunus cerasus cv.Kütahya)[J]. Turk J Biol,2011,35(3):283 -291.
[6] 张伟琼,聂明,肖明.荧光假单胞菌生防机理的研究进展[J].生物学杂志,2007,24(3):9 -11,24.
[7] Weyens N,van der Lelie,Taghavi S,et al. Exploiting plant-microbe partnerships to improve biomass production and remediation[J]. Trends in Biotechnology,2009,27(10):591 -598.
[8] 农业部微生物肥料和食用菌菌种质量监督检验测试中心,中国农业科学院农业资源与农业区划研究所.NY 884 -2012 生物有机肥[S].北京:中国农业出版社,2012.
[9] 雷娟,段静波,马寒,等. 一株抗青枯假单胞菌放线菌的筛选、鉴定及发酵条件优化[J].应用与环境生物学报,2010,16(1):79 -83.
[10] 韩丽,常建民,张柏林,等.白桦木材蓝变生防菌(Bacillus subtilis)B26 液体发酵条件的优化[J]. 东北林业大学学报,2011,39(12):71 -73.
[11] 郑艳,匡立学,李超,等. 洋葱假单胞菌乳糖酸发酵条件的优化[J].食品科学,2012,33(11):181 -183.
[12] 刘方春,邢尚军,马海林,等.PGPR 生物肥对甜樱桃(Cerasus pseudocerasus)根际土壤生物学特征的影响[J]. 应用与环境生物学报,2012,18(5):722 -727.
[13] 马海林,杜秉海,邢尚军,等. 一株樱桃根际促生假单胞菌及其应用:中国,201110376284.0[P].2012 -03 -28.
[14] 崔党群.Logistic 曲线方程的解析与拟合优度测验[J].数理统计与管理,2005,24(1):112 -115.
[15] Wang Chengyu,Gao Yun,Wang Xuewen,et al. Dynamical properties of a logistic growth model with cross-correlated noises[J].Physica A:Statistical Mechanics and Its Applications,2011,390(1):1 -7.
[16] 吕凤霞,陆兆新,别小妹,等. Bacillus subtilis γ-DES36 纤溶酶发酵条件的优化研究[J].农业工程学报,2005,21(12):175-178.
[17] 刘雪,叶婧,穆长青,等.枯草芽孢杆菌B -332 菌株发酵条件的研究[J].中国农学通报,2012,28(10):230 -235.
[18] 候美玲,辛媛媛,郝志敏,等. 玉米内生细菌YY1 菌株高产抗菌物质的发酵条件优化[J]. 玉米科学,2012,20(3):142 -147.

