上海市食源性金黄色葡萄球菌分布状况
李自然, 施春雷, 宋明辉, 史贤明*
(上海交通大学农业与生物学院,中美食品安全联合研究中心,陆伯勋食品安全研究中心,上海 200240)
上海市食源性金黄色葡萄球菌分布状况
李自然, 施春雷, 宋明辉, 史贤明*
(上海交通大学农业与生物学院,中美食品安全联合研究中心,陆伯勋食品安全研究中心,上海 200240)
采集上海市食品样品(生牛乳、生鲜肉、水产品、速冻食品、果蔬、豆制品)505份,按国标GB 4789.10ü 2010《金黄色葡萄球菌检验》方法进行金黄色葡萄球菌的分离和鉴定,并利用PCR技术进行进一步验证。结果表明:505份食品样品中有117份检出了金黄色葡萄球菌,总检出率为23.2%,其中生鲜肉检出率最高,为32.9%;其次为生牛乳和速冻食品,分别为26.3%和26.7%;其他食品中金黄色葡萄球菌的检出率相对较低。该实验结果基本上反映了上海市各类食品中金黄色葡萄球菌的分布状况,为监控金黄色葡萄球菌引起的食物中毒及追溯污染源提供参考。
金黄色葡萄球菌;分离鉴定;食品;多聚酶链式反应
金黄色葡萄球菌是重要的食源性及医源性致病菌,广泛存在于自然环境中,它产生的肠毒素是引起食物中毒的主要致病因子,金黄色葡萄球菌引起的食物中毒是世界性的公共卫生问题[1]。由于金黄色葡萄球菌对各种理化因素都有较强的抵抗力,且易污染肉类、乳品等食品,所以无论在发达国家还是在发展中国家,由金黄色葡萄球菌引起的食物中毒在细菌性食物中毒中均占较大比例[2]。在我国,20%~25%的细菌性食物中毒事件是由金黄色葡萄球菌引起的,成为仅次于沙门氏菌和副溶血弧菌的第三大致病菌[3],已引起我国卫生防疫和进出口检验等部门的广泛重视。
为了有效防控金黄色葡萄球菌的污染,首先需要调查了解各类食品中金黄色葡萄球菌的分布规律,为此,本研究从上海市采集各类食品样品,用国标GB 4789.10ü 2010《金黄色葡萄球菌检验》从中分离金黄色葡萄球菌,并利用PCR方法对其进行进一步鉴定,以了解该菌在食品中的分布情况,从而为监控金黄色葡萄球菌引起的食物中毒及追溯污染源提供依据。
1 材料与方法
1.1 材料与试剂
2010年8月到2011年1月共采集食品样品505份,其中生牛乳240份,采自上海市郊奶牛场,其余265份样品(包括生鲜肉70份、速冻食品45份、水产品25份、果蔬80份、豆制品45份)采自上海市各个超市及农贸市场。
无菌脱纤维羊血 上海康润生物科技有限公司;新鲜兔血浆 广州蕊特生物科技有限公司;革兰氏染液本实验室自制;nuc1引物 生工生物工程(上海)股份有限公司合成;Taq酶、dNTPs 天根生化科技(北京)有限公司。
1.2 仪器与设备
CX31RTSF型光学显微镜 日本Olympus公司;恒温混匀器、AG 2231 Hamburg型PCR仪 德国Eppendorf公司;DYCP-33A型电泳槽 北京市六一仪器厂;EPS 2A 200型电泳仪 美国Harvard Hoefer公司;GIS 2020型凝胶成像系统 厦门亿辰科技有限公司。
1.3 培养基
7.5%氯化钠肉汤、血琼脂平板、Baird-Parker琼脂平板、脑心浸出液肉汤(BHI)、TSB固体培养基,均为本实验室自制。
1.4 标准菌株
金黄色葡萄球菌ATCC6538,购自中国普通微生物菌种保藏中心。
1.5 金黄色葡萄球菌的分离及鉴定
1.5.1 前增菌
按照GB4789.10ü2010方法进行,称取25g样品至盛有225mL 7.5%氯化钠肉汤的无菌均质袋中,用拍击式均质器拍打1~2min;若样品为液态,吸取25mL样品至盛有225mL 7.5%氯化钠肉汤的无菌锥形瓶中,振荡混匀。将上述样品匀液于(36f1)℃培养18~24h,金黄色葡萄球菌在7.5%氯化钠肉汤中呈混浊生长。
1.5.2 分离培养
将上述培养物分别划线接种到 Baird-Parker平板和血平板,血平板(36f1)℃培养18~24h,Baird-Parker平板(36f1)℃培养18~24h或45~48h。金黄色葡萄球菌在Baird-Parker平板上,菌落直径为2~3mm,颜色呈灰色到黑色,边缘为淡色,周围为一混浊带,在其外层有一透明圈;在血平板上,形成菌落较大,圆形、光滑凸起、湿润、金黄色(有时为白色),菌落周围可见完全透明溶血圈。挑取上述菌落进行革兰氏染色镜检及血浆凝固酶实验。
1.5.3 鉴定
染色镜检:金黄色葡萄球菌为革兰氏阳性球菌,排列呈葡萄球状,无芽孢,直径约为0.5~1μm。
血浆凝固酶实验:挑取Baird-Parker平板或血平板上可疑菌落1个或以上,分别接种到5mL BHI和营养琼脂小斜面,(36f1)℃培养18~24h。取新鲜配制兔血浆0.5mL,放入小试管中,再加入BHI培养物0.2~0.3mL,振荡摇匀,置(36f1)℃温箱或水浴箱内,每30min观察1次,观察6h,如呈现凝固(即将试管倾斜或倒置时,呈现凝块)或凝固体积大于原体积的一半,被判定为阳性结果。同时以血浆凝固酶实验阳性和阴性葡萄球菌菌株的肉汤培养物作为对照。结果如可疑,挑取营养琼脂小斜面的菌落到5mL BHI,(36f1)℃培养18~48h,重复上述实验。
1.6 PCR方法验证
由于一些非金黄色葡萄球菌菌株可能会产生活性很高的假凝固酶,产生凝血现象,从而导致假阳性[4],所以本研究采用PCR技术扩增耐热核酸酶基因(nuc1[5])的方法对疑似菌株进行进一步验证,以减少假阳性。nuc1基因编码的耐热核酸酶具有较高的保守性[6],且为金黄色葡萄球菌所特有[7]。引物nuc1由生工生物工程(上海)股份有限公司合成,引物序列(5’→3’)上游:AGTATATAGTGCAACTTCAACTAA;下游:ATCAGCGTTGTCTTCGCTCCAAAT。
PCR反应体系为20µL,包括缓冲液2µL、引物(上下游)0.8µL、dNTP 0.8µL、Taq DNA聚合酶(天根2.5U/µL)0.4µL、Mg2+1.3µL、ddH2O 13.7µL、DNA模板1µL;循环参数设置为94℃预变性5min,94℃变性30s、55℃复性30s、72℃延伸30s,共35个循环,最后72℃延伸10min。PCR产物进行1.5%琼脂糖凝胶电泳,溴化乙啶(EB)染色,凝胶成像分析仪中观察扩增结果。
2 结果与分析
2.1 金黄色葡萄球菌的分离及鉴定
金黄色葡萄球菌在 Baird-Parker平板上,颜色呈灰色到黑色,边缘为淡色,周围为一混浊带,在其外层有一透明圈。用接种针接触菌落有似奶油至树胶样的硬度[8]。本实验中有一些菌落周围没有混浊圈,尤其是肉中分离的菌株,这与Capita等[9]的报道相符。
疑似分离株镜检结果为:革兰氏染色阳性,呈单个短链或葡萄串状排列,无鞭毛、无芽孢,符合金黄色葡萄球菌菌落的典型性状。
在血平板上,形成的菌落较大,圆形、光滑凸起、金黄色(有时为白色),菌落周围可见完全透明溶血圈。本实验中大部分为白色菌落,少数为金黄色,且不同菌株的溶血圈大小不同,这与其溶血能力有关,同时受血平板质量的影响也很大。将相同的菌株接种于不同批次的血平板上,其溶血圈的大小不同。此外,通过实验还发现血平板的厚度也是一个影响因素,厚度薄的平板的溶血带更清晰[10]。所以本实验以标准菌株ATCC6538接种血平板做为阳性对照,以减少因血平板质量问题而出现漏检情况。
在血浆凝固酶实验中,根据国标规定,将试管倾斜或倒置时,呈现凝块或凝固体积大于原体积的一半,被判定为阳性结果。本实验中,有些菌株凝固的牢固,有些出现半凝现象,具有一定的流动性,难以进行准确判断。为减少假阳性,需对可疑菌株进行PCR鉴定。
图1为部分金黄色葡萄球菌菌株的PCR鉴定结果,生化反应呈阳性的菌株中,有2株(来源于蔬菜)没有出现阳性扩增,被证实为非金黄色葡萄球菌,其余分离株均扩增出nuc1特异性目的片段。可见,不能仅凭借血浆凝固酶实验来鉴定金黄色葡萄球菌,否则可能会出现假阳性。
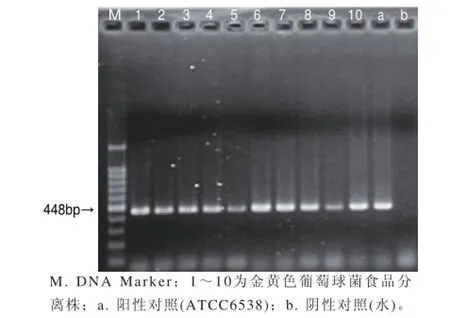
图 1 金黄色葡萄球菌的PCR鉴定结果Fig.1 Identif i cation of S. aureus by PCR
2.2 金黄色葡萄球菌在各类食品样品中的污染状况
经过前增菌,选择性培养基(Baird-Parker培养基、血琼脂平板)分离培养、革兰氏染色、血浆凝固酶实验以及PCR鉴定nuc1基因后,505份食品样品中共有117份检出金黄色葡萄球菌,检出率为23.2%。各类食品中金黄色葡萄球菌检出结果见表1。
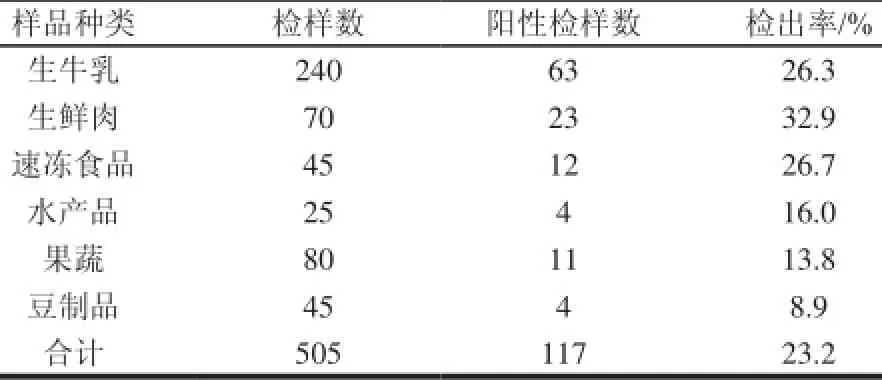
表 1 6类食品样品中金黄色葡萄球菌的检出结果Table 1 Results of detection of Staphylococcus aureus in six food samples
2.2.1 生牛乳的污染状况
由表1可见,240份生牛乳样品(均采自上海市郊奶牛场,于不同时间采集不同奶牛而得)中有63份检出金黄色葡萄球菌,检出率为26.3%,与文献[11]报道的我国生牛乳中金黄色葡萄球菌的检出率为15%~38%相符。生牛乳中金黄色葡萄球菌的检出率之所以高,原因是很多奶牛患有隐性乳房炎。有报道[12]称我国奶牛隐性乳房炎的阳性率在46.4%~85.7%之间,而金黄色葡萄球菌又是引起乳房炎的重要病原菌[13];此外,挤奶时消毒不彻底造成的二次污染也是造成高检出率的原因之一。
2.2.2 生鲜肉的污染状况
由表1可见,70份生鲜肉样品中,有23份检出金黄色葡萄球菌,检出率为32.9%。70份样品中有40份来自农贸市场,10份呈阳性,检出率为25.0%;30份来自超市,13份呈阳性,检出率为43.3%,卫生条件较差的农贸市场的检出率显著低于超市的检出率,这与索玉娟等[14]的研究结果相同。分析原因可能是由于农贸市场杂菌较多,金黄色葡萄球菌的生长受到了抑制,还有待于进一步的分析。
2.2.3 速冻食品的污染状况
由表1可见,45份速冻食品中,有12份检出金黄色葡萄球菌,检出率为26.7%。一般认为金黄色葡萄球菌受冷冻的影响,会产生亚致死性损伤,从而影响其存活与检出[15]。然而,也有报道[16]称金黄色葡萄球菌在冰棍中可存活2a以上,在模拟冰淇淋中可存活7a之久。可见金黄色葡萄球菌一旦污染速冻食品,便有可能长时间存活,从而导致食源性疾病的发生。
2.2.4 其他种类食品的污染状况
水产品中金黄色葡萄球菌的检出率为16%(4/25),检出的4份样品分别为对虾、带鱼、鲫鱼和扇贝。
豆制品中金黄色葡萄球菌的检出率为8.9%(4/45),检出的4份样品分别为豆皮、绿豆糕、素鸡和腐竹。
果蔬产品中金黄色葡萄球菌的检出率为13.8%(11/80),这些样品大部分采自农贸市场及超市,接触人手的机会比较多;有些水果采自路边水果摊,容易受灰尘污染,这些都可能是造成金黄色葡萄球菌检出率较高的原因[11]。
综上所述,生鲜肉检出率最高,为32.9%;其次为速冻食品和生牛乳,分别为26.7%和26.3%;水产品、果蔬以及豆制品检出率较低,分别为16.0%、13.8%和8.9%。
3 讨 论
金黄色葡萄球菌作为一种常见的食源性致病菌,按国标规定,在食品中不得检出,但本实验中多种食品检出金黄色葡萄球菌,且检出率相对较高。此外,金黄色葡萄球菌肠毒素是造成金黄色葡萄球菌食物中毒的重要致病因子,最近研究表明,金黄色葡萄球菌肠毒素的类型有21种[17],而且携带率很高,存在一定的安全隐患,不容忽视,我们应采取防范措施,将食品安全风险降至最低。
食品污染金黄色葡萄球菌的途径很多,如食品加工人员个人卫生不合格或操作不当而污染食品;包装不严,运输过程中受到污染等。有些食品要引起特别注意,如生鲜肉及速冻食品,其检出率比较高,特别是速度食品,一旦污染有可能长期存活。为此,做好防范措施就显得尤为重要,如加工过程中注意个人卫生,戴消毒口罩、一次性手套;减少流通领域的污染;食物尽量煮熟吃等。
本实验中生牛乳样品量较大,可将除生牛乳以外的其他样品作为一个整体,同其进行比较。240份生牛乳样品中,有63份检出金黄色葡萄球菌,检出率为26.3%;其他265份样品有54份检出金黄色葡萄球菌,检出率为20.4%,与生牛乳样品中金黄色葡萄球菌的检出率没有显著性差异。
果蔬、豆制品和水产品的检出率虽然较低,但这些一般被认为是较卫生的食品,也能检出金黄色葡萄球菌,应当引起我们的注意,否则会导致食源性疾病的发生。
[1] le-LOIR Y, BARON F, GAUTIER M. Staphylococcus aureus and food poisoning[J]. Genetics and Molecular Research, 2003, 2(1): 63-76.
[2] FISCHER A, FRANCOIS P, HOLTFRETER S, et al. Development and evaluation of a rapid strategy to determine enterotoxin gene content in Staphylococcus aureus[J]. Journal of Microbiological Methods, 2009, 77(2): 184-190.
[3] 高涛. 食品中金黄色葡萄球菌肠毒素及检测方法的研究进展[J]. 福建分析测试, 2003, 12(2): 1775-1781.
[4] PETER H, SNEATH A, NICHOLAS S, et al. Bergey’s manual of systematic bacteriology[M]. USA: Willizms, 1986: 1018.
[5] 唐俊妮, 周锐, 史贤明, 等. 金黄色葡萄球菌核酸酶基因缺失突变株RN4220Δnuc1的构建[J]. 中国生物工程杂志, 2008, 28(11): 43-47.
[6] BRAKSTAD O G. Detection of Staphylococcus sureus by polymerase chain reaction amplif i cation of the nuc gene[J]. J Clin Microbiol, 1992, 30(7): 1654-1660.
[7] BRAKSTAD O G, MAELAND J A. Generation and characterization of moloclonal antibodies against Staphylococcus aureus[J]. Acta Pathol Microbiol Immunoi Seand, 1989, 92(2): 166.
[8] 食品安全国家标准评审委员会. GB4789.10ü2010 食品安全国家标准[S]. 北京: 中华人民共和国卫生部, 2010.
[9] CAPITA R, ALONSO-CALLEJA C, GARCIA-FERNANDEZ M C, et al. Characterization of Staphylococcus aureus isolated from poultry meat in Spain[J]. Poultry Science, 2002, 81: 414-421.
[10] 雷云瑞, 柴文平, 解立满, 等. 廊坊市食品中金黄色葡萄球菌的检测及污染状况分析[J]. 食品与发酵科技, 2009, 46(1): 100-104.
[11] 杨红, 刘桂华, 龚云伟, 等. 食品中金黄色葡萄球菌的污染状况及检测方法[J]. 中国卫生工程学, 2006, 5(2): 107-108.
[12] 周利青. 奶牛乳房炎的研究进展[J]. 畜牧兽医科技信息, 2005(5): 8-9.
[13] MINOR T E. Staphylococcus aureus and staphylococal food intoxication, a review Ⅲ. staphylococci in dairy foods[J]. J Milk Food Technol, 1972, 35(2): 77-82.
[14] 索玉娟, 于宏伟, 凌巍, 等. 食品中金黄色葡萄球菌污染状况研究[J].中国食品学报, 2008, 8(3): 88-93.
[15] 孟昭赫. 食品卫生检验方法注解微生物学部分[M]. 北京: 人民卫生出版社, 1990: 860-865.
[16] 徐景野, 傅小红, 张思敏, 等. 冷冻状态下微生态中金黄色葡萄球菌的存活极限观察[J]. 中国医学检验杂志, 2002, 2(2): 107-108.
[17] MARIA-ANGELES A, MARIA-CARMEN M, MARIA-ROSARIO R. Food poisoning and Staphylococcus aureus enterotoxins[J]. Toxins, 2010, 2: 1751-1773.
Distribution Status of Food-borne Staphylococcus aureus in Shanghai
LI Zi-ran,SHI Chun-lei,SONG Ming-hui,SHI Xian-ming*
(MOST-USDA Joint Research Center for Food Safety, BorS. Luh Food Safety Research Center, School of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240, China)
In this study, Staphylococcus aureus was isolated and identif i ed from 505 food samples (including raw milk, raw meat, fruits, vegetables, aquatic products, frozen foods and soybean products) collected in Shanghai according to GB4789.10ü2010. In addition, PCR was performed for further conf i rmation. Staphylococcus aureus was detected in 117 food samples, with a total detection rate of 23.2%. The highest detection rate (32.9%) of Staphylococcus aureus in raw meat was found followed by frozen foods (26.7%) and raw milk (26.3%). In addition, the detection rates of Staphylococcus aureus in fruits and vegetables, aquatic products and soy products were lower than 16%. These results revealed the basic distribution status of Staphylococcus aureus in some types of foods in Shanghai, which may provide clues for monitoring Staphylococcus aureus in food processing, controlling food poisoning and tracing pollution sources.
Staphylococcus aureus;isolation and identif i cation;food;PCR
TS201.6
A
1002-6630(2013)01-0268-04
2011-11-14
科技部国际合作项目(2011DFA31220);国家863计划项目(SS2012AA101001)
李自然(1985ü),男,硕士研究生,研究方向为食品安全与微生物。E-mail:linature@163.com
*通信作者:史贤明(1961ü),男,教授,博士,研究方向为食品安全。E-mail:xmshi@sjtu.edu.cn

