液相色谱–串联质谱法测定生鲜乳中氯噻嗪残留量
田素润,蒋俊树,丁磊
(安徽国家农业标准化与监测中心,合肥 230051)
利尿剂通常在一些病理状况下用作治疗药物以排出体内流体,其不仅能促使肾脏排泄水和盐,同时也影响肾脏吸收和排泄其它离子如钾、钙、镁等。由于其作用迅速、强大而短暂,被广泛地用于畜禽养殖中治疗严重心、肝、肾性各类水肿,预防急性肾功能衰竭和加速毒物排出。若饲养者未经授权使用或者未遵循使用说明使用,可能导致其通过肉、奶进入消费者体内,危害消费者身体健康。长期食用含有利尿剂残留的食物可能使尿中的盐和电解质过度流失,破坏体内电解质平衡,严重时还会导致心律不齐或心脏衰竭而危及生命。因此有必要监控利尿剂在禽肉和奶中的残留,以免消费者身体健康遭受危害。作为被批准用作奶牛养殖中治疗奶牛乳腺及相关水肿的4种利尿剂之一,氯噻嗪不仅具有利尿作用,而且还具有降压作用。我国农业部规定乳牛使用氯噻嗪的休药期为72 h,但目前还没有规定氯噻嗪的容许量,FDA只有一个临时性的安全水平限,规定氯噻嗪在牛奶中的限量为67 μg/kg。
目前,利尿剂残留的检测主要面向饲料、人及动物尿液、保健食品等,方法有气相色谱法、液相色谱法、气相色谱–质谱法、液相色谱–质谱法[1–9]。液相色谱–串联质谱法以其高灵敏度和可靠的确证性能,正得到越来越广泛的应用。生鲜乳样品含有大量的脂肪和蛋白,基质较为复杂,特别是前处理过程与一般样品差异较大。笔者采用液相色谱–串联质谱法测定生鲜乳中氯噻嗪残留量,为养殖环节利尿剂药物的监控及生鲜乳质量安全提供了技术保障。
1 实验部分
1.1 主要仪器与试剂
液相色谱串联质谱仪:6490 Triple Quad LC–MS/MS型,美国安捷伦公司;
去离子水发生器:Milli–Q型,美国Millipore公司;
离心机:HERMLE Z–323K型,德国Hermle Labortechnik公司;
甲醇、乙腈、乙酸乙酯、甲酸:色谱纯,美国Tedia公司;
乙酸铅、钨酸钠:分析纯,上海国药化学试有限公司;
有机微孔过滤膜:孔径为0.22 μm;
氯噻嗪标准品:纯度为99.0%,美国Sigma公司;
氯噻嗪标准储备液:100 μg/mL,用甲醇配制,于冰箱中–20℃保存。根据需要用流动相将标准储备液稀释成适合浓度的标准工作溶液,现配现用;
实验用水为Milli-Q去离子高纯水。
1.2 样品前处理
取5 mL生鲜乳样品至15 mL离心管中,在4℃以2 000 r/min转速离心10 min,去除上层脂肪。脱脂后的样品转移至50 mL离心管中,加入10 mL乙腈和2 mL 5%乙酸铅溶液涡旋混合沉淀蛋白,在4℃以5 000 r/min离心10 min。取上清液至50 mL离心管中,加入25 mL水饱和的乙酸乙酯,涡旋混合,离心分层,有机相中加入5 mL 10%钨酸钠溶液,涡旋混合,离心分层,有机相在40℃下氮吹至近干,用流动相定容后过有机微孔滤膜,滤液供LC–MS/MS测定。
1.3 仪器工作条件
1.3.1 色谱条件
色谱柱:ZOBRAX SB–C18型(50 mm×2.1 mm, 1.8 μm);流动相:乙腈– 0.1%甲酸溶液(体积比为30∶70),流速为200 μL/min;柱温:30℃;进样量:10 μL。
1.3.2 质谱条件
离子源:电喷雾离子源(ESI);扫描方式:负离子扫描;检测方式:多反应监测(MRM);干燥气温度:350℃;干燥气流速:10 L/min;雾化器压力:2.76×105Pa(40 psi);毛细管电压:4 000 V。
最佳的碰撞电压及定性离子对、定量离子对、保留时间及碰撞能量见表1。
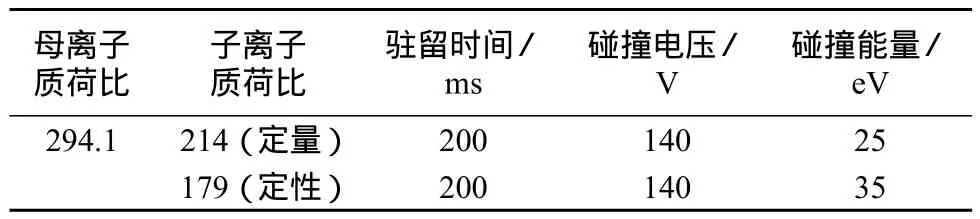
表1 多反应监测模式(MRM)参数
2 结果与讨论
2.1 样品提取、净化条件
生鲜乳中主要含脂肪、蛋白质、氨基酸和碳水化合物等,成分复杂,前处理过程与一般样品差异较大。在进样前需要进行必要的净化处理,否则会干扰电喷雾过程的离子化程度,形成基质效应,从而影响测定结果的灵敏度和准确性。
笔者在参考相关文献[1–9]的基础上,先在4℃下冷冻离心去除上层脂肪,再加入10 mL乙腈和2 mL 5%乙酸铅溶液作为蛋白沉淀剂。选择乙酸乙酯作为提取剂,有机相在40℃下用氮气吹至近干,用流动相定容,过有机微孔滤膜后供液相色谱串联质谱仪分析。
以乙酸乙酯为提取剂进行冷冻离心,能较好地提取氯噻嗪,并去除干扰组分的影响。以空白样品提取液做质谱全扫描,未发现有较大的基质干扰峰,说明本方法无明显基质干扰,分析准确度高。
2.2 色谱、质谱分析条件
由于氯噻嗪中含有多个极性基团,在一些色谱柱中会出现保留时间无规则的漂移。为了得到相对比较稳定的色谱保留时间,考察了Agilent ZOBRAX SB–C18色谱柱,结果发现,氯噻嗪色谱峰形良好。另外,当流动相中添加0.1%的甲酸溶液时,氯噻嗪色谱峰形能得到进一步改善,离子化效率较高。对流动相流速进行考察,结果发现流速为0.2 mL/min时离子化效率最高。
液相色谱以0.2 mL/min的流速将20.0 μg/L的氯噻嗪标准溶液引入离子源,分别在正负离子模式下进行工作,发现该化合物适合负离子模式,这是因为该化合物中含有羧基,更易于失去H+。在ES–条件下一级质谱分析得到[M–H]+分子离子峰,即选取m/z 294.1为分子离子。再以20.0 μg/L的标准溶液对质谱参数进一步优化,以获得最佳的质谱条件。分别在120,130,140,150 eV的碰撞电压下对氯噻嗪的分子离子进行选择性监测,比较不同碰撞电压下分子离子的强度,确定氯噻嗪的最佳解离电压为140 eV。在140 eV的碰撞电压下,对分子离子进行二级质谱分析,比较不同碰撞能量对特征离子的影响,使特征离子强度达到最大,最终确定m/z 179为定性离子,m/z 214为定量离子,优化后的多反应监测条件见表1。
在最佳实验条件下,氯噻嗪的总离子流色谱图、二级质谱图、空白样品总离子流图分别见图1~图3。
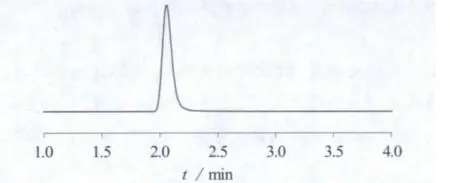
图1 氯噻嗪总离子色谱图

图2 氯噻嗪二级质谱图

图3 空白样品总离子色谱图
2.3 方法的线性范围与定量限
在优化的测定条件下,配制一系列不同浓度的标准溶液进行测定。以目标物定量离子的峰面积(Y)对氯噻嗪浓度(X)绘制标准曲线。结果表明,在5 ~100 μg/L范围内,氯噻嗪的质量浓度和定量离子的峰面积呈良好的线性关系,相关系数为0.999,线性方程为Y=42 394X–34 647,氯噻嗪的定量限(S/N=10)为5 μg/L。
2.4 方法的精密度与回收率
在生鲜乳阴性样品中加入适当浓度的氯噻嗪标准溶液,使加标量相当于10,50,100 μg/kg,涡旋混合。每个添加水平按1.2和1.3的方法重复测定6次。实验测得方法的回收率为86%~105%,相对标准偏差(RSD)为3.8%~7.5%。方法的测量精密度和加标回收率见表2。

表2 氯噻嗪的回收率和相对标准偏差(n=6)
3 结论
用液相色谱–串联质谱法测定生鲜乳中氯噻嗪残留量,对净化方法、色谱质谱条件进行了优化,该方法具有操作简便,定性、定量准确,重复性好和灵敏度高的特点。能满足生鲜乳中氯噻嗪残留量的检测要求,填补了国内检测方法空白,为今后制定相关检验标准提供了参考依据。
[1] 秦呖,朱绍棠,张长久,等.兴奋剂中利尿剂的检测方法[J].分析测试学报,2001,20(2): 82–86.
[2] 李亚伟,周同惠.噻嗪类利尿剂及其甲基化物的质谱研究[J].分析测试学报,2001,20(增刊): 50–51.
[3] 张兰,童萍,何聿,等.毛细管电泳–柱端喷壁式电化学检测法用于利尿剂氢氯噻嗪和氨苯喋啶的研究[J].色谱,2005,3(1): 22–25.
[4] 秦旸,徐友宣,吴侔天,等.液相色谱–质谱法快速筛选人尿中26种利尿剂[J].质谱学报,2007,28(4): 229–232.
[5] 朱永林,贡玉清,邵德佳,等.高效液相色谱–串联质谱法测定动物尿液中8种利尿剂残留量[J].中国兽药杂志,2008,42(9): 6–12.
[6] 刘薇,邱丽君,上官良敏,等.气相色谱–质谱联用技术用于利尿剂的快速初筛和确证[J].分析化学,2008,36(11): 1 465–1 470.
[7] 王培龙,范理,宋荣,等.气相色谱–质谱法确证分析饲料6种利尿剂的研究[J].分析试验室,2009,28(4): 31–34.
[8] 伍丽萍,孙成均,陈聪,等.HPLC–串联四级杆质谱法测定功能食品中的利尿剂[J].华西药学杂志,2009,24(1): 90–92.
[9] 卢明华,李鑫,冯强,等.基于一种新型有机聚合物整体柱的毛细管电色谱技术用于利尿剂的分离与检测[J].色谱,2010,28(3): 253–259.

