大鼠海马神经元TLR4介导的MyD88依赖途径在神经炎症中的作用*
张国霞,周爱玲,张贵萍,胡亚娥,茅家慧
(南通大学医学院病理生理学系,江苏南通226001)
近几年的临床研究和动物实验证据说明了脑内神经炎症与多种急慢性神经退行性疾病如帕金森病(Parkinson’s disease,PD)、阿尔茨海默病(Alzheimer’s disease,AD)和多发性硬化(multiple sclerosis,MS)等的发生和发展有密切联系[1,2]。
神经炎症反应的一个很重要特征是脑内固有免疫细胞尤其是小胶质细胞的激活。持续的小胶质细胞激活会通过释放过量神经毒性的炎症因子如一氧化氮(nitric oxide,NO)、前列腺素 E2(prostaglandin E2,PGE2)、肿瘤坏死因子 (tumor necrosis factor,TNF)、白介素 6(interleukin-6,IL-6)及白介素 1β(in-terleukin-1β,IL-1β)引起神经损伤[3,4]。
Toll样受体4(toll-like receptor 4,TLR4)作为脂多糖 (lipopolysaccharides,LPS)受体在先天免疫中所起的作用最重要。有研究表明AD脑中TLR4表达增多。那么,海马这一与AD密切相关的组织中——海马神经元能否发生炎症反应呢?我们的实验首先研究海马神经元是否有TLR4介导的MyD88依赖途径。在一般炎症细胞中[5,6],TLR4活化后与MyD88结合,依次激活下游信号分子IL-1受体相关激酶(IL-1 receptor associated kinase,IRAK)、肿瘤坏死因子受体相关因子6(TNF-αreceptor associated factor 6,TRAF6);然后,TRAF6激活 NF-κB信号通路[7]:NF-κB一般是由p65和p50亚单位组成的异源二聚体。在未激活状态下,NF-κB与抑制蛋白IκB结合以无活性的形式存在于胞浆。LPS激活TLR4后解除IκB对 NF-κB的抑制作用、促进 NF-κB核易位、激发炎症相关基因的表达,促进IL-1、TNF-α等合成和释放。
本研究采用原代培养的大鼠海马神经元作为研究对象,用TLR4配体LPS或TLR4抗体预处理海马神经元,以激活或阻断TLR4的作用,运用RT-qPCR、免疫荧光及Western blot等技术,探讨海马神经元是否有TLR4介导的的MyD88依赖途径及该途径的激活或阻断后对炎症介质生成的影响。通过研究,期望在理论上为海马神经元TLR4介导的MyD88依赖途径在神经炎症方面的作用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 出生1 d内 SPF级 SD大鼠,由南通大学实验动物中心提供。
1.1.2 试剂与仪器 DMEM/F12培养基和 B27添加剂(Invitrogen),胎牛血清(杭州四季青),多聚赖氨酸、脂多糖、阿糖胞苷、胰蛋白酶(Sigma)。Trizol(Invitrogen)、SYBR Green Master(Rox)(Roche),TLR4 antibody、β-actin antibodies(SANTA CRUZ),MyD88 antibody(CST),TRAF6 antibody(Epitomics),ECL(Millipore),ELISA试剂盒(R&B)。
1.2 原代海马神经元培养及纯度鉴定
无菌操作下取新生1 d内SD乳鼠海马回,放入冰D-Hank’s,在解剖显微镜下剔除脑膜和血管,剪碎组织成约1 mm3,37℃下0.125%胰蛋白酶消化20 min并以巴斯德管吹打数次,用含10%胎牛血清的完全培养基终止消化,经孔径为75μm的尼龙网过滤,离心,弃上清,用含10%胎牛血清的完全培养基吹散细胞,细胞计数板计数,以1×106cells/well种植于多聚赖氨酸包被的六孔板中,置于恒温培养箱内(37℃,5%CO2),24 h后全量换液,72 h后加阿糖胞苷,以后每3天换液一次。培养7 d后采用神经元特异性烯醇化酶(neuron-specific enolase,NSE)和Hoechst的细胞免疫荧光双标方法,对培养的海马神经元进行纯度的鉴定。
1.3 细胞处理
将 LPS按储存浓度(1 mg/ml)溶于基础培养基中,避光存于-20℃,用时基础培养基稀释至终浓度10μg/ml,以不同时间点作用于海马神经元。
1.4 免疫荧光检测NF-κB核易位
将海马神经元以10 000 cells/well每孔的密度种植于放置圆玻片的24孔板内,培养7 d后加入TLR4抗体培养,2 h后加入脂多糖处理。将圆玻片放入PBS中清洗,然后放入4%多聚甲醛室温下固定30 min,PBS清洗三次,每次五分钟,室温下10%山羊血清封闭1 h,甩干后加入兔抗大鼠一抗(NF-κB antibody),37℃,60 min,后 4℃过夜。PBS清洗 3遍后加入羊抗兔荧光二抗室温下避光孵育1 h,甩干后加1%Hochest染核15 min,用超纯水冲洗,加防荧光淬灭剂,倒置显微镜下观察,拍片。
1.5 Real-time PCR检测不同处理组中MyD88和TRAF6的mRNA的表达。
提取各组细胞中的RNA,并进行逆转录为cDNA,按照以下参数进行PCR扩增反应,预变性95℃10 min,变性 95℃ 15 s,退火 60℃ 30 s,延伸 72℃ 30 s,40次循环后再延伸 72℃ 5 min,β-actin作为内参。所用引物序列如下:MyD88基因扩增序列上游引物5′GTGGTGGTTGTTTCTGACGAT 3′,下 游 引 物 5′CGCAGATAGTGATGAACCGTAG3′TRAF6上游引物5′CATTGTGAATTCGCTCTAGTGA3′, 下 游 引 物 5′GGACAGCTTTGATCGTGGA3′,β-actin上 游 引 物 5′CAGGTCATCACTATCGGCAAT 3′,下游引物 5′AGGTCTTTACGGATGTCAACG 3′。
1.6 Western blot检测不同处理组中 MyD88和TRAF6蛋白的表达。
将六孔板中处理好的各组细胞弃培养基,用PBS轻洗,加入蛋白裂解液及蛋白酶抑制剂PMSF,使PMSF的终浓度为1 mmol/L。充分裂解后,将混合液在4℃14 000 r/min离心15 min,取上清测总蛋白浓度。调整各组总蛋白浓度相等(20μg),用10%PAGE胶电泳分离,再转到PVDF膜上。用5%脱脂牛奶封闭1 h,后加一抗4℃过夜。TBST洗三次,加二抗室温1 h,加ECL显影。
1.7 ELISA检测上清中各炎症因子水平变化
将培养的海马神经元分正常对照组、LPS刺激组、TLR4抗体阻断加LPS刺激组,收集细胞培养上清,按ELISA试剂盒说明进行实验,在酶标仪450μm处读取A值,绘制标准曲线,根据标准曲线计算培养上清中TNF-α、IL-1β和 NO蛋白含量。。
1.8 数据处理及统计分析
所有数据均用均数±标准差(¯x±s)表示,用软件 SPSS17.0进行统计分析。
2 结果
2.1 LPS对海马神经元MyD88和TRAF6的表达影响
2.1.1 RT-qPCR 结果显示,正常对照组海马神经元中MyD88和TRAF6 mRNA表达相对较少,LPS刺激4~12 h时,MyD88和TRAF6 mRNA的表达增加,与正常对照组比较,有非常显著的差异(P<0.01),但到24 h时与正常对照组无显著性差异(P>0.05,图 1)。
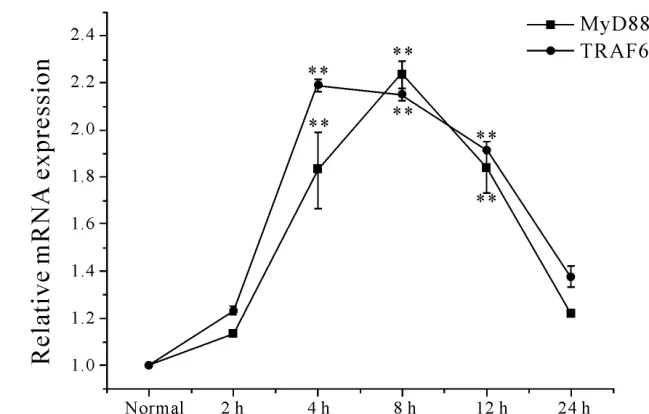
Fig.1 Effect of LPSon MyD88 and TRAF6 mRNA of hippocampal nuerons**P<0.01 vs normal group
2.1.2 Western Blot结果可见,在正常对照组海马神经元中,MyD88和TRAF6蛋白表达相对较少,LPS刺激后,其蛋白水平表达增加。与正常对照组相比,在LPS刺激不同时间点后,MyD88和TRAF6蛋白表达明显上调,有显著或非常显著的统计学差异(P<0.05,P<0.01,图 2)。
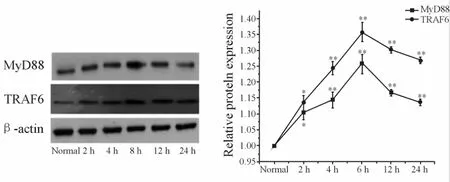
Fig.2 Effects of LPSon MyD88 and TRAF6 protein of hippocampal nuerons MyD88:Myeloid differentiation facfor 88;TRAF6:TNF-αreceptor assoiated factor 6*P<0.05,**P<0.01 vs normal group
2.2 TLR4抗体预处理并LPS刺激的海马神经元MyD88和TRAF6的表达变化
2.2.1 RT-qPCR 结果显示,正常对照组海马神经元中MyD88和TRAF6 mRNA表达相对较少;LPS单一刺激组:经 LPS刺激后,海马神经元 MyD88和TRAF6 mRNA明显高于正常对照组(P<0.01);TLR4抗体阻断联合LPS剌激组:给以TLR4抗体预处理后,再给以与 LPS单一刺激组相同浓度的 LPS刺激海马神经元后,其MyD88和TRAF6 mRNA的表达明显低于 LPS单一刺激组(P<0.05,图3)。

Fig.3 Effect of anti-TLR4 on MyD88 and TRAF6 mRNA in LPS-activated hippocampal nuerons MyD88:Myeloid differentiation facfor 88;TRAF6:TNF-αreceptor assoiated factor 6;LPS:Lipopolysaccharides;TLR4:Toll-like receptor 4**P<0.01 vs normal group;#P<0.05 vs LPSgroup
2.2.2 Western blot结果可见,正常对照组海马神经元中MyD88和TRAF6蛋白表达相对较少;LPS刺激后的海马神经元,MyD88和TRAF6蛋白表达明显高于正常对照组(P<0.01);TLR4抗体阻断联合LPS剌激组:给以TLR4抗体预处理后,再给以与LPS单一刺激组相同浓度的 LPS刺激海马神经元后,其MyD88和TRAF6蛋白的表达明显低于LPS单一刺激组 (P<0.05,P<0.01,图 4)。
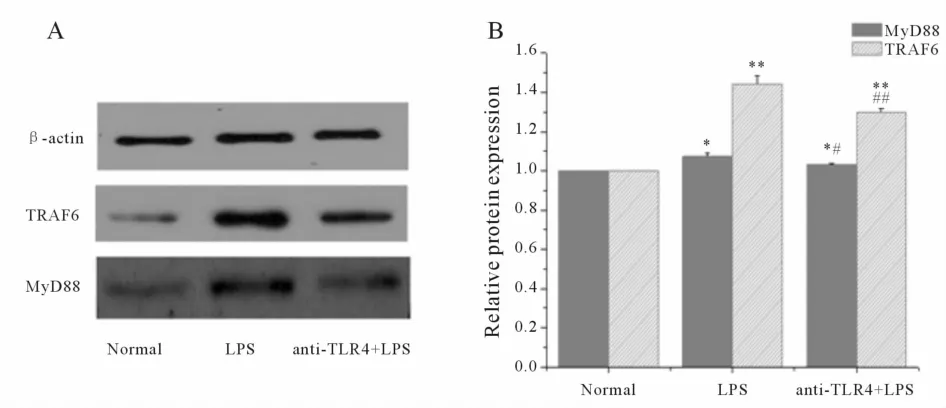
Fig.4 Effects of anti-TLR4 on MyD88 and TRAF6 protein expression in LPS-activated hippocampal nuerons MyD88:Myeloid differentiation facfor 88;TRAF6:TNF-αreceptor assoiated factor 6;LPS:Lipopolysaccharides;TLR4:Toll-like receptor 4*P<0.05,**P<0.01 vs normal group;#P<0.05,##P<0.01 vs LPSgroup
2.3 免疫荧光技术检测海马神经元NF-κB/P65核易位变化
免疫荧光结果显示,在正常对照组海马神经元中,NF-κB/P65主要表达在细胞质(图 5 A~C);LPS刺激后,大多数 NF-κB/P65易位到胞核(图5 E~F);而如果用LTR4抗体预处理培养的海马神经元2h以后,再给以同样浓度的LPS刺激,而LPS引起的NF-κB/P65核易位作用明显减弱(图5 G-I)。

Fig.5 Nuclear translocation of NF-κB/P65 of hippocampal nuerons in rats(Immunofluorescence×200)
2.4 ELISA法检测培养上清中各炎症因子水平
2.4.1 LPS对海马神经元培养上清中 TNF-α、IL-1β和NO的影响 为了探讨LPS对海马神经元炎症性细胞因子产生、释放的影响,分别于 LPS刺激后 2、4、8、12、24 h收集培养上清液,ELISA法测定培养上清中 TNF-α、IL-1β和NO的浓度。与正常对照组相比,在 LPS刺激不同时间点后,其上清中 TNF-α、IL-1β和NO的浓度明显上调,有统计学差异 (P<0.05,P<0.01,图 6)。
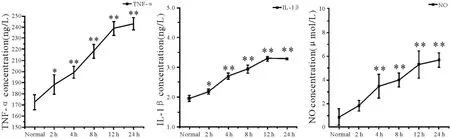
Fig.6 Effects of LPSon TNF-α,IL-1βand NO in culture supernatant LPS:Lipopoly saccharides;TNF-α:Tumor necrosis factor-α;IF-1β:Interleukin-1β;NO:Nitric oxide*P<0.05,**P<0.01 vs normal group
2.4.2 ELISA测定TLR4抗体预处理后LPS对海马神经元培养上清中TNF-α、IL-1β和 NO的影响 结果可见,正常对照组培养上清中炎症因子TNF-α、IL-1β和 NO释放量较少。与正常对照组相比,LPS单一刺激组TNF-α、IL-1β和 NO释放明显增多(P<0.01)。预先用TLR4抗体阻断则明显减弱了由LPS作用而引起的 TNF-α、IL-1β和 NO的释放(P<0.05,P<0.01,图 7)。

Fig.7 Effects of anti-TLR4 on production of TNF-α,IL-1βand NO in LPS-activated hippocampal nuerons in culture supernatant TLR4:Toll-like receptor 4;TNF-α:Tumor necrosis factor-α;IF-1β:Interleukin-1β;NO:Nitric oxide*P<0.05,**P<0.01 vs normal group;#P<0.05,##P<0.01 vs LPSgroup
3 讨论
TLR4是人类发现的第一个TLR相关蛋白,一种模式识别受体,主要识别革兰阴性菌细胞壁成分LPS,本实验采用TLR4和Hoechst的双重免疫荧光标记,鉴定TLR4在海马神经元的定位情况。结果表明,TLR4是一跨膜受体,定位于海马神经元的胞膜
[5]。
MyD88是TLR4信号通路中的一个关键接头分子,在传递上游信息和疾病发生发展中具有重要作用。在抵抗病原体入侵的免疫应答启动过程中TLR4介导的MyD88信号转导通路能调节多种炎症相关基因的表达[8]。
本实验采用RT-qPCR、Western blot法观察海马神经元中 MyD88 mRNA、蛋白的表达。LPS激活TLR4实验,结果可见:正常对照组海马神经元中,MyD88 mRNA和蛋白的表达相对较少,LPS刺激后,MyD88 mRNA和蛋白水平明显高于正常对照组(P<0.05,P<0.01)。TLR4抗体阻断实验,结果可见:给以TLR4抗体预处理后,再给以与LPS单一刺激组相同浓度的LPS刺激,海马神经元MyD88 mRNA、蛋白的表达明显低于 LPS单一刺激组(P<0.05)。结果提示:通过刺激海马神经元TLR4能促进MyD88的表达。
肿瘤坏死因子受体相关因子(tumor necrosis factor receptor associated factors,TRAFs)是肿瘤坏死因子(tumor necrosis factor,TNF)超家族和 Toll样/白细胞介素-1受体(Tool/IL-1 receptor,TIR)超家族重要的接头分子。在MyD88依赖的信号转导途径中,TRAF6是必需的连接分子[9]。
本实验采用RT-qPCR、Western blot法观察海马神经元中 TRAF6 mRNA、蛋白的表达。结果可见:LPS激活海马神经元TLR4后,正常对照组海马神经元中,TRAF6 mRNA和蛋白的表达相对较少,LPS刺激后,TRAF6 mRNA和蛋白水平明显高于正常对照组,(P<0.05,P<0.01)。TLR4抗体阻断实验,结果可见:给以TLR4抗体预处理后,再给以与LPS单一刺激组相同浓度的LPS刺激,海马神经元TRAF6 mRNA、蛋白的表达明显低于LPS单一刺激组(P<0.05)。结果提示:LPS通过激活 TLR4,增加海马神经元中TRAF6的表达。
NF-κB是TLR4的下游分子之一,一般是由p65和p50亚单位组成的异源二聚体。在未激活状态下,NF-κB与抑制蛋白IκB结合以无活性的形式存在于胞浆。有研究表明,在小胶质细胞中,LPS激活TLR4后解除 IκB对 NF-κB的抑制作用、促进 NF-κB核易位、激发炎症相关基因的表达,促进IL-1、TNF-α等合成和释放[7]。
本实验采用LPS刺激海马神经元,利用免疫荧光技术观察NF-κB/p65核易位现象,在正常对照组海马神经元中,NF-κB/p65主要表达在细胞质,LPS刺激后,易位到细胞核;而如果用 TLR4抗体预处理海马神经元后,再以同样剂量的 LPS刺激,则 LPS引起的 NF-κB/p65核易位作用明显减弱。NF-κB/p65的核异位是 NF-κB活化的标志。结果提示,LPS能活化海马神经元 NF-κB,其发挥作用主要是通过核的易位来实现。
现有大量证据说明激活的免疫细胞可产生多种炎症介质如TNF-a、IL-1β和NO等,它们能导致脑内神经元的变性死亡,尤其是致炎细胞因子TNF-α和IL-1β在神经退行性疾病中的作用受到广泛关注
[10]。
本实验采用 ELISA方法测定 LPS刺激海马神经元不同时间后培养上清中 TNF-α、IL-1β和NO的浓度。结果显示,LPS刺激后,海马神经元培养上清中TNF-α、IL-1β和 NO浓度逐渐升高,与正常组相比,LPS刺激 2、4、8、12、24 h组海马神经元培养上清中TNF-α、IL-1β和NO的浓度均显著或非常显著高于正常对照组(P<0.05,P<0.01)。预先用 TLR4抗体处理海马神经元4 h后,再给予同样剂量的LPS刺激,TNF-α、IL-1β和NO浓度显著低于单用 LPS刺激组(P<0.05)。结果提示,LPS可以通过刺激海马神经元 TLR4,增加 TNF-α、IL-1β和 NO的分泌,增强脑内的炎症反应。
由此可见,海马神经元上有 TLR4的介导的MyD88依赖途径,该途径的激活参与了神经炎症反应。通过上述研究,期望在理论上为海马神经元TLR4及其信号通路在神经炎症方面提供更多的实验依据,为神经炎症炎症学说增加新的知识。
[1] Salminen A,Ojala J,Kauppinen A,et al.Inflammation in Alzheimer’s disease:amyloid-beta oligomers trigger innate immunity defence via pattern recognition receptors[J].Prog Neurobiol,2009,87(3):181-194.
[2] Griffin W ST.Inflammation and neurodegenerative diseases[J].Am J Clin Nutr,2006,83(2):S470-474.
[3] Glass CK,Saijo K,Winner B,et al.Mechanisms underlying inflammation in neurodegeneration[J].Cell,2010,140(6):918-934.
[4] Minghetti L.Role of inflammation in neurodegenerative diseases[J].Curr Opi Neurol,2005,18(3):315-321.
[5] Walter S,Letiembre M,Liu Y,et al.Roll of the toll-Like receptor 4 in neuroinflammation in alzheimer’s disease[J].Cell Physiol Biochem,2007,20(6):947-956.
[6] Janssens S,Beyaert R.A universal role for MyD88 in TLR/IL-1R-mediated signaling[J].Trends Bioehem Sci,2002,27(9):474-482.
[7] Lin S T,Wang Y,Xue Y,et al.Tetrandrine suppresses LPS-Induced astrocyte activation via modulating IKKs-Ikappa-Balpha-NF-kappaB signaling pathway[J].Mol and Cell Biochem,2008,315(2):41-50.
[8] Hua F,Ha T,Ma J,et al.Blocking the MyD88-dependent pathway protects the myocardium from ischemia/reperfusion injury in rat hearts[J].Biochem Biophys Res Commun,2005,338(2):1118-1125.
[9] Zapata J M,Lefebvre S,Reed J C.Targeting TRAFs for therapeutic intervention[J].Adv Exp Med Biol,2007,597(3):188-201.
[10] Zeng K W,Fu H,Liu GX,et al.Icariin attenuates lipopolysaccharide-induced microglial activation and resultant death of neuron by inhibiting TAK1/IKK/NF-kappaB and JNK/p38 MAPK pathways[J].Int Immunopharmacol,2010,10(6):668-678.

