狗牙根抗非生物胁迫的研究进展
产祝龙,施海涛,王艳平
(中国科学院植物种质创新与特色农业重点实验室 中国科学院武汉植物园,湖北 武汉 430074)
狗牙根(Cynodondactylon)是一种抗性能力强的暖季型草坪草,属禾本科画眉草亚科狗牙根属多年生草本植物[1]。狗牙根的繁殖速度快,成坪时间短,耐践踏,在生产上被广泛应用[1,2]。狗牙根喜温热气候和潮湿土壤,不耐寒,气候寒冷时生长差,易遭受霜害。在日均温24 ℃以上时,狗牙根生长最好。当日均温下降至6~9 ℃时生长缓慢,开始变黄,当日均温为-2~-3 ℃时,茎叶死亡。狗牙根以根状茎和匍匐茎越冬,翌年则靠越冬部分休眠芽萌发生长[3]。狗牙根原产于非洲,目前主要分布在53° N至45° S之间,海拔为0~3 000 m的世界各大洲热带、亚热带和温带沿海地区。在美国的南部、非洲、欧洲、亚洲南部各国均有分布[4]。在我国主要分布于黄河流域以南,多生长于村庄附近、道旁河岸、荒地山坡及草坡,吉林、青海、甘肃、新疆和西藏等地均有分布,是热带、亚热带地区被广泛应用的暖季型草坪草种之一,也是一种优良的牧草资源[1,3]。狗牙根广泛分布的特性使其成为研究逆境胁迫的好材料。本文对近年来狗牙根对非生物胁迫的抗性方面所取得的研究进展进行综述。
1 非生物胁迫对狗牙根生理生化代谢的影响
1.1冷害胁迫对狗牙根生理生化代谢的影响 狗牙根属植物最大的缺点是抗寒能力差。作为一种暧季型草,狗牙根在南方地区常常表现为绿色期较短,过渡带地区容易受到低温危害而出现大面积死亡,北方地区则不能安全越冬等问题。Emmons[5]发现,低温时狗牙根转入休眠,在15.6 ℃下,一些狗牙根品种开始停止生长,当温度达到10 ℃时叶片开始转黄。温度的降低和光周期的缩短会诱导狗牙根进入休眠状态,长势趋缓[6]。
经过冷害胁迫以后,狗牙根体内发生一系列生理生化的变化,包括细胞膜透性,酶、蛋白质、可溶性糖含量,相关代谢以及超微细胞结构的变化。近年来,越来越多的研究验证了相关化学物质在狗牙根抗冷害过程当中的作用[7]。通过冷害适应性驯化以后,狗牙根抗性品种Riviera和敏感品种Princess-77都积累了大量的蔗糖以及脯氨酸。但是在抗性狗牙根品种Riviera中,总可溶性碳水化合物(TNC)以及蛋白质的积累量明显大于敏感品种Princess-77,表明可溶性碳水化合物以及蛋白质类与狗牙根的抗冷性相关。更多研究结果显示,细胞膜透性、可溶性糖和脯氨酸含量以及抗氧化酶活性的变化影响到狗牙根材料的抗冷害能力[8-9]。人工培养室以及田间试验的结果表明,随着温度的下降和光周期的缩短,狗牙根地上部分鲜质量、干质量、草坪密度、植株高度、叶面积、叶绿素含量以及相对含水量也随之下降,但是根的长度以及根的鲜质量却呈增加趋势,植株的电导率、脯氨酸以及淀粉的含量也随之上升[6]。进一步研究显示,碳水化合物、脱水素蛋白、ABA以及细胞分裂素的积累与狗牙根对冷害的抗性相关[10-11]。这些研究均表明,植物激素在狗牙根对冷害的抗性方面起到一定的作用。ABA已被证明是众多的逆境胁迫中重要的一个植物激素[12-13]。ABA受体的发现[14-15]以及ABA信号传导途径的阐明为研究ABA在冷害以及干旱胁迫中的作用提供了很好的基础。
因此,在冷害条件下,抗性的狗牙根材料细胞膜相对较完整、透性小,不饱和脂肪酸的比重增加、总蛋白质和可溶性糖的含量提高、相关抗氧化酶的活性增强,这些生理生化的变化有利于提高细胞内渗透压、减少膜的损伤、增强对逆境条件下产生的活性氧清除能力、增加保水能力,从而降低因为温度下降而导致细胞内结冰的风险[16-18]。
不同狗牙根材料对冷害的抗性存在着差异。通过比较9种四倍体和两种三倍体狗牙根材料对冷害的抗性发现,TifGreen抗冷性最强,Midiron等抗性较弱[19]。另外突变体的筛选是抗性研究中一个重要的技术手段。Anderson等[20-21]在这方面做出了很好的尝试,他们通过逐渐降温筛选出抗冷性较强的狗牙根品系。具体做法是:将狗牙根在人工气候室里培养4周[温度为白天8 ℃,夜间2 ℃,短日照 (10 h),低光强(300 μmol·m2·s-1)],然后转到低温培养箱过夜(-2 ℃)以适应低温环境。第2天,每隔1 h将培养箱的温度降低1 ℃,通过这种梯度降温,直到达到相应的冻害温度。冷冻后的植株在低温下过夜恢复,再于温室内正常生长。通过计算存活率和半致死温度(LT50)来比较不同狗牙根品种在低温驯化后对冻害的抗性以及低温驯化时间对狗牙根的影响。狗牙根分布广泛,通过相应的筛选和基因工程手段,有望培育出抗寒能力强的材料,扩大其在北方低温地区的种植。
1.2干旱胁迫对狗牙根生理生化代谢的影响 狗牙根对干旱具有很强的抗性,但是不同种、品种的狗牙根在抗旱能力方面存在明显差异。分析抗旱的杂交狗牙根品种Tifway以及普通狗牙根品系C299对干旱胁迫的反应发现,Tifway相对抗旱,表现为相对高的含水量以及相对低的电导率。同时Tifway的光合作用指标,包括Rubisco酶的活性要强于C299[22-25]。另外,通过对三倍体TifEagle的体细胞无性系变异体对干旱胁迫的应答反应分析发现,相关的抗氧化酶(CAT,SOD和APX)活性、脯氨酸含量以及可溶性糖的含量与狗牙根电导率具有明显的相关性[26-27]。本研究团队的干旱筛选结果也表明,不同的狗牙根材料对干旱胁迫的抗性存在明显的差异。抗性品种Tifgreen在干旱胁迫以后,电导率和失水率明显低于相对干旱敏感型品种Yukon,抗氧化酶活性和脯氨酸含量明显高于Yukon。Yukon对干旱敏感可能源于体内过高的活性氧积累[28]。这与前人发现的狗牙根的抗旱性与活性氧代谢以及渗透调节物质的变化相关的结果吻合[29-30]。
脱水素(Dehydrin)是胚胎发育后期的一类丰富蛋白(LEA:Late Embryogenesis Abundant Proteins),含有富含赖氨酸的K片段,属于具有高度热稳定性的亲水性蛋白,在植物脱水条件下能保护细胞内蛋白质和膜结构免受破坏[31]。在正常灌溉条件下,很难检测到狗牙根体内的脱水素蛋白,但干旱处理后,其体内的脱水素蛋白明显增加。其中31-和40-kDa 的脱水素蛋白与狗牙根的抗旱性相关[32]。代谢组学的研究也表明,干旱处理以后,狗牙根体内一种非常见的氨基酸5-hydroxynorvaline含量增加[33],表明这种特殊氨基酸在狗牙根对干旱抗性中起到一定的作用。
目前认为,干旱胁迫对狗牙根生理生化代谢的影响主要表现在,1)叶片相对含水量降低,2)游离脯氨酸含量增加,3)活性氧代谢相关酶活性增加,4)细胞活性氧增加,5)可溶性糖以及可溶性蛋白增加。
1.3渍害胁迫对狗牙根生理生化代谢的影响 三峡库区消涨带内生态系统恢复问题引起越来越多研究者的关注。调查发现,在三峡水库退水后,狗牙根能迅速返青,恢复生长,表现出极强的耐淹能力[34]。可见,狗牙根可能是一种适用于库区消涨带植被恢复的物种[35-38]。
洪明等[39]通过对三峡水库消涨带不同海拔区段狗牙根的种群密度、形态性状和生物量及其分配的研究表明,不同水位区段的狗牙根种群对水陆生境变化具有不同的适应策略。浅水位区段的狗牙根种群表现为加速伸长生长、增加茎生物量分配,深水位区段的策略则是增加分枝节间数量、分枝数量和叶生物量分配,二者共有的适应策略是加速根系生长、增加分蘖数量和地下生物量分配,为在陆地环境中的快速生长提供营养和能量储备。盆栽控水试验发现,狗牙根受到淹水胁迫时叶绿素a、b的含量和光合效率有所下降,丙二醛含量有所升高,但是抗氧化酶活性以及脯氨酸含量的增大提高了植物对淹水胁迫的抵抗力[40]。同时,受淹水胁迫以后,狗牙根体内可溶性糖含量和淀粉含量都保持在较高水平,表明作为禾本科植物,狗牙根具有一定的耐淹性[41]。
有研究团队收集了国内外不同地区的狗牙根材料并鉴定其对水淹胁迫的抗性。初步研究结果表明,来自雨水充足的湿热带地区的材料与干旱半干旱地区的材料相比,在对水淹胁迫的抗性上存在差异(施海涛等,未发表数据)。
1.4盐胁迫对狗牙根生理生化代谢的影响 目前对狗牙根抗盐的研究主要集中在对抗性材料的筛选上。许多暖季型草坪草的抗盐性比冷季型草坪草强,但存在属间及种间的抗盐性差异。与狗牙根对其它胁迫的抗性类似,不同的狗牙根材料对盐胁迫的抗性存在着差异。通过不同浓度梯度的NaCl处理发现,“Tifdwarf”和“Tifgreen”抗性最强,“Common”和“Ormond”抗性较弱[42]。江苏省中国科学院植物研究所草业中心大量收集全国不同地区及部分国外暖季型草坪草资源并对其抗盐性进行了鉴定,发现,与沟叶结缕草(Zoysiamatrella)、海雀稗(Paspalumvaginatum)和钝叶草(Stenotaphrumsecundatum)的抗盐性相比较,狗牙根具有中度的抗盐性[43-45]。Marcum[46]的盐胁迫试验确定了6 种草坪草的抗盐力大小顺序为海滨雀稗(400)>沟叶结缕草(400)>钝叶草(395)>狗牙根(272)>结缕草(130)>假俭草(77)[括号内数字为出现50%地上生物量减少时的盐浓度(mol·L-1)]。周霞等[47]用Hogland营养液培养法,用不同浓度的NaCl营养液对403份狗牙根材料进行耐盐处理30 d,筛选出耐盐种质21份,在此基础上复选出较耐盐种质11份,次耐盐种质10份,这些材料为培育耐盐狗牙根品系提供了优良亲本。Marcum和Pessarakli[48]筛选了35份狗牙根品种对盐胁迫的抗性,发现不同的品种对盐胁迫的抗性差异明显。狗牙根品种对盐胁迫的抗性与狗牙根叶片钠离子的含量呈负相关,与叶片的泌盐效率呈正相关。通过在含盐培养基上诱导三倍体狗牙根TifEagle的愈伤组织,成功筛选了比TifEagle更耐盐的株系。在盐胁迫的条件下,诱导株系比TifEagle具有相对高的水分含量和电导率,部分株系体内的K+/Na+含量高于TifEagle[49]。
2 非生物胁迫对狗牙根分子水平的影响
目前由于狗牙根遗传背景不清楚,对狗牙根分子生物学的研究开展较少。直到2008年,狗牙根基因型T89(PI 290869)的cDNA文库才由美国乔治亚大学Andrew H.Paterson教授课题组完成测序,从9 414个unigene中通过BLASTX鉴定出了6 489个,NCBI的编号为ES291835-ES307422[50]。这些成果为今后从分子水平上研究水分胁迫对狗牙根的影响提供了很好的基础。
2.1冷害胁迫对狗牙根分子水平的影响 根据模式植物基因的序列,谢永丽等[51]从狗牙根材料中克隆到两个DREB基因,分别命名为BeDREB1和BeDREB2。这两个基因的编码框均为753个碱基,编码251个氨基酸,具有DREB转录因子的典型特征。两种逆境胁迫下扩增的基因序列同源性很高,达到了97.8%。酵母单杂交的结果表明,BeDREB1和BeDREB2蛋白均可以与DRE顺式作用元件结合,激活下游报告基因HIS3的表达。相关的表达调控实验结果表明,BeDREB1基因主要是在冷害条件下表达,而BeDREB2主要在盐胁迫的条件下诱导表达,并且表达量的变化与诱导时间有关。上述结果表明,从狗牙根中克隆到的BeDREB1和BeDREB2基因具有DREB转录因子的活性,并且这两个基因参与狗牙根对冷害和盐胁迫的抗性。
2.2干旱胁迫对分子水平的影响 蛋白质组学的研究表明,干旱胁迫以后,在抗旱的杂交狗牙根品种Tifway或普通狗牙根品系C299中,有32个蛋白的表达明显增加,22个蛋白的表达减弱。在Tifway中,更多蛋白的表达量在干旱胁迫以后增加了,其中有16个蛋白只在Tifway中表达量增加。这些蛋白的功能主要涉及到代谢、能量、细胞生长和分化、蛋白质合成以及对胁迫的抗性方面。光合作用相关的蛋白以及与抗氧化相关的蛋白的表达量都在胁迫以后增加[25]。这些结果进一步验证了狗牙根在干旱胁迫以后发生的生理生化的变化。
通过微阵列技术,Kim等[52]鉴定出了189个干旱胁迫以后发生变化的基因。其中120个基因的表达量上调,69个下调。通过BLASTX分析发现,上调的基因当中,功能主要涉及到脯氨酸代谢,信号转导,蛋白质修复和有毒物的清除。而下调的基因主要是一些植物基本代谢相关的,比如说与光合作用以及糖酵解相关。同时证明一些顺式作用元件也在狗牙根的抗旱过程中起一定的作用。
3 存在的问题与发展趋势
综上所述,对于狗牙根抗性的研究主要集中在生理生化方面(图1)。众多的研究结果表明,水分胁迫条件下,狗牙根细胞膜的透性、光合作用速率、抗氧化酶活性、可溶性糖及蛋白质的含量等指标都发生了相应变化。但是这些变化只是狗牙根为了适应环境的变化而做出的生理调整。针对这些变化的上游机理研究不多。作为一种非模式植物,狗牙根在面对不同的非生物逆境时,其信号传导途径是否与模式生物类似(图1),有待于后续的试验进行验证。同时,狗牙根在逆境发生前后,分子水平上的变化目前仍然不清楚,取得的研究成果有限。挖掘相关的抗性基因,尤其是原始的抗性基因,以期通过基因工程的手段来提高狗牙根对不同逆境的抗性,是一项迫切的任务。
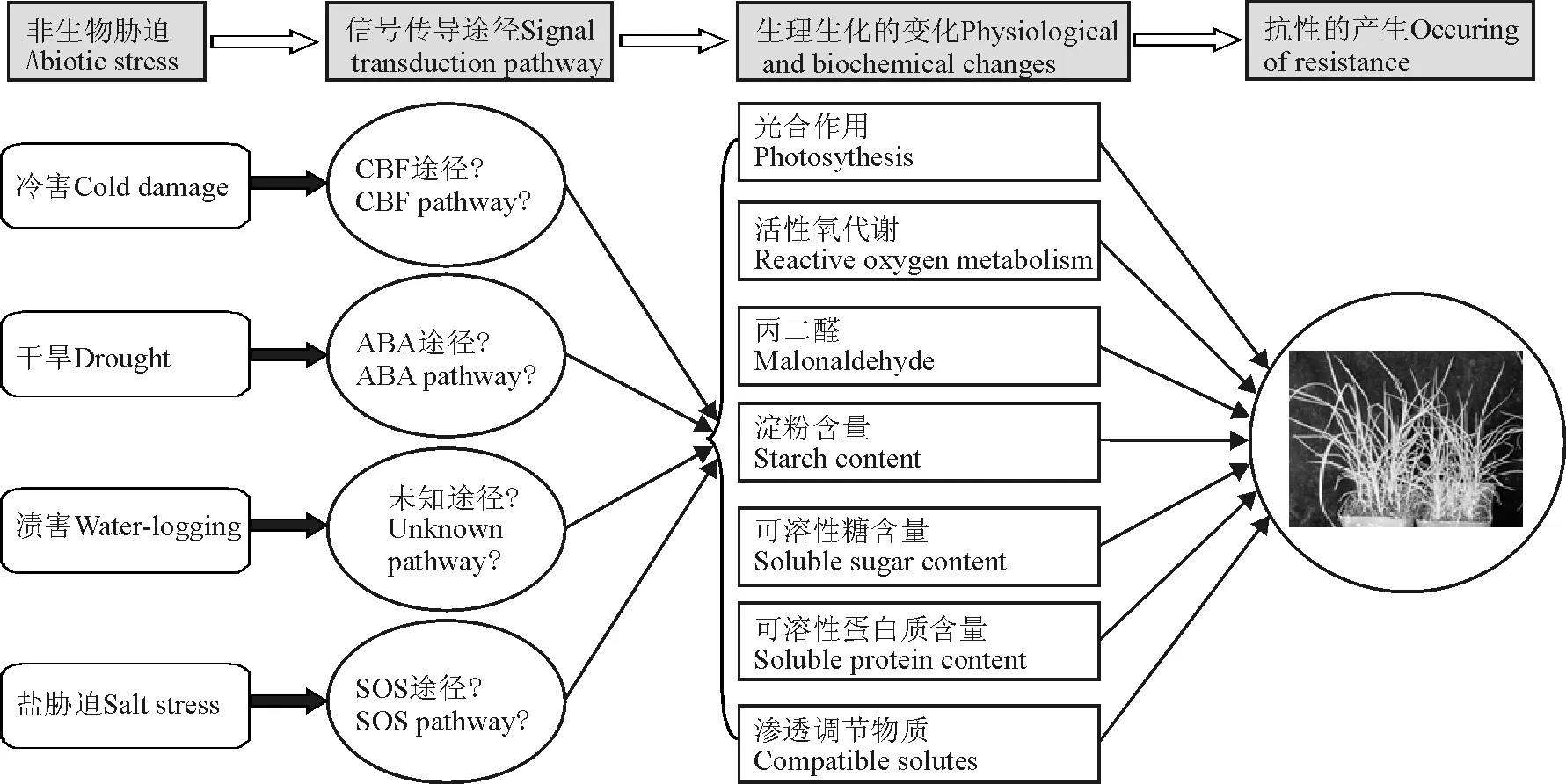
图1 狗牙根对非生物胁迫产生抗性的机理Fig.1 Possible mechanisms of tolerance response of Burmuda grass to abiotic stresses
随着现代科学技术的发展,越来越多的新技术平台被用来研究遗传背景不清楚的物种。目前,组学的研究手段,包括蛋白质组学、转录组学以及代谢组学,为研究狗牙根对水分胁迫的抗性机理提供了很好的技术平台。在前人的研究基础上,今后的研究内容可以偏重于从分子水平上来解析狗牙根对相关逆境胁迫的抗性。1)根据模式植物的相关抗性基因的序列,从狗牙根中克隆抗性基因并研究这些同源基因的功能;2)通过组学的方法,来挖掘狗牙根对不同水分胁迫抗性的基因,研究相关基因在狗牙根抗性产生过程中的功能;3)建立转基因的技术平台,通过转基因的手段来提高狗牙根对相关逆境的抗性;4)将狗牙根中的抗性基因转到相关农作物和资源作物中,提高其对相关逆境胁迫的抗性。相关的研究结果可以加深对狗牙根抗逆性的理解,通过提高狗牙根及相关作物的抗性,最终达到扩大种植区域,改善生态环境,提高经济效益的目的。
[1] 孙吉雄.草坪学[M].北京:中国农业出版社,2003:98-99.
[2] 杨福良.狗牙根草类的主要品种、特性及其建坪利用与管理技术[J].四川草原,2002(2):46-48.
[3] 刘伟,张新全,干友民,等.我国野生狗牙根种质资源的开发利用[J].中国种业,2003(4):41-42.
[4] Harlan J R,de Wet J M J.Sources of variation inCynodondactylon(L.) Pers [J].Crop Science,1969,9:774-778.
[5] Emmons R D.Warm season grasses [A].Turfgrass Science and Management [M].Albany,NY:Delmar Lengagl Learing,1984:36-55.
[6] Esmaili S,Salehi H.Effects of temperature and photoperiod on postponing bermudagrass (Cynodondactylon[L.]Pers.) turf dormancy[J].Journal of Plant Physiology,2012,169:851-858.
[7] Zhang X,Ervin E H,LaBranche A J.Metabolic defense responses of seeded Bermudagrass during acclimation to freezing stress [J].Crop Science,2006,46:2598-2605.
[8] 杨丽丽,赵玉靖,李会彬,等.四个狗牙根品种耐寒生理评价研究[J].北方园艺,2009(11):89-91.
[9] 李培英,孙宗玖,景艳杰,等.冷害胁迫下4 份狗牙根的生理响应[J].新疆农业大学学报,2010,33(5):373-379.
[10] Zhang X,Ervin E H,Waltz C,etal.Metabolic changes during cold acclimation and deacclimation in five Bermudagrass varieties:II.cytokinin and abscisic acid metabolism [J].Crop Science,2010,51:847-853.
[11] Zhang X,Wang K,Ervin E H,etal.Metabolic changes during cold acclimation and deacclimation in five Bermudagrass varieties:I.proline,total amino acid,protein,and dehydrin expression [J].Crop Science,2010,51:838-846.
[12] Chan Z,Grumet R,Loescher W.Global gene expression analysis of transgenic,mannitolproducing,and salt-tolerantArabidopsisthalianaindicates widespread changes in abiotic and biotic stress-related genes [J].Journal of Experimental Botany,2011,62:4787-4803.
[13] Klingler J P,Batelli G,Zhu J K.ABA receptors:The START of a new paradigm in phytohormone signaling [J].Journal of Experimental Botany,2010,61:3199-3210.
[14] Ma Y,Szostkiewicz I,Korte A,etal.Regulators of PP2C phosphatase activity function asabscisic acid sensors [J].Science,2009,324:1064-1068.
[15] Park S Y,Fung P,Nishimura N,etal.Abscisic acid inhibits Type 2C protein phosphatases via the PYR/PYL family of START proteins [J].Science,2009,324,1068-1071.
[16] 刘玲珑,吴彦奇.狗牙根种质资源及抗寒性研究进展[J].中国草地,2000(6):45-50,59.
[17] 熊曦,吴彦奇,李西.狗牙根抗寒性生理生化研究进展[J].草业科学,2001,18(3):39-41,45.
[18] 代会平,杨知建,胡勇.狗牙根抗寒性研究进展[J].草业科学,2007,24(11):87-91.
[19] Anderson J A,Taliaferro C M.Freeze tolerance of seed- producing turf bermudagrasses [J].Crop Science,2002,42:190-192.
[20] Anderson J A,Taliaferro C M,Martin D L.Evaluating freeze tolerance of bermudagrass in a controlled environment [J].HortScience,1993,28:955.
[21] Anderson J A,Taliaferro C M,Martin D L.Longer exposure durations increase freeze damage to turf Bermudagrasses [J].Crop Science,2003,43:973-977.
[22] 张岩,李会彬,边秀举,等.水分胁迫条件下几种狗牙根草坪草抗旱性比较研究[J].华北农学报,2008,23(增刊):150-152.
[23] 张建波,唐成斌,吴佳海,等.狗牙根对不同干旱胁迫处理的生理响应[J].草业科学,2011,28(1):117-120.
[24] Hu L,Wang Z,Huang B.Photosynthetic responses of Bermudagrass to drought stress associated with stomatal and metabolic limitations [J].Crop Science,2009,49:1902-1909.
[25] Zhao Y,Du H,Wang Z,etal.Identification of proteins associated with water-deficit tolerance in C4perennial grass species,Cynodondactylon×CynodontransvaalensisandCynodondactylon[J].Physiologia Plantarum,2011,141:40-55.
[26] Lu S,Wang Z,Peng X,etal.An efficient callus suspension culture system for triploid bermudagrass (Cynodontransvaalensis×C.dactylon) and somaclonal variations [J].Plant Cell,Tissue and Organ Culture,2006,87:77-84.
[27] Lu S,Chen C,Wang Z,etal.Physiological responses of somaclonal variants of triploid bermudagrass (Cynodontransvaalensis×Cynodondactylon) to drought stress [J].Plant Cell Reports,2009,28:517-526.
[28] Shi H,Wang Y,Cheng Z,etal.Analysis of natural variation in bermudagrass (Cynodondactylon) reveals physiological responses underlying drought tolerance [J].PLOS ONE, 2012,7:e53422.
[29] 阿力木·沙比尔,阿不来提·阿不都热依木,齐曼·尤努斯,等.干旱胁迫与复水对3 份新疆狗牙根新品系渗透调节物质的影响[J].新疆农业大学学报,2009,32(6):12-15.
[30] 王玉刚,阿不来提,齐曼.两狗牙根品种对干旱胁迫反应的差异[J].草业学报,2006(8):58-65.
[31] 徐红霞,陈俊伟,谢鸣.脱水素在植物低温胁迫响应中的作用[J].西北植物学报,2009,29(1):199-206.
[32] Hu L,Wang Z,Du H,etal.Differential accumulation of dehydrins in response to water stress for hybrid and common bermudagrass genotypes differing in drought tolerance [J].Journal of Plant Physiology,2010,167:103-109.
[33] Carmo-Silva A E,Keys A J,Beale M H,etal.Drought stress increases the production of 5-hydroxynorvaline in two C4grasses [J].Phytochemistry,2009,70:664-671.
[34] 王强,袁兴中,刘红,等.三峡水库初期蓄水对消落带植被及物种多样性的影响[J].自然资源学报,2011,26(10):1680-1693.
[35] 王海锋,曾波,李娅,等.长期完全水淹对4 种三峡库区岸生植物存活及恢复生长的影响[J].植物生态学报,2008,32(5):977-984.
[36] 马利民,唐燕萍,张明,等.三峡库区消落区几种两栖植物的适生性评价[J].生态学报,2009,29(4):1885-1892.
[37] 谭淑端,张守君,张克荣,等.长期深淹对三峡库区三种草本植物的恢复生长及光合特性的影响[J].武汉植物学研究,2009,27(4):391-396.
[38] 李强,丁武泉,朱启红,等.水位变化对三峡库区低位狗牙根种群的影响[J].生态环境学报,2010,19(3):652-656.
[39] 洪明,郭泉水,聂必红,等.三峡库区消落带狗牙根种群对水陆生境变化的响应[J].应用生态学报,2011,22:2829-2835.
[40] 贾国梅,张红燕,韩京成,等.土壤含水量对狗牙根叶片生理生态指标的影响[J].水土保持研究,2009,16(5):199-202.
[41] 谭淑端,朱明勇,党海山,等.三峡库区狗牙根对深淹胁迫的生理响应[J].生态学报,2009,29:3685-3691.
[42] Dudeck A E,Singh S,Giordano C E,etal.Effects of sodium chloride onCynodonturfgrasses[J].Agronomy Journal,1983,75:927-930.
[43] 陈静波,阎君,姜燕琴,等.NaCl胁迫对6种暖季型草坪草新选系生长的影响[J].植物资源与环境学报,2007,16(4):47-52.
[44] 陈静波,阎君,姜燕琴,等.暖季型草坪草优良选系和品种抗盐性的初步评价[J].草业学报,2009,18(5):107-114.
[45] 陈静波,张婷婷,阎君,等.短期和长期盐胁迫对暖季型草坪草新选系生长的影响[J].草业科学,2008,25(7):109-113.
[46] Marcum K B.Salinity tolerance mechanisms of six C4turfgrasses [J].Journal of the American Society for Horticultural Science,1994,119:779-784.
[47] 周霞,黄春琼,张绪元,等.狗牙根耐盐性材料初步筛选[J].热带农业科学,2010,30(4):20-24.
[48] Marcum K B,Pessarakli M.Salinity tolerance and salt gland excretion efficiency of Bermudagrass turf cultivars[J].Crop Science,2006,46:2571-2574.
[49] Lu S,Peng X,Guo Z,etal.In vitro selection of salinity tolerant variants from triploid bermudagrass (Cynodontransvaalensis×C.dactylon) and their physiological responses to salt and drought stress[J].Plant Cell Reports,2007,26:1413-1420.
[50] Kim C,Jang C S,Kamps T L,etal.Transcriptome analysis of leaf tissue from bermudagrass (Cynodondactylon) using a normalized cDNA library[J].Functional Plant Biology,2008,35:585-594.
[51] 谢永丽,王自章,刘强,等.草坪草狗牙根中抗逆基因BeDREB的克隆及功能鉴定[J].中国生物化学与分子生物学报,2005,21:521-527.
[52] Kim C,Lemke C,Paterson A H.Functional dissection of drought-responsive gene expression patterns inCynodondactylonL[J].Plant Molecular Biology,2009,70:1-16.

