紫藤甘薯茎叶花色苷的提取及其副产物的综合利用
陈 丽,王晨静,王倩娟,陆国权
(浙江农林大学农业与食品科学学院,浙江杭州311300)
甘薯为旋花科甘薯属中能形成块根的栽培种,一年生或多年生草质蔓性藤本植物,近年来,天然色素越来越受到人们的关注与欢迎,是因为其不仅是食品、药品、化妆品等的着色剂[1],而且自身还含有多种营养成分,有的对某些疾病还有疗效作用,对人体有保健功能[2-3]。因此甘薯花青素的研究也应运而生。但这些研究多集中于块根花青素,而未涉及甘薯地上部茎叶的花青素[4]。紫藤甘薯是甘薯特有的新品种类型,它不仅营养丰富,而且茎叶再生性强,可分次收割,所收割的茎叶易贮藏,紫藤甘薯的茎叶中富含具有显著天然抗氧化性和清除自由基等生理活性作用的天然花青素[5-6],花青素主要通过糖苷键形成花色苷而存在,其呈现出鲜艳紫色,是一种重要的天然色素源和营养保健食物源。另外,紫藤甘薯茎叶提取完花色苷之后会留有一部分的残渣,其中的叶蛋白、纤维、黄酮等还可进一步利用,以达到节约资源、提高甘薯茎叶利用率的目的。本文以紫藤甘薯茎叶为材料,主要通过盐酸乙醇提取花色苷,研究花色苷的提取工艺,分析在不同提取条件下的最佳工艺,并对其副产物进行分析研究[7]。
1 材料与方法
1.1 材料与仪器
紫藤甘薯茎叶 采自浙江农林大学官塘农场,新鲜紫藤甘薯茎叶洗净,剪碎,研磨粉碎,备用;盐酸、无水乙醇、柠檬酸、磷酸氢二钠、醋酸、蒸馏水、氢氧化钠 均为国产分析纯。
电子天平 赛多利斯科学仪器(北京)有限公司;HH-4型数显恒温水浴锅 常州国华电器有限公司;TDL-5-D型台式离心机 上海安亭科学仪器厂制造;DGG-9123AD型电热恒温鼓风干燥箱 上海森信实验仪器有限公司;PHS-2C型精密酸度计 上海精密科学技术有限公司;紫外可见分光光度计 北京普析通用仪器有限责任公司;恒温磁力搅拌器 上海梅颖浦仪器仪表制造有限公司;布氏漏斗 熙元实业有限公司;旋转蒸发仪 上海人和科学仪器有限公司。
1.2 实验方法
1.2.1 紫藤甘薯花色苷含量的测定方法 单一pH法测定花色苷含量[8]:由比尔定律A=εcb,用单个花色苷比消光度测定花色苷含量:
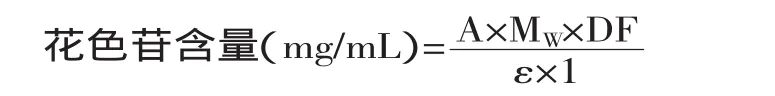
式中:A为吸光度;MW为矢车菊素-3-葡萄糖苷分子量(取449.2);DF为稀释倍数;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数(取26900);1为比色皿光程(1cm)。根据比尔定律可知,总花色苷溶液的含量与吸光度成正比,因此为了方便起见,在本文中直接用吸光度值(A)分析比较不同提取条件下花色苷的提取率大小。
1.2.1.1 不同提取剂浸提效果比较 比较采用1%HCl、95%乙醇(1%HCl)、95%乙醇(1%醋酸)、95%乙醇(蒸馏水)、蒸馏水时所提取出来花色苷的吸光值来确定最佳提取溶剂。
1.2.1.2 酸化乙醇浓度 称取5g紫藤甘薯茎叶研磨物,每组的酸化乙醇浓度不同,研究酸化乙醇对紫藤甘薯茎叶花色苷提取的影响。
1.2.1.3 料液比 实验步骤同上,每组的料液比不同,研究料液比对紫甘蓝花色苷提取的影响。
1.2.1.4 提取时间 实验步骤同上,每组的提取时间不同,研究提取时间对紫藤甘薯茎叶花色苷提取的影响。
1.2.1.5 提取温度 实验步骤同上,每组的提取温度不同,研究提取温度对紫藤甘薯茎叶花色苷提取的影响。
1.2.1.6 最佳提取溶剂的提取条件实验 在最佳提取剂确定的条件下,经实验花色苷在不同提取剂浓度、浸提温度、浸提时间上有先上升后下降趋势,对花色苷提取影响较大,因此安排三因素三水平的正交实验,采用最佳提取剂在各种实验条件下进行提取,在最大吸收波长下测定最佳提取剂浸提液的吸光度值大小来确定最佳的提取工艺。

表1 正交实验的因素与水平表Table 1 Factors and levels of the orthogonal experiment
1.2.2 副产物的综合利用
1.2.2.1 副产物叶蛋白的含量测定 提取叶蛋白的流程:5g提取过花色苷的紫藤甘薯茎叶残渣→压榨取草液汁→定容至100mL→调pH(pH=3)→加热(先75℃加热9min,后快速冷却至40℃)→蛋白絮凝→抽滤→干燥→粗蛋白(叶蛋白)

1.2.2.2 副产物纤维的含量测定 纤维提取方法如下:准备好5g提取过花色苷的紫藤甘薯茎叶残渣用清水清洗干净→过滤→残渣原料→浸入氢氧化钠水溶液(5%NaOH,80℃下加热60min,固液比1∶30)中→搅拌→滤网过滤→副产物纤维。
纤维的含量测定:采用硝酸乙醇法,用20%硝酸及80%乙醇(体积比)的混合液处理残渣原料,原料中大部分的木质素被硝酸和乙醇混合液溶解,余下的固体物质是纤维。混合液中的纤维经过滤分离出来,烘干至恒重,称重计算出纤维的含量。

1.2.2.3 副产物黄酮的含量测定 黄酮提取方法如下:根据文献[9]中的芦丁标准曲线方法,得A=10.1143C-0.0096,相关系数R2为0.9968(A为吸光度,C为质量浓度mg·mL-1)。甘薯茎叶副产物以水为溶剂,提取温度91~100℃,提取时间50~60min,可达到最佳提取效果。将提取液过滤、离心后用紫外分光光度计在506nm波长处测定吸光度。
2 结果与分析
2.1 紫藤甘薯茎叶花色苷提取的研究
2.1.1 最佳提取剂的确定 分别采用蒸馏水、不同的酸化乙醇、稀盐酸等提取剂,从紫藤甘薯茎叶中提取花色苷,在相同条件下测定各提取液在510nm条件下的吸光度。结果如表2所示。
由以上结果可以看出,在相同的条件下,95%乙醇与0.1mol/L盐酸作为提取剂,在510nm处具有最大的吸光度值,故宜选用盐酸酸化的乙醇作为最佳提取剂,在此波长下测其吸光度。
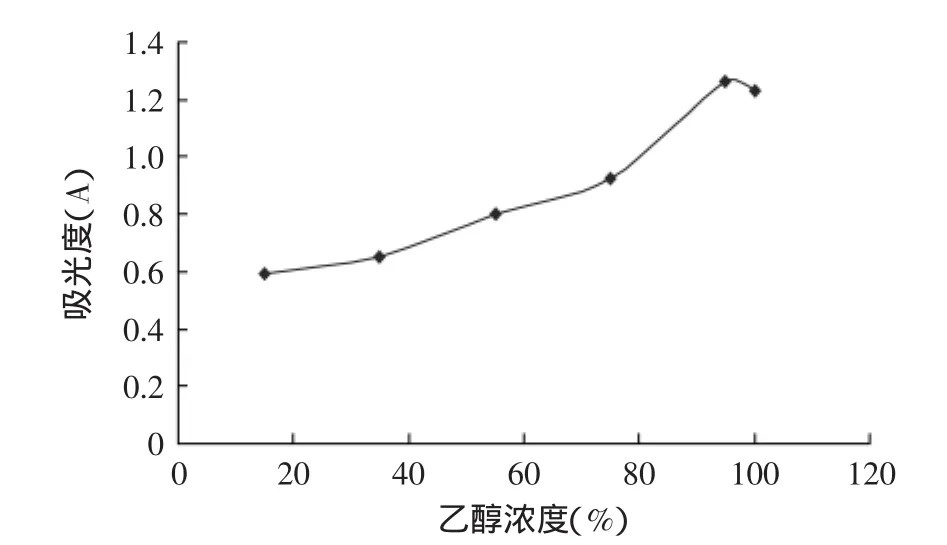
图1 酸化乙醇浓度对紫藤甘薯茎叶花色苷提取的影响Fig.1 Effect of acidified ethanol content on extraction of the stem and leaf of wisteria sweet potato anthocyanin

表2 各提取液在510nm下的吸光度(A)Table 2 The absorbance(A)of each extract at 510nm
2.1.2 酸化乙醇浓度对紫藤甘薯茎叶花色苷提取的影响 料液比1∶40(g∶mL),提取时间24h,提取温度50℃,酸化乙醇对紫藤甘薯茎叶花色苷提取率的影响研究结果见图1。由图1可知,紫藤甘薯茎叶花色苷提取率随着酸化乙醇浓度的增加呈现先上升后下降的趋势。当酸化乙醇浓度提高时,紫藤甘薯茎叶花色苷提取的吸光度随着乙醇浓度的升高而增加,并在95%的时候达到最高值,随之有所下降,因此乙醇浓度保持在95%左右为宜。
2.1.3 料液比对紫藤甘薯茎叶花色苷提取的影响酸化乙醇浓度95%,提取时间24h,提取温度50℃,料液比对紫藤甘薯茎叶花色苷提取率的影响见图2。由图2可以看出,随着料液比的增大,料液比小于1∶40(g/mL)时花色苷的提取率呈平缓的降低趋势。当料液比为1∶50(g/mL)时,提取率的降低幅度最大。这是因为料液比小于1∶40(g/mL)时,原料中的花色苷没有被完全提取出来,溶液就已饱和。当料液比为1∶50(g/mL)时,提取的花色苷被稀释,导致吸光度降低幅度变大。考虑到水量多有利于花色苷的扩散传质,但料液比过大不但会增加溶剂的用量,而且会提高操作费用[10],因此料液比选择1∶40(g/mL)为最佳。

图2 料液比对紫藤甘薯茎叶花色苷提取的影响Fig.2 Effect of the ratio of solid to solution on extraction of the stem and leaf of wisteria sweet potato anthocyanin
2.1.4 提取时间对紫藤甘薯茎叶花色苷提取的影响
在酸化乙醇浓度95%,料液比1∶40(g/mL),提取温度50℃时,提取时间对紫藤甘薯茎叶花色苷提取的影响见图3。从图3可以看出,随着提取时间的延长,提取率增大,提取时间为24h时,提取率达到最高,继续延长提取时间,提取率反而呈下降的趋势,这是因为,随着时间的增加,色素的提取量增加,但在加热的条件下,色素容易发生分解,加上光照等的作用,花色苷的稳定性下降[11]。所以不宜在加热条件下提取过长的时间,因此提取时间保持在24h为宜。

图3 提取时间对紫藤甘薯茎叶花色苷提取的影响Fig.3 Effect of extraction time on extraction of the stem and leaf of wisteria sweet potato anthocyanin
2.1.5 提取温度对紫藤甘薯茎叶花色苷提取的影响
酸化乙醇浓度95%,料液比1∶40(g/mL),提取时间24h,提取温度对紫藤甘薯茎叶花色苷提取的影响见图4。由图4可以看出提取率随温度的升高而增加,这可能是温度的升高有助于加快紫藤甘薯茎叶花色苷的溶出,溶出速率加快,当温度为50℃时,提取率达到最高,大于50℃,由于温度过高导致紫藤甘薯茎叶花色苷中的矢车菊色素结构发生改变,生成无色的查尔酮式结构,所以50℃以后,花色苷的提取率下降[12]。综合考虑,温度选择50℃最佳。

图4 提取温度对紫藤甘薯茎叶花色苷提取的影响Fig.4 Effect of extraction temperature on extraction of the stem and leaf of wisteria sweet potato anthocyanin
2.1.6 最佳提取条件的确定 根据1.2.1.5的正交实验设计进行的紫藤甘薯茎叶花色苷乙醇浸提法,得到的实验结果和数据处理见表3和表4。

表3 乙醇提取花色苷正交实验结果Table 3 Results of the orthogonal experimental design of ethanol extraction on anthocyanin

表4 乙醇提取花色苷正交实验方差分析Table 4 ANOVA of the orthogonal experimental design of ethanol extraction on anthocyanin
从正交实验结果来看,乙醇浓度、温度、时间这三个因素对紫藤甘薯茎叶花色苷的提取影响都是显著的(F>F0.05(2,2)),影响大小为A>C>B,按实验结果可确定最佳的乙醇水浴提取条件是:A2B2C3,即提取溶剂用95%的酸化乙醇,提取温度为50℃,时间为24h,与它相同的恰好是5号实验。从实际做出的结果来看,5号实验的吸光度为1.089,是9次实验中最高的,说明找出的最优方案是符合实际的。所以根据正交设计助手显著性检验确定最优工艺条件为A2B2C3。
2.2 副产物的综合利用
经以上实验设计操作流程,所得紫藤甘薯茎叶副产物中各类营养物质提取率。由表可知,经提取过花色苷的紫藤甘薯茎叶残渣中含有7.32%的叶蛋白、13.02%的纤维及6.07%的黄酮,均含量较高,能够实现副产物的综合利用。见表5。

表5 各类营养物质提取率Table 5 Extraction rate of nutritional compontent
3 结论
3.1 通过以上实验得出最佳单因素条件组合为酸化乙醇浓度95%,料液比1∶40(g/mL),提取时间24h,提取温度50℃,在此条件下提取的紫藤甘薯茎叶花色苷在510nm下呈现最大吸收波,吸光值最大,花色苷含量为149.76mg/g。另外,在实验设计范围内,各因素对紫藤甘薯茎叶花色苷提取率的影响从大到小依次为乙醇浓度、时间、温度。
3.2 利用提取过花色苷的紫藤甘薯茎叶残渣进行下一步的研究,可提取出得率为7.32%的叶蛋白,得率为13.02%的纤维,得率为6.07%的黄酮。残渣中叶蛋白、纤维、黄酮的含量较高,表明副产物仍可以得到进一步的开发利用:叶蛋白可广泛应用于食品、饲料等领域,纤维可广泛应用于生活用品、工艺品、建筑板材、工业包装等领域,黄酮可广泛应用于药理药效、化学成分研究等领域,综上,提取过花色苷的紫藤甘薯茎叶残渣可实现废物资源的综合利用。
[1]Van-den Truong,Nigel Deighton,Roger T Thompson,et al.Characterization of Anthocyanins and Anthocyanidins in Purple-Fleshed Sweetpotatoes by HPLC-DAD/ESI-MS/MS[J].J Agric.Food Chem,2010,58:404-410.
[2]Elyana Cuevas Montilla,Silke Hillebrand,Peter Winterhalter.Anthocyanins in purple sweetpotato(Impomoea batatas L.)variesties[J].Fruit Vegetable and Ceral Science and Biotechnology,2011(2):19-24.
[3]杨萍.紫色甘薯茎叶色素理化性质研究[J].东北农业大学学报,2010,41(7):113-117.
[4]MdShahiul Islam,MJalaluddin,James OGarner.Artifical Shading and Temperature Influence on Anthocyanin Composition in Sweetpotato Leaves[J].HortScience,2005,40(1):176-180.
[5]杨颖,夏其乐,陈剑兵,等.紫薯花色苷的理化性质研究[J].食品工业科技,2009,30(11):251-253.
[6]BOVELL-BENJAMIN A C.Sweet potato:A review of its past,present,and future role in human nutrition[J].Advances in Food and Nutrition Research,2007,52:1-59.
[7]牟杰,赵晓燕,李新华,等.响应面法优化超声提取紫色马铃薯皮花色苷工艺的研究[J].食品工业科技,2009,30(7):241-243.
[8]李洋,张媛,李琳,等.蛇莓果实总花色苷含量测定方法的比较.化学研究[J].2011,22(5):95-98.
[9]骆祥峰.银杏黄酮类生物活性物质提取工艺研究[D].合肥:合肥工业大学,2000.
[10]刘会超,贾文庆,贾国瑞,等.二月兰花色苷的提取及其稳定性研究[J].贵州农业科学,2010,38(2):156-159.
[11]Bolívar A,Cevallos-Casals,Luis Cisneros-Zevallos.Stability of anthocyanin-based aqueous extracts of Andean purple corn and red-fleshed sweet potato compared to synthetic and natural colorants[J].Food Chemistry,2004,86(1):69-77.
[12]MARIKO N,HASSIMOTTO A,GENOVESE M I,et al.Absorption and metabolism ofcyanidin-3-glucosideand cyanidin-3-rutinoside extracted fromwild mulberry(Morus nigra L.)in rats[J].Nutrition Research,2008,28(3):198-207.

