重组褐藻胶裂解酶基因工程菌的高密度培养
李安雪,汪立平,赵 勇
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海201306)
褐藻胶的降解产物褐藻寡糖具有促进双歧杆菌的增殖、整肠、解毒、降血糖血脂、抗炎、抗菌、免疫调节等作用[1-5]。褐藻胶的酶解法,反应条件易控制,底物特异性高,在寡糖制备各方面明显优于化学和物理降解,褐藻胶裂解酶已成为目前研究的热点。大部分含有褐藻胶裂解酶基因的野生菌株生长条件特殊,产酶量低,分离困难。近年来国内外已构建了表达褐藻胶裂解酶基因的工程菌[6-13],但是利用这些工程菌进行发酵产生的褐藻胶裂解酶的活性依然偏低,达不到工业生产利用的要求。高细胞密度发酵(High cell density cultivation,HCDC)是指在一定条件和培养体系下获得最多的细胞量,即利用一定的培养技术和装置提高菌体的发酵密度,使菌体密度较普通培养有显著提高,最终提高产物的比生产率(单位体积单位时间内产物的产量)[14]。高密度发酵技术不仅增加了发酵过程中重组大肠杆菌的生物量,得到大量的目的基因产物,并且目的产物也得到质的提高。据LeeS Y[15]计算,理论上大肠杆菌发酵所能达到的最高菌体密度为400g(DCW/L),迄今为止,大肠杆菌发酵菌体密度最高的两例为:非重组E.coli W3110 达 174g(DCW/L)[16],生产聚-3-羟基丁酸的重组菌达175.4g(DCW/L)[17]。目前,褐藻胶裂解酶基因的工程菌高密度培养尚未见报道。较高活性的褐藻胶裂解酶可以制备褐藻寡糖,并具有较高的利用价值,为提高褐藻胶裂解酶的产量和活性,本实验对褐藻胶裂解酶基因工程菌的高密度培养进行了研究。本实验对来源于蜡样芽孢杆菌的褐藻胶裂解酶基因进行了克隆,并在大肠杆菌BL21中进行表达[18]。将该菌种采用分批补料方式在5L发酵罐中进行培养。通过对发酵培养基中碳浓度、氮源浓度、补料培养基浓度、诱导时间和诱导剂浓度的控制,通过高密度发酵提高褐藻胶裂解酶生产量。
1 材料与方法
1.1 材料与仪器
含表达褐藻胶裂解酶重组质粒的工程菌E.coli BL21 本实验室构建和保藏;氨苄青霉素、IPTG 天根生化科技有限公司;其他培养基成分及试剂 国药集团化学试剂有限公司;LB培养基(g/L):蛋白胨10,酵母提取物5,氯化钠10,卡那霉素(10mg/mL)600μL;摇瓶种子培养基(g/L):蛋白胨10,酵母提取物 5,NaCl 10,葡萄糖 30,卡那霉素(10mg/mL)600μL;发酵培养基[19](g/L):葡萄糖 10,酵母提取物5,蛋白胨 20,K2HPO45,KH2PO43.5,(NH4)2HPO44.0,MgSO4·7H2O 1.2,柠檬酸 1.7,微量元素液(1mL/L),卡那霉素(10mg/mL)600μL;其中微量元素液(g/L):FeSO4·7H2O 1.0,ZnSO4·7H2O 0.225,(NH4)6MO·4H2O 0.15,CuSO4·H2O 0.15,CaCl2·H2O 0.2,MnSO4·H2O 0.05,Na2B4O4·H2O 0.002;补料培养基(g/L):葡萄糖,蛋白胨20,酵母提取物10,MgSO4·7H2O 1.2。
立式压力蒸汽灭菌器 上海申安医疗器械厂;FMG-5L-Ⅰ发酵罐 上海国强生化工程装备有限公司;细胞破碎仪 LOW SURFACE TENSION LIQUIDS ORGANIC SOLVENTS;SW-CJ-1F洁净工作台 上海博迅实业有限公司;UV-2000型分光光度计 上海安亭科学仪器厂;CR21G冷冻离心机 日本日立公司。
1.2 实验方法
1.2.1 重组大肠杆菌的分批发酵 将含表达褐藻胶裂解酶重组质粒的工程菌E.coli BL21在LB培养基中进行活化,按2%接种量接种于 LB培养基中,150r/mim,37℃,培养 10h,OD600约 0.7~0.8。摇瓶培养后[19]的种子液按5%的接种量接种于5L发酵罐中,培养基体积为3L。控制的几个关键参数为:溶氧量控制在30%~40%,转速400r/min;在第5h加入1mmol/L的IPTG诱导表达,诱导前发酵温度自动控制在37℃,诱导后发酵温度设定为30℃;每隔2h进行取样,利用分光光度计在600nm处测定菌体密度OD600,用DNS法测定发酵液中葡萄糖含量;发酵结束后收集菌体制备酶液,用紫外吸收测定酶活。
1.2.2 重组大肠杆菌的分批补料发酵 按照1.2.1进行接种培养,培养至10g/L的初糖浓度低于1g/L时,在不同批次培养中分别流加葡萄糖浓度为60、90、120、150g/L的补料培养基,根据补料培养基的体积和发酵时间,4~10h的流加速率为 100mL/h,10~16h流加速率为200mL/h。补料期间仍然手动流加30%(v/v)的氨水,流加速率根据发酵液中pH的变化而改变,保持pH稳定,使pH保持在7.0~7.2,溶氧量控制在30%~40%,转速400r/min;温度设定为37℃。
1.2.3 重组大肠杆菌补料分批发酵过程中IPTG诱导条件的优化 在分批补料发酵过程中,选择IPTG的诱导时间和IPTG浓度两个因素进行单因素实验,对IPTG诱导条件进行初步优化。以单因素实验结果为基础,运用单纯形法[20]对IPTG的诱导条件做进一步优化,得到最优诱导条件。
1.2.4 酶液的制备 发酵进行24h后结束发酵,发酵液在4℃、8000r/min下离心10min,收集菌体,用PBS缓冲液洗涤3次,加入适量PBS缓冲液重悬(菌液浓度为40mg/mL,以湿重计)。菌液在4℃下预冷并均质后在冰水浴中经超声波破碎(超声波破碎条件为菌液体积50mL,NaCl浓度为0.15mol/L,破碎强度50%,总工作时间5min,工作/间歇时间为4s/8s),4℃下以12000r/min转速离心15min,上清液即为粗酶液,粗酶液利用镍柱亲和层析纯化进行纯化后得到纯酶液。
1.3 分析方法
1.3.1 菌体密度 取一定量的发酵液,经适当稀释,使稀释后的菌液OD值在0.2~0.8之间,用分光光度计在600nm处测吸光值,吸光值与稀释倍数的乘积即为发酵液的菌体密度(OD600)。
1.3.2 细胞浓度 取10mL发酵液,离心收集菌体沉淀,于105℃烘干约3h至恒重,精确称重,即为细胞干重。
1.3.3 残糖浓度 DNS法[21]。
1.3.4 酶活测定 参照Preiss[22]紫外吸收法。
1.3.5 重组蛋白含量 考马斯亮蓝法[23],以牛血清白蛋白BSA为标准。
1.3.6 平均比生长速率[24]
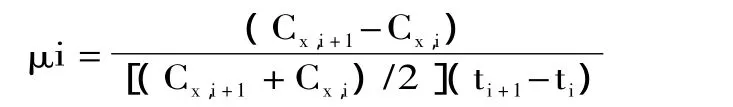
其中μ是平均比生长速率(1/h),C是菌体浓度(g/L),t是时间(h)。
2 结果与分析
2.1 重组大肠杆菌的分批发酵
重组大肠杆菌分批发酵的结果如图1所示,由图中可以看出,在葡萄糖浓度为10g/L的发酵培养基中进行分批发酵时,重组大肠杆菌的菌体密度在12h达到最大,OD600为10.83,发酵结束后按照分析方法1.3.2测定细胞浓度(DCW)达5.95g/L。在第5h加入IPTG诱导外源基因表达,根据预实验的结果,诱导表达6h后取发酵液制取粗酶液,重组大肠杆菌进入稳定期,发酵进行24h后结束发酵,制取粗酶液,测定酶活达4.81U/mL。
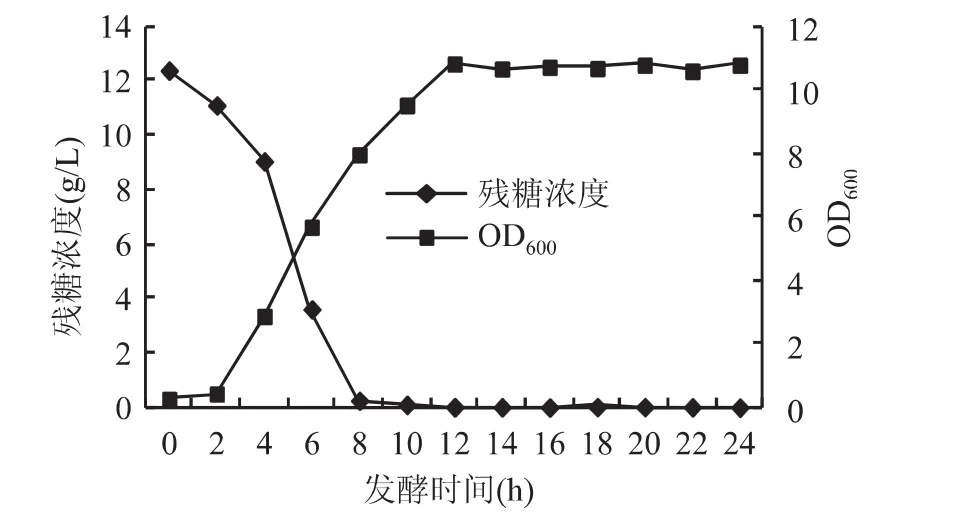
图1 重组大肠杆菌的分批发酵Fig.1 Batch fermentation of recombinant E.coli
2.2 重组大肠杆菌的分批补料发酵
重组大肠杆菌的分批补料发酵结果如图2,由图2(A)可以看出,当补料培养基中葡萄糖浓度为60g/L时,补料前平均比生长速率为0.44h-1,补料期间平均比生长速率仅为0.02h-1,在第14h菌体密度达到最大,OD600仅为11.99,与分批发酵相比没有一点提高。这说明补料培养基中葡萄糖的浓度过低,培养基中碳源浓度严重不足,菌体生长缓慢。因此,增大补料培养基中葡糖糖的浓度,以提高发酵液中葡萄糖的浓度,分别设计了补料培养基中葡萄糖浓度为90、120、150g/L,并在补料时手动流加氨水溶液,培养结果如图2(B)~图2(D)所示。
由图2(B)~图2(D)可知,随着补料培养基中葡萄糖浓度的增大,当补料培养基中葡萄糖浓度为90g/L时,补料前比生长速率为0.44h-1,补料期间平均比生长速率为0.060h-1;在第14h获得细胞密度OD600值为33.75。当补料培养基中葡萄糖浓度为120g/L时,补料前比生长速率为0.43h-1,补料期间平均比生长速率为0.13h-1;在第22h获得细胞密度OD600值为45.13。当补料培养基中葡萄糖浓度为150g/L时,料前比生长速率为0.44h-1,补料期间平均比生长速率为0.27h-1;在第24h获得细胞密度OD600值为99.24。比较之后可以得出,补料培养基中葡萄糖浓度为150g/L的结果最好。
2.3 IPTG诱导条件的优化
2.3.1 单因素实验
2.3.1.1 诱导时间 在重组大肠杆菌的分批补料发酵过程,在诱导温度为30℃,IPTG浓度为1mmol/L的情况下,分别在第 2、4、8、12、16h进行诱导后,分批发酵30h,考察诱导时间对褐藻胶裂解酶高效表达的影响。结果如图3所示。诱导时间对基因表达效果影响很大,加入过早或过迟褐藻胶裂解酶基因的表达效果都不够理想,过早的诱导时,微生物处于停滞期,IPTG的加入抑制了大肠杆菌的生长,使得菌体密度较低;若诱导太晚,菌成熟后各种酶的合成能力降低,表达量也减少。由图中可以看出,在第4h进行诱导时,表达效果最好,表达量达到最高值。发酵结束后制取粗酶液,酶活达17.62U/mL,重组蛋白含量达0.357g/g。
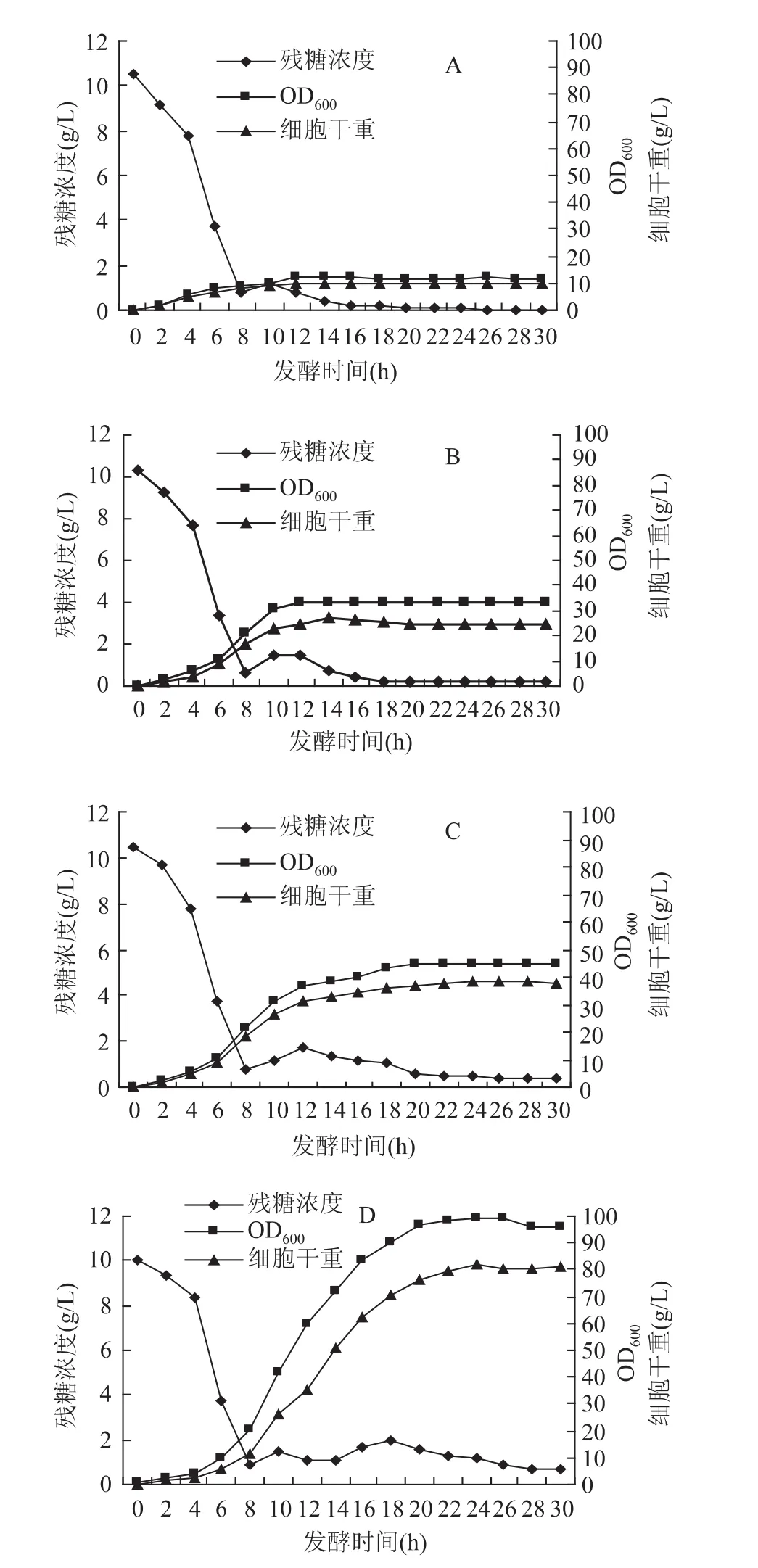
图2 补料葡萄糖浓度对重组大肠杆菌分批补料发酵的影响Fig.2 Supplementary food glucose concentration on recombinant E.coli fed-batch culture fermentation
2.3.1.2 IPTG浓度 在重组大肠杆菌的分批补料发酵过程,在诱导温度为30℃,诱导时间为4h的情况下,分别以 IPTG 终浓度为 0.2、0.4、0.6、0.8、1.0mmol/L对重组菌进行诱导表达,分批发酵30h,考察诱导时间对褐藻胶裂解酶高效表达的影响。结果如图4所示,由图中可以看出,第 4h以 IPTG终浓度为0.6mmol/L进行诱导时,表达效果最好。发酵结束后制取粗酶液,酶活达17.62U/mL,重组蛋白含量达0.373g/g。当大于0.6mmol/L时诱导效果开始降低,这是由于高浓度的IPTG对含质粒工程菌的生长具有抑制作用[18],并且IPTG本身价格就比较昂贵,因此控制好浓度是非常有必要的。
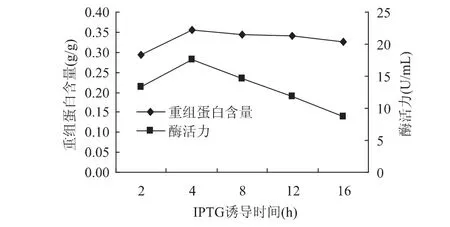
图3 IPTG诱导时间对重组蛋白表达的影响Fig.3 Induction time of IPTG on recombinant protein expression
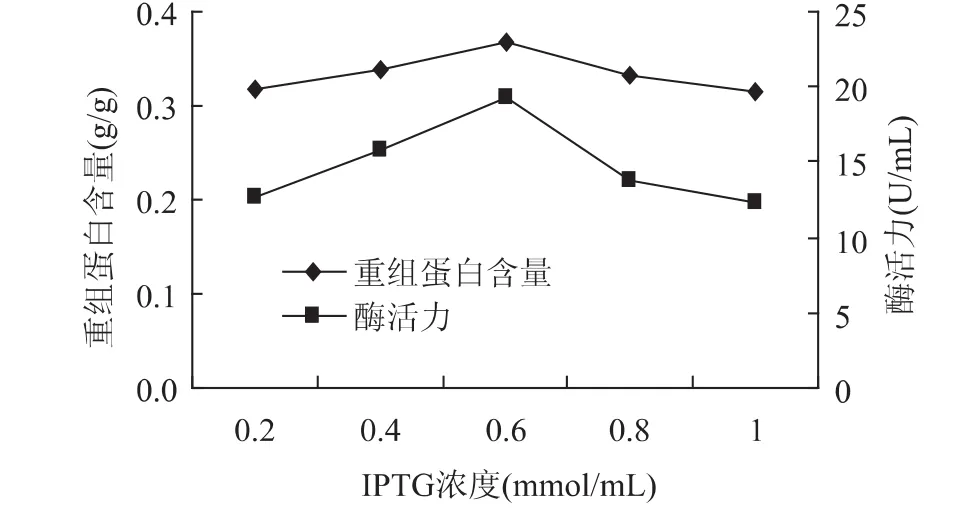
图4 IPTG浓度对重组蛋白表达的影响Fig.4 Concentration of IPTG on recombinant protein expression
2.3.2 单纯形优化法 单纯形法在实验的过程中,要先确定考察的因素,而且要等一个配方实验完后才能根据计算的结果进行下一次实验,因此主要适用于实验周期较短的细菌或重组工程菌发酵培养基的优化,以及不能进行大量实验的发酵罐培养条件的优化[25]。根据单因素实验结果进行单纯形优化实验,利用均匀设计表构造初始单纯形,如表1所示,分别进行重组大肠杆菌分批补料发酵实验;发酵结束后制备粗酶液,测定褐藻胶裂解酶酶活力,根据初始单纯形实验结果,去掉其中结果最坏的实验点,按照改进单纯形优化法确定出新的实验点的诱导时间和IPTG终浓度,其中新的实验点的计算公式为:P新=P平+α(P平-P差),式中 P平为留下实验点的平均值,P差为去掉的最差点,α的取值一般为1,根据实验的结果进行扩大或缩小。
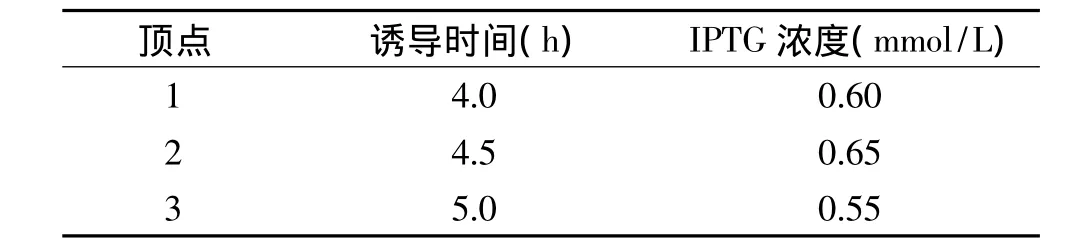
表1 初始单纯形Table 1 Initial simplex
实验结果表明,经过5次更新单纯形,即可确定出IPTG诱导的最优条件,结果如表2所示,最佳诱导条件为:诱导时间为第 4.5h,IPTG终浓度为0.60mmol/L。在此条件下,经过分批补料发酵,重组大肠杆菌经过分批补料发酵,在最佳诱导条件下诱导后,发酵进行30h,最终菌体密度OD600达91.29,粗酶液的酶活达26.37U/mL,重组蛋白含量为0.491g/g,即为第7组实验的结果,发酵液经105℃烘干至恒重,称得其细胞干重为60.15g/L。与分批发酵相比,菌体密度提高了8.43倍,褐藻胶裂解酶的活性提高了5.48倍。
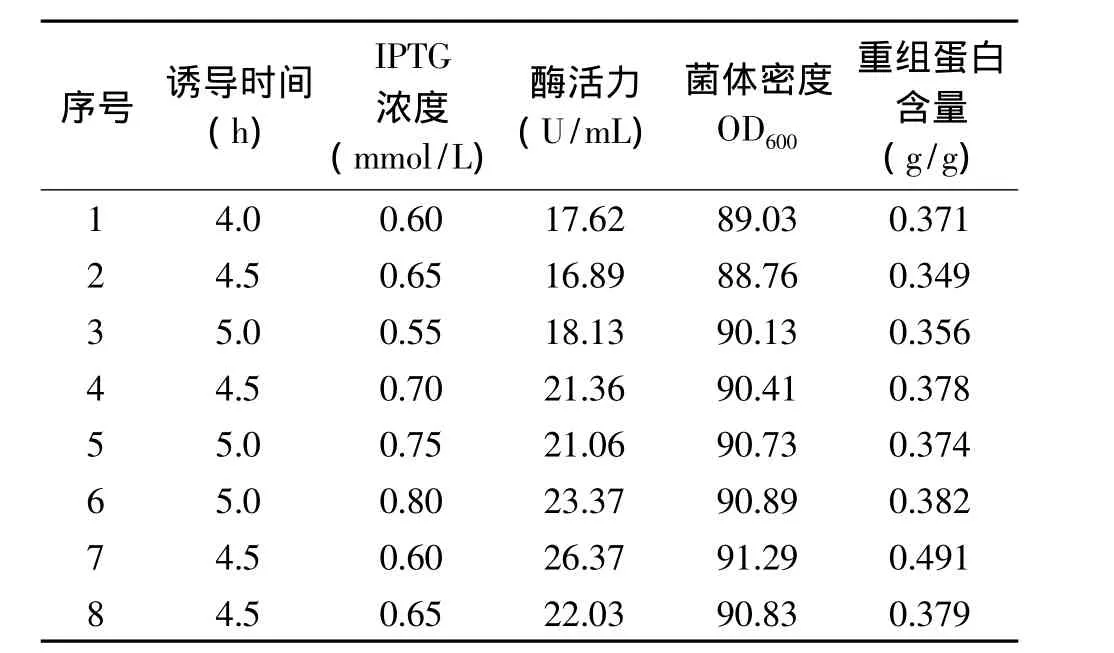
表2 诱导条件单纯形优化数据Table 2 Progress of simplex optimization for induction condition
3 结论
本研究通过对补料培养基中葡萄糖浓度的优化,使得发酵罐中葡萄糖的浓度既能供应大肠杆菌的生长,即能保持较高的比生长速率,又能控制乙酸的产生,发酵罐中的pH保持在7.0左右,最终大肠杆菌发酵结束后菌体密度 OD600达99.24、细胞干重(g(DCW)/L)65.38的高密度。通过单因素实验和单纯形优化法优化诱导条件,最终以最佳诱导条件诱导后,重组大肠杆菌在分批补料发酵中菌体OD600达91.29,细胞干重(g(DCW)/L)达60.15;褐藻胶裂解酶的酶活达26.37U/mL,是分批发酵的5.48倍。该方法补料指征简便,不需要复杂的发酵参数控制和较长的发酵时间,为以后的研究提供了一定的基础。虽然与分批发酵相比,褐藻胶裂解酶的酶活得到了一定的提高,但仍然满足不了生产使用的需求,以后仍然需要更加深入的研究,例如在酵母系统中进行表达、蛋白质工程等手段使其酶活进一步提高。
[1]卜宁,马莲菊,刘诗扬,等.两种海洋寡糖对双歧杆菌体外生长作用的影响[J].沈阳师范大学学报:自然科学版,2009,27(4):472-475.
[2]陈丽,王淑军,刘泉,等.褐藻寡糖对3种水产致病菌抗菌活性研究[J].淮海工学院学报,2009,18(1):90-92.
[3]陈丽,张林维,薛婉立.褐藻寡糖的制备及抑菌性研究[J].中国饲料,2007,42(9):34-35,42.
[4]江晓路,杜以帅,王鹏,等.褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响[J].中国海洋大学学报:自然科学版,2009,6:1188-1192.
[5]佟哲,王雪,卜宁,等.褐藻寡糖对热应激小鼠肝脏和胰腺的影响[J].沈阳师范大学学报:自然科学版,2007,25(4):487-490.
[6]Boyd A,Ghosh M,May TB,et al.Sequence of the algL gene of Pseudomonas aeruginosa and purification of its alginate lyase product[J].Gene,1993,131:1-8.
[7]Schiller N L,Monday S R,Boyd C M,et al.Characterization of thePseudomonasaerugino0sa alginate lyase gene(algL):Cloning,sequencing,and expression inEscherichia coli[J].Journal of Bacteriology,1993,175(15):4780-4789.
[8]Pecnia A,Pascual A,Paneque A.Cloning and expression of the algL gene,encoding the Azotobacter chroococcum alginate lyase:purification and characterization of the enzyme[J].Journal of Bacteriology,1999,181(5):1409-1414.
[9]Ma Y,Xue L,Sun DW.Characteristics of trehalose synthase from permeablized Pseudomonas putida cells and its application in converting maltose into trehalose[J].Journal of Food Engineering,2006,77:342-347.
[10]Osamu M-,Wataru H.An exotype alginate lyase in Sphingomonassp.A1:overexpression in Escherichia coli,purification,and characterization of alginate lyase IV(A1-IV)[J].Protein Expression and Purification,2003,29:33-41.
[11]Malissard M,Chavagnat F,Duez C,et al.Overproduetion and Properties of the mannuronate alginate lyase AIXMB FEMS[J].Mierobiol Lett,1995,126:105-112.
[12]刘岩,江晓路,管华诗.褐藻胶裂合酶研究进展[J].中国水产科学,2001,7(4):99-103.
[13]Schiller N L,Monday S R,Boyd C M,et al.Characterization of the Pseudomonas aeruginosa alginate lyase gene(algL):Cloning,sequencing,and expression in Escherichia coli[J].Journal of Bacteriology,1993,175(15):4780-4789.
[14]李民,陈常庆.基因工程茵高密度发酵研究进展[J].生物工程进展,2000,20(2):26-31.
[15]LeeS Y,Chang H N J.High cell-density culture of Escherichian coli[J].Environ Polymer Degrad,1994,2:169-174.
[16]Jong H C,Ki Chang Keum,Sang Yap Lee.Production of recombinant proteins by High cell density culture of Escherichia coli[J].Chemical Engineering Science,2006,61:876-885.
[17]杨利军,杨涛,解军,等.重组Echistatin融合基因工程菌高密度发酵工艺优化[J].中国生物制品学杂志,2006,19(1):84-86.
[18]汪立平,刘玉佩,孙晓红,等.褐藻胶裂解酶基因在大肠杆菌中的表达及其酶学性质[J].食品与生物技术学报,2012,31(2):190-194.
[19]陈坚,堵国成,张东旭.发酵工程实验技术[M].北京:化学工业出版社,2009:209.
[20]秦建侯,邓勃,王小芹,等:分析测试中的实验设计和优化方法[J].分析实验室,1986,5(1):50-56.
[21]宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1997,72-81.
[22]Preiss J,Ashwell G.Alginic acid metabolism in bacteria.I.Enzymatic formation of unsaturated oligosaccharides and 4-deoxy-L-erythro-5-hexoseulose uronic acid[J].Biochem,1962,237:309-316.
[23]凌沛学,张天民.透明质酸[M].北京:中国轻工业出版社,2000:44-45.
[24]王英臣.菌体比生长速率的酒精发酵动力学研究[J].酿酒科技,2009,135(9):48-51.
[25]褚以文.微生物培养基优化方法及其OPTI优化软件[J].国外医药抗生素分册,1999,20(2):58-60,66.

