滑子菇多糖超声辅助提取工艺及抗氧化活性评价
贺 婷,向 莹,陈 健
(华南理工大学轻工与食品学院,广东广州510640)
滑子菇(Pholiota nameko)又名珍珠菇、真姬菇,属于担子菌纲,原产于日本,自七十年代中叶,始于辽宁省南部地区,现主产区为河北北部、辽宁、黑龙江等地。滑子菇菌盖淡黄色到黄褐色,边缘略淡,由于子实体表面附有粘液,手摸粘滑,故以滑子菇得名。多糖是滑子菇重要的活性成分,具有增强免疫力和抗肿瘤等生物活性[1]。最常用提取多糖的方法是热水浸提法[2],但是这种提取方法具有时间长、温度高等缺点。超声能够加速细胞的破碎,传质强化,促进渗透和毛细血管效应[3],因此可以加快多糖的提取和生物活性物质的提取[4-6]。本文采用超声波提取和热水浸提法结合的方式进行提取多糖即超声辅助提取。在单因素实验的基础上,采用正交实验优化多糖最佳提取工艺,并采用对DPPH·、·和OH·的清除能力以及还原能力实验评价其体外抗氧化活性。
1 材料与方法
1.1 材料与仪器
滑子菇 广州一德路干货市场;二苯基苦味酰基苯肼(DPPH)Sigma公司;无水乙醇、丙酮、H2O2、FeSO4·7H2O、水杨酸、铁氰化钾、FeCl3、KBr、葡萄糖、苯酚和浓硫酸等试剂 均为国产分析纯。
KDC-40低速离心机 科大创新股份有限公司中佳分公司;电子天平 上海精密科学仪器有限公司;HHS电热恒温水浴锅 上海博讯实业有限公司医疗设备厂;UV-5200型紫外/可见分光光度计 上海元析仪器有限公司生产;Vector 33型傅里叶变换红外光谱仪 德国Bruck公司生产。
1.2 实验方法
1.2.1 滑子菇多糖的提取工艺 滑子菇→粉碎→60目筛→超声波处理→恒温水浴提取→离心→过滤→浓缩→烘干得滑子菇多糖(粗品)
1.2.2 多糖含量与提取率的测定 苯酚-硫酸法[7]。
1.2.2.1 葡萄糖标准曲线的绘制 精确称取在105℃干燥至恒质量的葡萄糖标准样品2g,定容于1000mL容量瓶中,得到质量浓度为2g/L的标准溶液。准确吸取0、0.1、0.2、0.4、0.6、0.8 和 1.0mL 的标准溶液于试管中,分别加入蒸馏水补足到1mL,然后再分别加入6%的苯酚1mL和浓硫酸5mL,充分摇匀后冷却。以不加样品作为空白对照,在490nm处分别测量吸光值,以葡萄糖质量为横坐标,吸光值为纵坐标,绘制出标准曲线,并进行线性回归,得回归方程:y=1.1991x-0.0014,R2=0.9994。
1.2.2.2 样品含量测定 准确称取滑子菇多糖(PNP)10mg,定容于50mL容量瓶中,吸取0.4mL样品溶液,再依次加入苯酚溶液和浓硫酸,振荡摇匀,冷却后在490nm处测吸光度,计算样品溶液多糖的含量。
1.2.2.3 样品多糖得率的计算 多糖得率(%)=糖浓度×体积×稀释倍数/样品质量×100。
1.2.3 影响多糖得率的因素
1.2.3.1 超声波频率对多糖得率的影响 称2g滑子菇粉末5份,按1∶20的料液比加入40mL蒸馏水,分别依次考察在40、60、70、80、100Hz 超声频率下超声10min,然后在80℃下水浸提2h,测定多糖得率,求取平均值。
1.2.3.2 超声波振荡时间对多糖得率的影响 称2g滑子菇粉末5份,按1∶20的料液比加入40mL蒸馏水,在80Hz超声频率下分别超声 5、10、15、20、25min后,在80℃下水浸提2h,测定多糖得率,求取平均值。
1.2.3.3 液料比对多糖得率的影响 称2g滑子菇粉末 5 份,按 10∶1、15∶1、20∶1、25∶1、30∶1 的液料比分别加入20、30、40、50、60mL 蒸馏水,在 80Hz超声频率下超声10min,然后在80℃下水浸提2h,测定多糖得率,求取平均值。
1.2.4 多糖提取工艺的优化 采用正交实验法:选用超声频率(A)、超声时间(B)、料液比(C)三个因素,每个因素三个水平,进行L9(34)正交实验,因素水平见表1。

表1 正交实验因素水平表Table 1 Factors and levels in orthogonal test
1.2.5 抗氧化活性测定
1.2.5.1 清除DPPH自由基的测定[8-9]取样品不同浓度提取液0.6mL,分别加入0.1mmol/L DPPH溶液2.0mL,混匀在25℃下密闭静置25min,用蒸馏水作参比,于517nm波长下测定吸光度。根据公式计算不同浓度提取液对DPPH自由基的清除率:
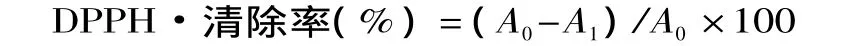
式中,A1为加提取液后DPPH溶液的吸光度;A0为未加提取液时DPPH溶液的吸光度。
1.2.5.2 清除O-2·的测定 50mmol/L Tris-HCl缓冲液1.84mL,加入0.4mL的样品和0.16mL邻苯三酚溶液,摇匀,4min后加 8mmol/L的 HCl终止剂0.4mL。在325nm下立即测定吸光度。根据公式计算多糖对·的抑制率:

式中,A1为加提取液的吸光度;A0为未加提取液时吸光度。
1.2.5.3 清除·OH的测定 参考Nicholas&Quinton[10]并做修改,试管中依次加入 1mL FeSO4(9mmol/L)与1mL不同浓度提取液样品和1mL水杨酸(9mmol/L)混匀后,37℃水浴静置10min,加入6mmol/L H2O21mL,37℃ 水浴静置 30min后,在510nm测定吸光度A1;不加提取液样品,以去离子水补足,同上操作处理,测定其对比吸光度A0;用去离子水为参比。根据公式计算每种提取液对·OH的清除率:

1.2.5.4 还原能力测定[11]在0.6mL pH6.6磷酸缓冲溶液(200mmol/L)中加入0.6mL提取物溶液,2.5mL 1%铁氰化钾,混合物在 50℃恒温,保温20min,急速冷却,加0.6mL 10% 三氯乙酸,离心分离10min。取上层清液1mL,加入1mL水,再加入0.2mL 0.1%FeCl3,混合均匀,静置10min后在波长700nm下测吸光值,值越大,则样品的还原力越强。
2 结果与讨论
2.1 单因素实验结果及分析
2.1.1 超声波频率的影响 在超声时间为10min时,液料比为20∶1,分别采用不同的超声频率40、60、70、80、100Hz进行辅助提取。测定滑子菇多糖的得率,结果如图1所示。由图1可知,随着超声频率的增大,多糖得率逐渐增多。其原因可能是随频率的增加,产生的冲击力、剪切力也增大,使多糖溶出率增加。当频率为80Hz时,多糖的得率上升幅度趋于平缓。超声频率越大,超声波与媒质相互作用的热学机制和空化机制[12-13]使得多糖分子会发生分解。因此,选用80Hz为最佳频率。

图1 超声频率对多糖得率的影响Fig.1 Effect of ultrasonic rate on polysaccharide yield
2.1.2 超声时间的影响 在超声频率为80Hz,液料比为 20∶1,分别采用不同超声时间 5、10、15、20、25min进行辅助提取。从图2中可以看出随着超声时间的延长,滑子菇多糖的得率先升后降;在前10min多糖的得率随时间增加上升较快,这是由于随超声时间延长,细胞破碎度加大,内部的多糖物质开始溶出,得率升高;在10~25min之间,随时间的增加下降幅度较小,其原因可能是超声时间延长,超声过程中不断产生热量使糖降解[14]。因此,选择超声时间10min为最佳。
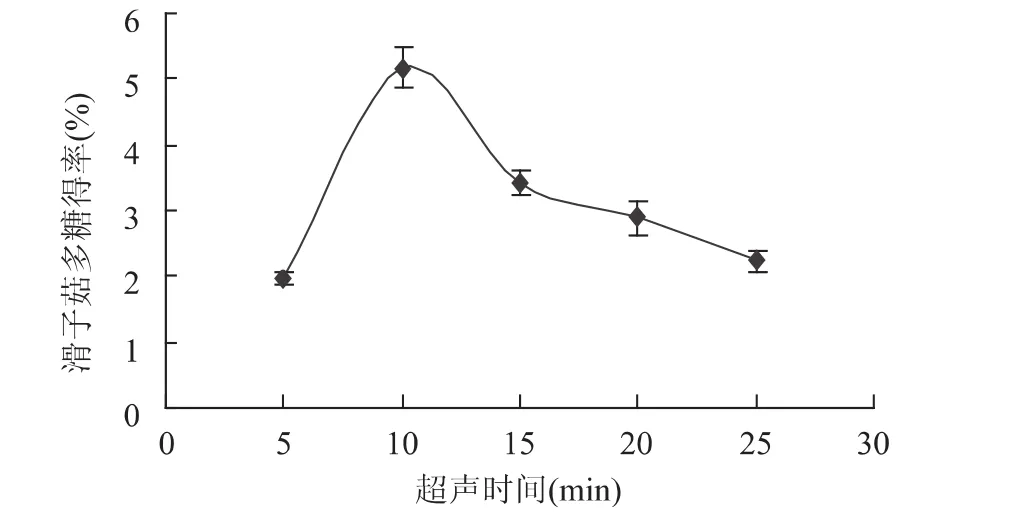
图2 超声时间对多糖得率的影响Fig.2 Effect of ultrasound treatment time on polysaccharide yield
2.1.3 液料比的影响 在超声时间10min,频率为80Hz下,改变蒸馏水体积与滑子菇粉末质量的比,考察不同液料比对多糖得率的影响。由图3可以看出,随着液料比的增大,多糖的得率增大。但当液料比大于20∶1后,多糖得率下降。这可能是过多的提取剂破坏滑子菇细胞,使细胞膜受到损害,造成细胞液或其他成分溶出,导致多糖得率下降。所以,液料比选择 20∶1。

图3 液料比对多糖得率的影响Fig.3 Effect of liquid/material ratio on polysaccharide yield
2.2 正交实验结果及分析
在单因素预实验的基础上,利用正交实验,得出不同超声频率(A)、超声时间(B)、液料比(C)组合提取滑子菇多糖得率如表2所示。
由表2分析表明,以水为溶剂超声辅助提取滑子菇多糖,最佳搭配组合为 A3B2C1,即超声频率为80Hz、超声时间 15min、液料比为 15∶1,多糖得率为10.791%;其次是A3B3C2,多糖得率为9.912%。从表2中K1、K2和K3可以看出,在各因子的水平中,分别以 A3(80Hz)、B2(15min)、C2(20∶1)为最佳水平,按该水平即A3B2C2进行实验进行进一步的验证。实验结果多糖得率为11.219%,高于组合A3B2C1,因此,超声辅助提取滑子菇多糖的最佳提取工艺条件为A3B2C2,,即为以液料比为 20∶1,在 80Hz 下,超声15min。

表2 超声辅助提取正交实验结果Table 2 Orthogonal experiment of ultrasonic synergistic extraction and results
由表3方差分析表表明,超声频率为主要因子,其不同水平对滑子菇多糖的提取影响最大;其次是超声时间,为次要因子;而液料比的影响最小。
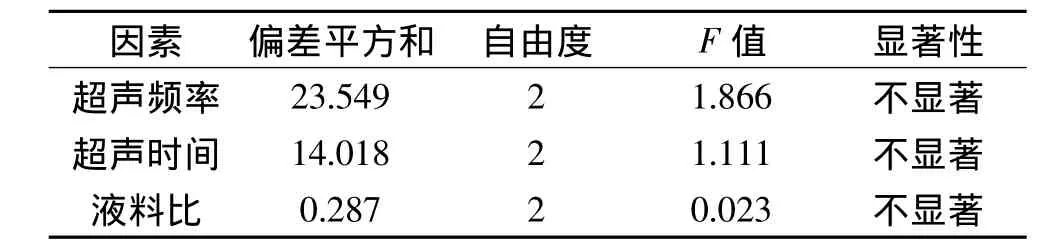
表3 方差分析表Table 3 Analysis of variance
2.3 抗氧化活性
从图7可以看出,随着粗多糖浓度的增加,多糖的还原能力逐渐增强。还原能力是表示抗氧化物质提供电子能力的重要指标,提供可阻断Fe2+向Fe3+转变的电子;多糖的分子链中活性的羟基提供电子或氢原子的能力强,与自由基充分作用,表现出抗氧化活性[17]。VC浓度在0.8mg/mL时,还原能力可与PNP浓度在10mg/mL相比。
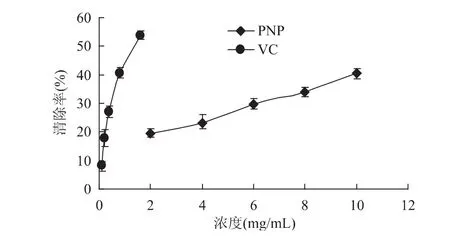
图4 不同浓度多糖对DPPH·的清除活性Fig.4 DPPH·scavenging capability of different polysaccharide

图5 不同浓度多糖对·OH的清除活性Fig.5 ·OH scavenging capability of different polysaccharide
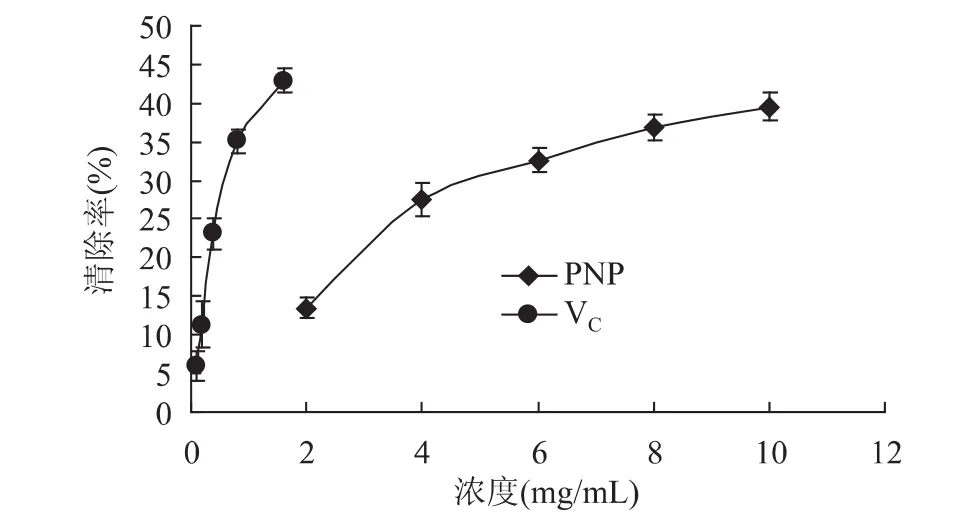
图6 不同浓度多糖对·的清除活性Fig.6 scavenging capability of different polysaccharid

图7 不同浓度多糖的还原能力Fig.7 Reducing power of different polysaccharide
3 结论
通过正交实验,确定超声辅助提取滑子菇多糖的最佳提取条件是:超声频率为80Hz、超声时间为15min以及液料比为20∶1,在此工艺条件下多糖的得率为11.219%。3个因素对多糖得率的影响程度不同,其中超声频率影响最明显,其次是超声时间,而液料比对提取得率影响不大。粗多糖对DPPH·、·和·OH都有一定的清除活性,有量效关系,清除·OH活性最高,清除·活性最低,通过自由基清除活性实验证明该多糖具有一定的抗氧化活性。
[1]朱建华.食用菌栽培技术[M].北京:中国计量出版社,1999,1071-1073.
[2]YONGOOKKIM,SANG BAEHAND,HONGWOEN LEE,et al.Immune-stimulating effect of the endo-polysaccharide produced by submerged culture of Inonotus obliquus[J].Life Sciences,2005,77:2438-2456.
[3]I Yasuo,T Toru,Y Kyuichi,et al.Control of viscosity in starch and polysaccharide solutions with ultrasound after gelatinization[J].Food Sci Emerg Technol,2008(9):140-146.
[4]M Salisova,S Toma,T J Masor.Comparison of conventional and ultrasonically assisted extractions of pharmaceutically active compounds from Salvia officinalis[J].Ultrason Sonochem,1997(4):131-134.
[5]Z Hromádková,A Ebringerová,P Valachovic'.Comparison of classical and ultrasound-a ssisted extraction of polysaccharides from Salvia officinalis[J].Ultrasonics Sonochemistry,1999(5):163-168.
[6]A Ebringerová,Z Hromádková.Effect of ultrasound on the extrac tibility of corn bran hemicell uloses[J].Ultrasonics Sonochemistry,2002(9):225-229.
[7]孙素兰,俞励平.叶青山超声波法提取灵芝袋泡茶多糖的实验研究[J].食品与药品,2006,8(1):52-54.
[8]Cuendet M,Hostettmann K,Potterat O.Iridoid glucosides with free radical scavenging properties from Fagraea blumei[J].Helvetica Chimica Acta,1997,80:1144-1152.
[9]Srivastava A,Harish S R,Shivanandappa T.Antioxidant activity of the roots of Decalepis hamiltonii(Wight& Arn.)[J].LWT,2006,39:1059-1065.
[10]Nicholas S,Quinton J C.Hyroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
[11]Halliwell B,Gutteridge J M C.Role of free radicals and catalytic metal ions in human disease:an overview[J].Methods in Enzymology,1990,186:1-85.
[12]Cengiz S,Bektas T,Mustafa Y.Evaluation of the antioxidant activity of four edible mushrooms from the Central Anatolia,Eskisehir-Turkey:Lactarius deterrimus,Suillus collitinus,Boletus edulis,Xerocomus chrysenteron[J].Bioresource Technology,2008,99:6651-6655.
[13]Mircea Vinaturo.An overview of the ultrasonically assisted extraction of bioactive principles from herbs[J].Ultrasonics Sonochemistry,2001(8):303-313.
[14]郑静,常滔,林英,等.超声波法和超声波酶法提取灵芝多糖的条件研究[J].食用菌学报,2006,13(1):48-52.
[15]Duh P D,Tu Y Y,Yen G C.Antioxidant activity of water extract of Harng Jyur(Chrysanthemum mo rifolium Ramat)[J].Lebensmittel Wissenschaft and Technologie,1999,32:269-277.
[16]Yuan H,Zhang W,Li X,et al.Preparation and in vitro antioxidant activity of jcarrageenan oligosaccharides and their oversulfated,acetylated,and phosphorylated derivatives[J].Carbohydrate Research,2005,340:385-692.
[17]姚倩,孙涛,徐轶霞,等.壳聚糖/壳寡糖衍生物的制备及其抗氧化性能研究[J].食品与生物技术学报,2009,28(2):188-189.

