逆境对红酵母发酵生产类胡萝卜素的促进作用
史馨怡 刘丹 陈黎黎 陈欣
(江苏科技大学生物与化学工程学院,镇江 212018)
类胡萝卜素(Carotenoids)是一类呈黄色、橙红色或红色的多烯类化合物,主要包括β-类胡萝卜素、虾青素、叶黄素和蕃茄红素等[1-3]。类胡萝卜素广泛存在于细菌、藻类、真菌和植物中,具有重要的生理保健功能,如吸收光能、保护光合作用系统、屏障紫外线、清除自由基以及稳定色素蛋白的功能构型等[1-4]。
国内外已报道的类胡萝卜素高产菌株主要有三孢布拉氏霉(Blakesle a trispora)和红酵母(Rhodotorulasp.)。三孢布拉氏霉发酵产率虽然较高,但存在发酵技术工艺复杂、发酵周期长、成本高等缺点;而红酵母生长对营养要求较简单,发酵工艺易于调控,培养周期短,菌体可综合利用,且属于我国饲料行业12种确认的饲用微生物,发酵过程易于产业化,因而具有较高的应用价值和开发前景[1]。目前对红酵母发酵生产类胡萝卜素的研究主要集中在对菌株筛选、培养基和发酵条件的优化以及类胡萝卜素的分离提取等方面[1,5-7],菌体中类胡萝卜素含量可达到35 mg/g DCW[8],发酵的最高产量也已超过100 mg/L[7]。近年来利用代谢工程改造菌株进行发酵生产类胡萝卜素的报道也逐渐增多,而利用逆境条件增加类胡萝卜素发酵的研究较为少见。研究发现,酵母细胞中类胡萝卜素的含量会受到培养环境的影响,南极嗜冷菌在5℃培养时类胡萝卜素含量比在25℃培养时有明显增加[10,11],这是因为在低温环境中,类胡萝卜素与膜结合可以增加膜的流动性[2,12,13];在酸处理条件下,酵母细胞利用胞内大量的氨基酸合成胁迫响应蛋白,造成胞内氨基酸匮乏,而胞内氨基酸的匮乏会引起胞内氧自由基的积累[14],酵母细胞能通过增加类胡萝卜素的合成来消除胞内氧自由基[2,15];细胞中的类胡萝卜素还能清除活性氧(Reactive oxygen species,ROS)或通过与其他抗氧化剂如维生素E或维生素C的协同作用,增加其在干旱、高盐等环境中的抗逆性[16]。
本文研究了低温、低温处理时间、酸处理和高盐处理及其交互作用对一株红酵母发酵生产类胡萝卜素影响,旨在为红酵母对低温、高盐和酸处理的生理应答机制的解析提供理论依据,同时对利用红酵母发酵生产类胡萝卜素也具有一定的指导意义。
1 材料与方法
1.1 材料
1.1.1 菌株与试剂 红酵母(Rhodotorulasp.),江苏科技大学生物工程实验室保存。葡萄糖、蛋白胨、酵母膏:分析纯,均为国药集团化学试剂有限公司。
1.1.2 仪器与设备 SW-C-J-1F超净工作台(苏州安泰空气技术有限公司);310P-03精密台式pH计(上海杰晟科学仪器有限公司);YXQ-SC41-280A手提式压力蒸汽灭菌锅(上海核子仪器厂);UV-9100紫外/可见光分光光度计(北京瑞利分析仪器公司);TGL-16G高速台式离心机(上海安亭科学仪器厂);202-00干燥箱(北京化玻联医疗器械有限公司);FLY-211B卧式大容量全温培养振荡器(上海申贤恒温设备厂)。
1.2 方法
1.2.1 培养基 斜面培养基(g/L):YEPD培养基,酵母膏 10,蛋白胨 20,葡萄糖 20,琼脂粉 2%(W/V),pH自然,121℃,15 min灭菌。发酵培养基:同斜面培养基。
1.2.2 不同逆境条件处理方法 在500 mL的三角瓶中配制发酵培养基,每瓶装液量为100 mL,用接种环接入斜面培养基活化的红酵母菌株1环,于30℃摇床200 r/min振荡培养。对低温(15℃)处理不同时间的试验开始于(120-t)h,其他试验于培养菌浓度至OD600nm=2.0时进行。分别考察不同低温(控制T=5、10、15、20、25、30℃直至发酵结束)、低温(15℃)处理不同时间(t=12、24、36、48、60、72 h)、高盐处理(一次性加入灭菌的NaCl使其在发酵液中的浓度分别为1、2、3、4、5 mol/L),以及酸处理(一次性加入2 mol/L的HCl溶液,使发酵液pH分别为2.0、2.5、3.0、3.5、4.0、4.5)对发酵的影响。发酵至120 h结束,进行类胡萝卜素含量及生物量(DCW)的测定,每个处理3个重复,同时以不接菌发酵液为空白对照。
1.2.3 不同逆境条件处理对红酵母发酵生产类胡萝卜素的影响 选择低温(T)、低温处理时间(t)、高盐和酸处理4种因素进行研究,每个因素3个水平(表1),确定Box-Behnken设计的自变量,以类胡萝卜素产量为响应值,通过响应曲面分析(Response surface analysis,RSA)考察4种逆境条件之间的交互作用。
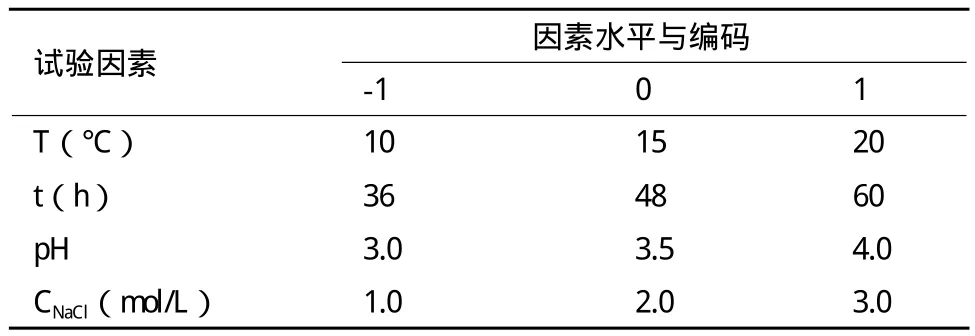
表1 响应面分析因素与水平
1.2.4 检测方法 将发酵液转入离心管中,8 000 r/min离心10 min,弃上清液,菌体用无菌水洗后再离心,65℃左右烘干至恒重计算DCW。
类胡萝卜素含量检测方法及产量计算方法参照文献[1] 进行。准确称取菌体0.1 g和石英砂0.05 g,充分研磨,加入6 mL丙酮:石油醚=11(VV)的混合液,28℃振荡浸提30 min,然后8 000 r/min离心15 min,上清液即为胡萝卜素浸提液。
类胡萝卜素含量(μg/g干基)=(Aλmax×D×V)/(0.16×W)
式中:Aλmax为类胡萝卜素浸提液最大波长处的吸光度;D为色素浸提液稀释倍数;V为浸提所用丙酮和石油醚的总体积(mL);W为提取所用的发酵培养物重量(g);0.16为胡萝卜素的摩尔消光系数。
类胡萝卜素产量计算方法参照公式:
类胡萝卜素产量(mg/L)=生物量×类胡萝卜素含量
2 结果
2.1 温度对红酵母发酵生产类胡萝卜素的影响
由图1可以看出,随着温度(T)的增加,生物量(DCW)逐渐增加,当T为30℃时,DCW达到最高值17.46 g/L,说明T升高能促进细胞生长,低温不利于细胞生长。由于类胡萝卜素对微生物膜流动性的调节具有重要,所以低温能增加细胞类胡萝卜素含量,类胡萝卜素含量随着T的升高呈现先上升后下降的趋势,在T为15℃时,类胡萝卜素含量达到最高值1.31 mg/g DCW。类胡萝卜素产量与DCW和类胡萝卜素含量都相关,温度高能增加DCW,但类胡萝卜素含量较低,而温度低时DCW较低,但类胡萝卜素含量高。随着T的增加,类胡萝卜素产量呈现先上升后下降的趋势,在T为15℃时,类胡萝卜素产量达到最高值19.07 mg/L。

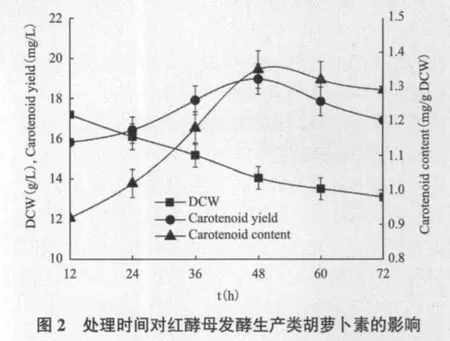
2.2 处理时间对红酵母发酵生产类胡萝卜素的影响
由图2可以看出,随着低温处理时间(t)的增加,DCW逐渐降低,当t为72 h时,DCW达到最低值13.09 g/L,而t为12 h时,DCW的最高值17.18 g/L,说明t值越大对细胞生长影响越大,低温处理不利于细胞的生长。类胡萝卜素含量随着处理时间的延长呈现先上升后略有下降的趋势,在t为48 h时,类胡萝卜素含量达到最高值1.35 mg/g DCW;继续延长处理时间,可能由于类胡萝卜素合成途经相关的酶活性受到影响因而类胡萝卜素含量出现了下降。由于类胡萝卜素产量受到DCW和类胡萝卜素含量的影响,延长t能增加类胡萝卜素含量,但DCW降低,而减少t时DCW增加,但类胡萝卜素含量降低,随着t的增加,类胡萝卜素产量亦呈现先上升后下降的趋势,在t为48 h时,类胡萝卜素产量达到最高值18.95 mg/L。
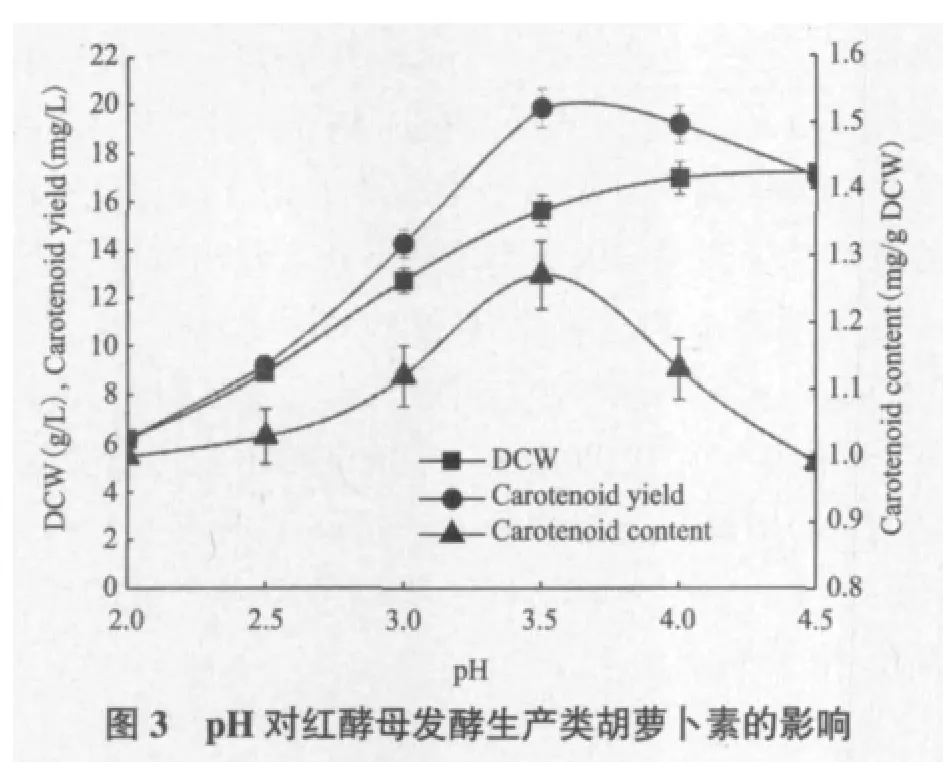
2.3 酸处理对红酵母发酵生产类胡萝卜素的影响
由图3可以看出,随着pH的增加,DCW逐渐增加,当pH为2.0时,DCW仅为6.22 g/L,当pH为4.5时,DCW达到最高值17.12 g/L,说明酸处理对菌体生长不利,pH较低不利于细胞的生长。由于酸处理条件下红酵母细胞会增加类胡萝卜素的合成来替代SOD行使抗氧化功能而保护细胞,所以当pH降低时红酵母的类胡萝卜素含量将增加,类胡萝卜素含量随着pH的升高呈现先上升后下降的趋势,在pH为3.5时,类胡萝卜素含量达到最高值1.27 mg/g DCW;pH较低时,可能由于类胡萝卜素合成途经相关的酶活性受到影响因而类胡萝卜素含量出现了下降。随着pH的增加,类胡萝卜素产量亦呈现先上升后下降的趋势,在pH为3.5时,类胡萝卜素产量达到最高值19.79 mg/L。
2.4 高盐处理对红酵母发酵生产类胡萝卜素的影响
由图4可以看出,随着NaCl浓度(CNacl)的增加,DCW呈现先略有上升后明显下降的趋势,当CNaCl为1.0 mol/L时,DCW达到最高值17.46 g/L,而CNaCl为5.0 mol/L时,DCW仅为4.46 g/L,说明CNaCl的增加能提供细胞生长需要的无机盐而增加DCW,但过高的CNaCl造成较高的渗透压影响了细胞的生长。由于红酵母在高盐的条件下会增加类胡萝卜素的合成,所以增加CNaCl能增加细胞类胡萝卜素含量,但过高的CNaCl可能通过影响类胡萝卜素合成途经相关的酶活性而使类胡萝卜素合成受到影响,所以过高的CNaCl也不利于类胡萝卜素含量的增加。类胡萝卜素含量随着CNaCl的增加呈现先上升后下降的趋势,在CNaCl为2.0 mol/L时,类胡萝卜素含量达到最高值1.24 mg/g DCW;CNaCl继续升高为5.0 mol/L时,类胡萝卜素含量降低到最低值0.98 mg/g DCW。由于类胡萝卜素产量受到DCW和类胡萝卜素含量的影响,随着CNaCl的增加,类胡萝卜素产量亦呈现先上升后下降的趋势,在CNaCl为2 mol/L时,类胡萝卜素产量达到最高值19.86 mg/L。
2.5 不同逆境条件处理对红酵母发酵生产类胡萝卜素的影响
根据Box-Behnken优化设计的4因素3水平实验方案,并以变量X1、X2、X3和X4分别代表T、t、pH及CNaCl,结果见表2。
通过Design Expert 7.0软件进行二次响应面回归分析,得到多元二次响应面回归模型:Y=27.02-0.52X1-0.021X2+0.52X3+0.49X4-0.11X1X2+0.77X1X3-0.82X1X4-0.83X2X3+0.057X2X4+0.10X3X4-5.76X12-4.47X22-3.18X32-2.21X42,其决定系数R2= 0.9845,试验值与预测值非常接近。方差分析表明,以上回归方程较好地拟合了试验数据。

由方差分析结果(表3)可知,上述回归方程描述了各因子与响应值之间线性关系显著性,由F值检验来判定,概率P值越小,则其相应变量的显著性越高。T,pH、CNaCl的影响以及T-pH、T-CNaCl和t-pH的交互作用对类胡萝卜素产量的影响均显著(P>F值分别为0.011 8,0.011 8,0.015 8,0.025 3,0.018 8,0.017 1)。t,T-T,t-CNaCl,pHCNaCl对类胡萝卜素产量的影响不显著(P>F值分别为0.908 6、0.726 8,0.854 9和0.738 7)。Model的P>F值<0.000 1,表明该二次方程模型达到极显著水平,失拟相=1.06>0.05,表明失拟项相对于绝对误差不显著,说明该方程对试验拟合较好。相关系数r=338.30/343.63×l00%=98.45%,说明响应值的变化有98.45%来源于所选变量,可以用此模型对类胡萝卜素产量进行分析。
响应面图形是响应值对各试验因子X1、X2、X3、X4。所构成的三维空间的曲面图,从响应面分析图上形象地看出最佳参数及各参数之间的相互作用。本试验根据回归方程进行不同因子的响应面分析,结果如图5示。从图5可以看出,在t为48 h,CNaCl为2.0 mol/L时,T与pH的交互作用对类胡萝卜素产量影响显著,T与pH的提高可以增加类胡萝卜素产量,但T要随着pH的变化而有所变化,因为过高的处理温度会影响类胡萝卜素含量,过低的pH也会影响DCW,从而影响类胡萝卜素产量。
在t为48 h,pH为3.5时,T与CNaCl的交互作用对类胡萝卜素产量影响显著,T与CNaCl的提高可以增加类胡萝卜素产量。但T要随着CNaCl的变化而有所变化,因为过高的处理温度会影响类胡萝卜素含量,过高的CNaCl也会影响DCW从而影响类胡萝卜素产量。

表2 响应面分析方案及试验结果
在T为15℃,CNaCl为2.0 mol/L时,t与pH的交互作用对类胡萝卜素产量影响显著,t与pH的提高可以增加类胡萝卜素产量,但t要随着pH的变化而有所变化,因为t的增加以及过低的pH会影响DCW,过高的pH也会影响类胡萝卜素含量从而影响类胡萝卜素产量。
利用Design-Expert 7.0计算得到类胡萝卜素发酵的最佳条件为:T=14.76℃,t=47.91 h,pH=3.54,CNaCl=2.12 mol/L,类胡萝卜素产量的理论最高值为27.08 mg/L。在该条件下重新进行3次重复试验,得到类胡萝卜素产量为(31.04±0.89)mg/L,高于试验中的最高值28.10 mg/L,说明采用响应面分析法优化得到的类胡萝卜素发酵条件参数准确可靠,具有一定的实用价值。
3 讨论
类胡萝卜素广泛存在于细菌、藻类、真菌和植物中,具有重要的生理保健功能。由于动物及人体自身无法合成类胡萝卜素,因而常被作为饲料、保健食品的添加剂。目前,通过大面积养殖盐藻获得类胡萝卜素的方法最为成熟,但盐藻的养殖对培养条件要求较高。利用红酵母发酵生产类胡萝卜素具有安全、成本低等优点因而备受关注。在前期的研究中,经过对培养基的优化,该菌株类胡萝卜素含量达到0.52 mg/g DCW,发酵最高产量达到11.61 mg/L[1]。由于低温、高盐度、酸处理等逆境有利于类胡萝卜素的合成,为了进一步提高类胡萝卜素产量,考察了低温、低温处理时间、酸处理及高盐处理对该菌株发酵生产类胡萝卜素的影响。在此基础上利用响应面分析法进一步优化培养条件,类胡萝卜素产量达到31.04 mg/L,较不利用逆境条件处理时(11.61 mg/L)提高了2.67倍,类胡萝卜素含量也显著提高。目前国内利用红酵母发酵生产类胡萝卜素报道的产量大多较低(6-30 mg/L),菌体中类胡萝卜素含量也不高(一般低于1.0 mg/g DCW)[5,6],而利用逆境培养条件增加类胡萝卜素发酵的研究较为少见,通过将菌体在逆境条件下培养,类胡萝卜素含量和产量均明显提高,若在此基础上利用流加及高密度发酵等策略进一步增加类胡萝卜素的产量,将有望达到或超过国外类胡萝卜素发酵的最高水平。
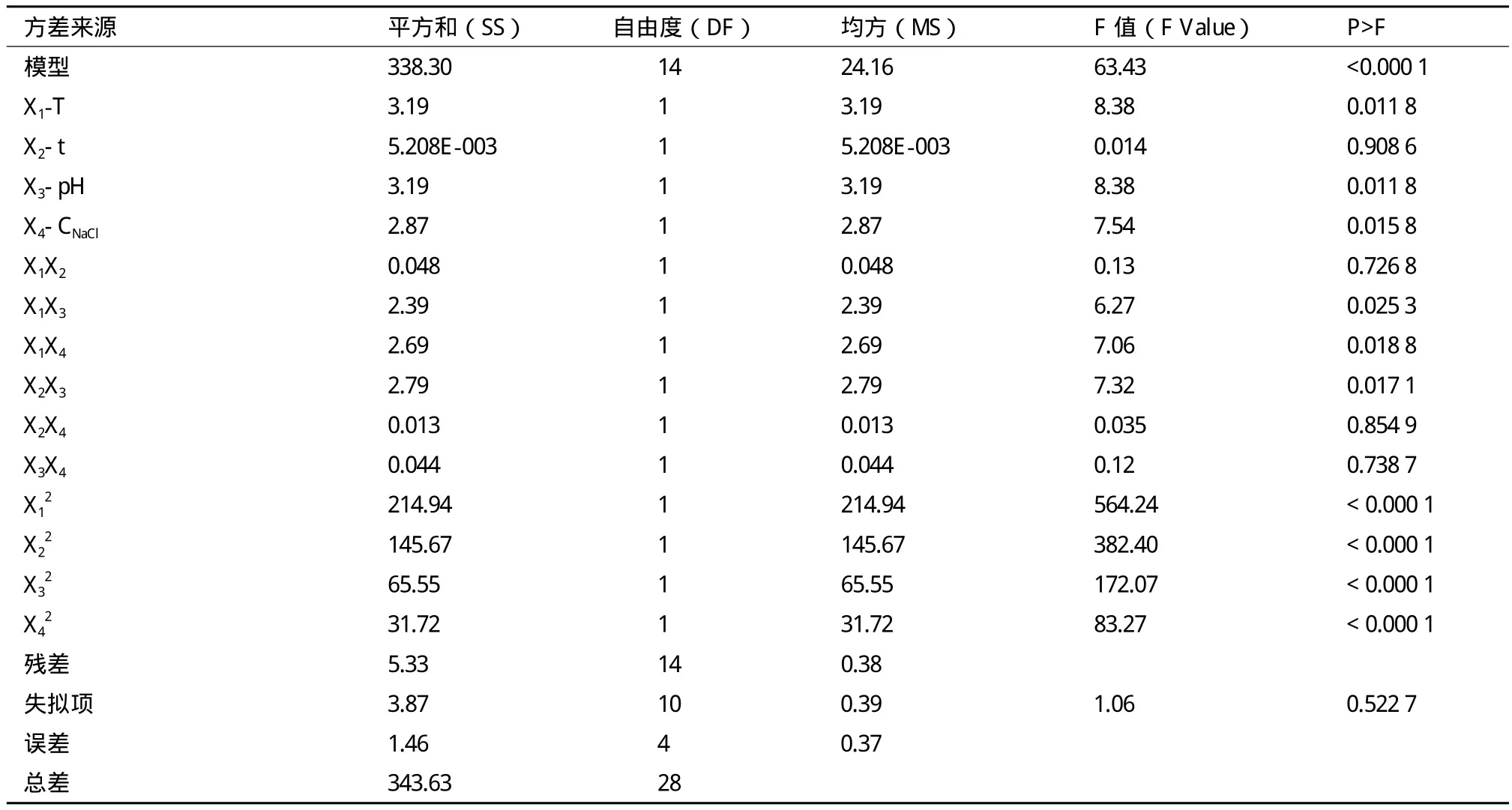
表3 二次响应面回归模型方差分析
4 结论
本研究考察了低温、低温处理时间、酸处理及高盐处理对一株红酵母(Rhodotorulasp.)发酵生产类胡萝卜素的影响,在此基础上并利用响应面分析方法研究了其交互作用。结果表明,在温度为15℃条件下处理48 h,pH3.5,NaCl浓度为2 mol/L的条件下,类胡萝卜素最高产量达到31.04 mg/L,说明逆境对红酵母发酵生产类胡萝卜素具有促进作用。
[1] 陈欣. 红酵母发酵产类胡萝卜素条件的优化[J] . 食品科学,2009, 30(15):176-179.
[2] Gruszecki WI, Strzalka K. Carotenoids as modulators of lipid membrane physical properties[J] . Biochim Biophys Acta, 2005,1740(2):108-115.
[3] Garrido-Fernandez J, Maldonado-Barragan A, Caballero-Guerrero B,et al. Carotenoid production inLactobacillus plantarum[J] . Int J Food Microbiol, 2010, 140(1):34-39.
[4] Edge R, El-Agamey A, Land EJ, et al. Studies of carotenoid oneelectron reduction radicals[J] . Arch Biochem Biophys, 2007, 458(2):104-110.
[5] 唐棠, 黄乾明, 杨群峰. 红酵母Y-5 产类胡萝卜素培养基无机盐组分的优化[J] . 食品科学, 2011, 32(3):130-133.
[6] 刘卉琳, 刘绍, 兰时乐, 等. 红酵母的鉴定及其固态发酵产类胡萝卜素的研究[J] . 食品科技, 2011, 36(6):9-13.
[7] Saenge C, Cheirsilp B. Potential use of oleaginous red yeastRhodotorula glutinisfor the bioconversion of crude glycerol from biodiesel plant to lipids and carotenoids[J] . Process Biochem, 2012, (46):210-218.
[8] Aksu Z, Tugba Eren A. Carotenoids production by the yeastRhodotorula mucilaginosa:use of agricultural wastes as a carbon source[J] . Process Biochem, 2005, 40:2985-2991.
[9] Yuan L, Rouvière P, LaRossa R, et al. Chromosomal promoter replacement of the isoprenoid pathway for enhancing carotenoid production inE. coli[J] . Metab Eng, 2006, 8:79-90.
[10] Subczynski WK, Markowska E, Gruszecki WI, et al. Effects of polar carotenoids on dimyristoyl-phosphatidylcholine membranes:a spin-label study[J] . Biochim Biophys Acta, 1992, 1105(1):97-108.
[11] Chattopadhyay MK, Jagannadham MV, Vairamani M, et al.Carotenoid pigments of an antarctic psychrotrophic bacteriumMicrococcus roseus:temperature dependent biosynthesis, structure,and interaction with synthetic membranes[J] . Biochem Biophys Res Commun, 1997, 239(1):85-90.
[12] Schonfeld M, Neumann J. Proton conductance of the thylakoid membrane:modulation by light[J] . FEBS Lett, 1977, 73(1):51-54.
[13] Jagannadham MV, Narayanan K, Rao CM, et al.In vivocharacteristics and localisation of carotenoid pigments in psychrotrophic and mesophilicMicrococcus roseususing photoacoustic spectroscopy[J] . Biochem Biophys Res Commun, 1996, 227(1):221-226.
[14] Suzuki T, Sugiyama M, Wakazono K, et al. Lactic-acid stress causes vacuolar fragmentation and impairs intracellular amino-acid homeostasis inSaccharomyces cerevisiae[J] . J Biosci Bioeng,2012, 113(4):421-430.
[15] Sowmya R, Sachindra NM. Evaluation of antioxidant activity of carotenoid extract from shrimp processing byproducts byin vitroassays and in membrane model system[J] . Food Chemistry,2012, 134(1):308-314.
[16] Kim SH, Ahn YO, Ahn MJ, et al. Down-regulation of betacarotene hydroxylase increases beta-carotene and total carotenoids enhancing salt stress tolerance in transgenic cultured cells of sweetpotato[J] . Phytochemistry, 2012, 74:69-78.

