植物甾醇与胆固醇对脂质体膜性质的影响
杨贝贝,曹 栋,耿亚男,聂新艳
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122)
脂质体是由脂质双分子层组成,内部为水相的闭合囊泡,在模拟生物膜、药物载体、反应微环境中都有广泛应用。目前,国内外制备脂质体,大多会添加一定比例的胆固醇改善脂质体性质。胆固醇可以减慢氧化磷脂的迁移[1],抑制溶血磷脂形成导致的膜渗漏[2]。Smith E A 等[3]研究表明,胆固醇会影响脂质体膜的通透性、分子有序性、弹性、取向性、和分子间的空隙大小。胆固醇还可以调节脂质体膜的流动性,提高脂质体的稳定性[4]。但高胆固醇会引发动脉粥样硬化、冠心病等健康问题,随着人们对健康食品的要求提高,可能会限制脂质体在食品药品中的应用。植物甾醇结构与胆固醇类似,不仅可以影响脂质体膜上磷脂分子聚集,调节膜对小分子物质的通透性[5],改变膜的表面性质[6],还可以减小胆固醇的肠道吸收[7]。本文主要通过研究不同甾醇对卵磷脂脂质体粒径大小、粒径分布、氧化稳定性、流动性、双分子层内部分子极性的影响,探讨植物甾醇能否替代胆固醇改善脂质体的膜性质,促进脂质体在实际工业生产中的应用。
1 材料与方法
1.1 材料与仪器
磷酸氢二钠、磷酸二氢钠、甲醇、三氯甲烷、无水乙醇、胆固醇、硫代巴比妥酸、三氯乙酸、浓盐酸 均为分析纯,国药集团生产;β-谷固醇(>95%)、豆甾醇(>95%) 阿拉丁试剂有限公司;大豆磷脂、大豆植物甾醇 江苏曼氏生物科技有限公司;芘(99.0%)、1,6-二苯基-1,3,5-己三烯(DPH)Sigma-Aldrich公司。
旋转蒸发仪、XMTE-2000 数显恒温水浴锅、SHB-IIIA循环水式多用真空泵 南京予凯仪器设备有限公司;Mettler AL-204电子精密天平 梅特勒-托利多仪器有限公司;F-7000荧光光谱仪 日本Hitach公司;Zetasizer nano ZS纳米粒度仪 英国Malvern公司;KJ-300超声波发生器 无锡市科洁超声电子设备有限公司;WEZ UV-2010紫外可见分光光度计 尤尼柯仪器有限公司;78 HW-1型恒温磁力搅拌器 江苏省金坛市荣华仪器制造有限公司。
1.2 实验方法
1.2.1 脂质体制备 取0.02g大豆卵磷脂,分别加入磷脂摩尔质量0%、5%、15%、25%、50%的甾醇,溶于30mL氯仿/甲醇(2∶1)混合溶液中,放入玻璃珠,45℃、40r/min旋转蒸发1h,在瓶内壁形成一层薄膜。然后用5mL磷酸盐缓冲液(10mol/L,pH7.4)水化脂质薄膜,形成5mL粗脂质悬浮液,磁力搅拌30min,超声15min,得到脂质体悬浊液。
1.2.2 脂质体粒径大小测定 样品槽经样品溶液润洗后,加入脂质体悬浮液,用ZS纳米粒度仪测定粒径大小,测量温度:25℃,分散介质:H2O,平衡时间:60s。分别测定添加不同比例胆固醇的脂质体粒径大小。
1.2.3 膜抗氧化性测定 取30g三氯乙酸,0.75g硫代巴比妥酸加入到200mL 0.25mol/L的盐酸溶液中,微热溶解,然后取5mL混合溶液和1mL的脂质体溶液于试管中,水浴 30min,在 5000r/min下离心10min,取上清液在532nm测定吸光度。分别制备摩尔百分比15%的甾醇-脂质体,在4℃条件下冷藏,用硫代巴比妥酸法测定不同贮藏时间的吸光值变化。
1.2.4 膜微极性的测定 配制4×10-7mol/L芘的丙酮溶液,取0.1mL的芘溶液于试管中,挥发丙酮,加入5mL稀释5倍的不同甾醇-脂质体溶液,超声1h,放置12h,分别在激发波长338nm,发射波长373nm,384nm 时测定荧光强度[8]。
1.2.5 膜流动性的测定 用磷酸盐缓冲液配制2×10-6mol/L的DPH溶液,取1mL DPH溶液加入到5mL稀释5倍的脂质体溶液中,平衡12h,在 λEx=360nm,λEm=430nm时测定荧光强度。按公式P=(F‖-GF⊥)/(F‖+GF⊥)计算偏振度,其中‖代表激发与发射偏振器平行,⊥代表激发与发射偏振器垂直,G为光栅校正因子。已知偏振度越大,流动性越小[9]。制备摩尔百分比15%的甾醇-脂质体,在25℃和55℃下测定偏振度。
2 结果与讨论
2.1 不同浓度甾醇对脂质体粒径的影响
不同粒径大小的脂质体应用范围不同,一般情况下粒径小的脂质体稳定性较好,但由于体积的减小,其包埋的有效成分也会减少。加入甾醇后,脂质体一般会增大,而甾醇与磷脂间的相互作用可以提高脂质体的稳定性。
2.1.1 胆固醇对脂质体粒径的影响 胆固醇-脂质体的粒径大小和分布结果分别如图1、图2所示。
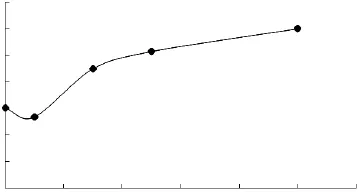
图1 胆固醇含量对脂质体粒径大小的影响Fig.1 Effect of different amount of cholesterol on particle size of liposome
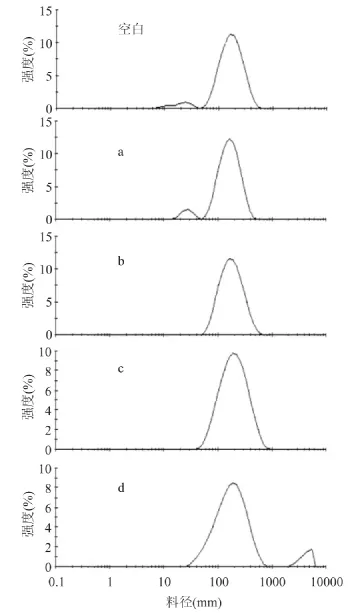
图2 胆固醇-脂质体粒径分布Fig.2 The particle size distribution of cholesterol-liposome
由图1、图2可知,未添加胆固醇的脂质体,粒径分布较宽,在10~100nm处有个分布很宽的小峰;添加5%胆固醇时脂质体粒径减小,分布变较均匀,可能是少量的胆固醇加入,减小了磷脂双分子层之间空隙,从而使得脂质体的粒径略微减小。当胆固醇含量提高到15%,脂质体粒径变大,分布更加均匀,这说明胆固醇较均匀地嵌入,利于脂质体膜的形成。随着胆固醇含量进一步提高,脂质体粒径继续增大,但是分布变的不均匀,说明过多的胆固醇存在又会不均匀地嵌在脂质体膜中。
2.1.2 β-谷固醇对脂质体粒径的影响 β-谷甾醇-脂质体的粒径大小和分布结果分别如图3、图4所示。
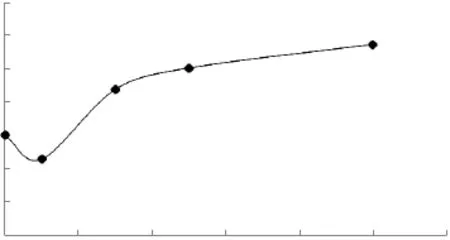
图3 β-谷甾醇醇含量对脂质体粒径大小的影响Fig.3 Effect of different amount of β-sitosterol on particle size of liposome

图4 β-谷甾醇-脂质体粒径分布Fig.4 The particle size distribution of β- sitosterol- liposome
由图3可知,随着β-谷甾醇含量的提高,脂质体粒径大小的变化与胆固醇的影响相似,但是β-谷甾醇-脂质体的粒径增大程度比胆固醇-脂质体的要小;由图4可知,β-谷甾醇-脂质体多分散指数更小,分布的更均匀,这可能是由于β-谷甾醇比胆固醇更好的嵌入双分子层。
2.1.3 豆固醇对脂质体粒径的影响 豆甾醇-脂质体的粒径大小和分布结果分别如图5、图6所示。

图5 豆甾醇含量对脂质体粒径大小的影响Fig.5 Effect of different amount of stigmasterol on particle size of liposome
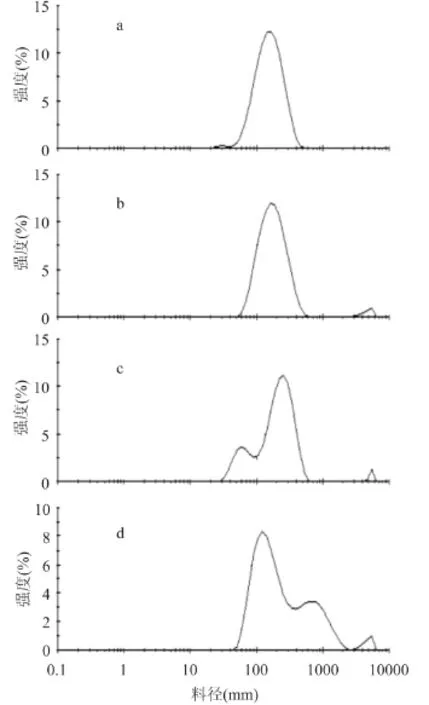
图6 豆甾醇-脂质体粒径分布Fig.6 The particle size distribution of stigmasterol-liposome
由图5、图6可知,随着豆甾醇含量提高,脂质体的粒径逐渐增大,但增大程度比胆固醇与β-谷甾醇的都要高。当豆甾醇摩尔百分比0~15%时,脂质体分布情况变化不大,但是豆甾醇浓度继续增加时,分布变的不均匀,在大于1000nm处也有分布,这可能是由于在脂质体的形成过程中,粒径较大时失去了原有的平衡,从而使得脂质体破裂和重组。
2.1.4 大豆植物甾醇对脂质体粒径的影响 大豆植物甾醇-脂质体的粒径大小和分布结果分别如图7、图8所示。

图7 大豆植物甾醇含量对脂质体粒径大小的影响Fig.7 Effect of different amount of soybean phytosterols on particle size of liposome

图8 大豆植物甾醇-脂质体粒径分布Fig.8 The particle size distribution of soybean phytosterols-liposome
由图7、图8可知,随着大豆植物甾醇含量提高,脂质体粒径也逐渐增大,但是增大的趋势相对不明显。从粒径分布上看,在高浓度时,大豆植物甾醇-脂质体的分布不如β-谷甾醇的均匀,但是比豆甾醇要均匀的多,这是由于大豆植物甾醇中,β-谷甾醇占多数。
2.2 甾醇-脂质体氧化稳定性
丙二醛(MDA)是多不饱和脂肪酸链断裂形成的产物之一,可以与硫代巴比妥酸发生成色反应,在532nm处比色测定,可检测丙二醛相对含量的变化,从而了解磷脂过氧化的程度[10]。脂质体被氧化程度越深,丙二醛含量越高,颜色越深,用紫外分光光度仪在532nm处测量出的吸光值也就越高。结果如图9所示。

图9 贮存时间与氧化程度的关系Fig.9 The relationship between storage time and the degree of oxidation
由图9可知,随着时间增加,吸光度逐渐增大,说明脂质体溶液中丙二醛的含量增多,脂质体被氧化的程度更深。在10d内,添加不同甾醇的脂质体与空白脂质体溶液的氧化程度都不大,这说明脂质体膜保持稳定,10d后脂质体的氧化程度加深,这是由于脂质体膜是个不断运动的平衡态膜,在贮藏过程中,膜上磷脂分子不停交换,导致脂质体的聚集沉淀等,从而破坏脂质体的稳定性。实验结果表明,添加大豆植物甾醇和β-谷甾醇的脂质体,稳定性要高于加入豆甾醇和胆固醇的脂质体。这是由于添加β-谷甾醇与大豆植物甾醇粒径分布均匀,脂质体溶液更加平衡稳定。
2.3 膜微极性
芘是一种脂溶性探针,易分配于脂双层中,在荧光光谱中,荧光强度I1(373nm)与I3(384nm)的比值大小取决于芘所处体系的极性,该值越大表明芘探针所处微环境的极性越大[11]。测定不同浓度的甾醇-脂质体的荧光强度,微极性结果如图10所示。
甾醇与膜结合时,3β-OH与水相结合,侧链延伸到双分子层的疏水核心与磷脂分子的脂肪链结合[12]。由图10可知,加入甾醇,使得膜的微极性逐渐减小,且少量甾醇可较大程度的降低脂质体的微极,说明甾醇分子嵌入到磷脂双分子层中时填充到了磷脂分子的间隙中,避免分子层外部的极性基团影响分子层内部的微极性。当甾醇浓度高时,豆甾醇的微极性比其他甾醇的要大,可能是由于豆甾醇浓度大时容易形成甾醇的富集区,增大分子空隙,所以使得微极性较高。

图10 不同甾醇与膜微极性关系Fig.10 Effects of different kind of sterol on membrane micro-polarity
2.4 膜流动性
脂质体的流动性是脂质体的一个重要物理性质,膜的流动性大,脂质体的稳定性就小、药物释放快[13]。荧光探针DPH是一种疏水性极强的分子,在脂肪酸酰基链中排列较好,常平行排列,更容易结合在双分子层内[14]。DPH在水中的荧光很小,可以忽略[15],其荧光偏振度(P)结果反映了脂质体烃区的平均活动程度,荧光偏振度越小说明磷脂膜的流动性越大[16]。分别在25℃和55℃下测定甾醇-脂质体的偏振度,结果如表1所示。
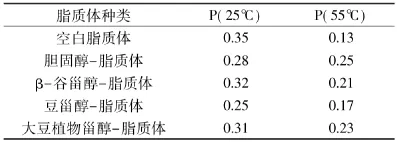
表1 不同甾醇-脂质体在25和55℃时偏振度Table1 Different polarization degree of sterol-liposome at 25 and 55℃
由表1可知,空白脂质体在55℃时的偏振度比在25℃时减小很多,这是由于温度升高,分子运动加快,磷脂分子疏水链会有全反式转变为扭曲态,发生相变,会使得膜分子间距增大,流动性降低。与空白脂质体相比,在25℃时,甾醇-脂质体偏振度更小,即流动性更大;55℃时,甾醇-脂质体的偏振度更大,即流动性较小,说明这几种甾醇对脂质体膜的流动性都有一定的调节作用。但是,不同甾醇对膜流动性的调节作用大小不同,胆固醇>大豆植物甾醇>β-谷甾醇>豆甾醇,这是由于胆固醇分子在相变温度以上时,胆固醇、β-谷甾醇弯曲的酰基链链可更好的填充在磷脂分子中,通过范德华作用,限制磷脂脂肪酸链的运动。豆甾醇侧链在C22和C23之间存在的双键不弯曲,流动性较强,在使得豆甾醇对膜流动性的调剂作用相对较小。
3 结论
植物甾醇对磷脂脂质体膜性质的影响与胆固醇类似,虽然胆固醇对脂质体膜流动性调节作用较强,但是β-谷甾醇,大豆植物甾醇调节的脂质体在粒径分布及稳定性方面更优,而且膜内部的微极性小,分子结合更紧密,可以有效的降低膜的渗透率。豆甾醇对膜性质的影响较小,但是可以跟谷甾醇,菜籽甾醇等发挥协同作用改善膜性质,并可以降低胆固醇的危害。因此用β-谷甾醇,大豆植物甾醇替代胆固醇,既生产更加稳定的脂质体,又有益于人体健康。
[1]Plochberger B,Stockner T,Chiantia S,et al.Cholesterol slows down the lateral mobility of an oxidized phospholipid in a supported lipid bilayer[J].Langmuir,2010,26(22):17322-17329.
[2]Colles S M,Chisolm G M.Lysophosphatidylcholine-induced cellular injury in cultured fibroblasts involves oxidative events[J].Journal of Lipid Research,2000,41(8):1188-1198.
[3]Smith E A,W Wang,Dea P K.Effects of cholesterol on phospholipid membranes:inhibition of the interdigitated gel phase of F-DPPC and F-DPPC/DPPC[J].Chem Phys Lipids,2012,165(2):151-159.
[4]Halling K K,J Petter Slotte.Membrane properties of plant sterols in phospholipid bilayers as determined by differential scanning calorimetry,resonance energy transfer and detergentinduced solubilization[J].Biochimica et Biophysica Acta,2004,1664(2):161-171.
[5]TakaoY,YamauchiH,ManosroiJ,etal.Molecular interactions between lipids and some steroids in a monolayer and a bilayer.2[J].Langmuir,1995,11(3):912-916.
[6]Hellgren L I,Sandelius A S.The impact of different phytosterols on the molecular dynamics in the hydrophobic/hydrophilic interface phosphatidylcholine-liposomes[J],Physiol Plant,2001,113(1):23-32.
[7]Elke A Trautwein,Guus Duchateau,Yuguang Lin,et al.Proposed mechanisms of cholesterol-lowering action of plant sterols[J].European Journal of Lipid Science and Technology,2003,105(3/4):15.
[8]刘天晴.电容法研究卵磷脂氨基酸H2O胶束和囊泡体系[J].物理化学学报,2010,26(2):311-316
[9]Umakoshi H,Suga K,Bui H T,et al.Charged liposome affects the translation and folding steps of in vitro expression of green fluorescent protein[J].J Biosci Bioeng,2009,108(5):450-454.
[10]Marsanasco M,Márquez Andrés L,Wagner Jorge R,et al.Liposomes as vehicles for vitamins E and C:An alternative to fortify orange juice and offer vitamin C protection after heat treatment[J].Food Research International,2011,44(9):3039-3046.
[11]陆国庆,郑江,郑新川,等.芘荧光探针法结合曲线拟合研究胆盐-磷脂混合纳米胶束的聚集行为[J].中国药业,2011,20(10):21-22.
[12]Hartmann M.Plant sterols and the membrane environment[J].Trends Plant Sci,1998,3(5):170-175.
[13]陆彬.脂质体、修饰脂质体与改良脂质体给药系统及其进展(上)[J].中国药师,2005,8(5):374-377.
[14]Silva C,Aranda F J,Ortiz A,et al.Molecular aspects of the interaction between plants sterols and DPPC bilayers:an experimental and theoretical approach[J].J Colloid Interface Sci,2011,358(1):192-201.
[15]Shimanouchi T,Ishii H,Yoshimoto N,et al.Calcein permeation across phosphatidylcholine bilayer membrane:effects of membrane fluidity,liposome size,and immobilization[J].Colloids Surf B Biointerfaces,2009,73(1):156-160.
[16]严文伟,费然,王文浩,等.大豆甾醇糖苷及两亲性聚乙二醇对阳离子脂质体细胞转染与膜各向异性的影响[J].北京大学学报:医学版,2003,35(3):5.

