不同发育期 柑精油对意大利青霉和指状青霉的抑制作用
贾 雷,何湘丽,陶能国,周海恩
(湘潭大学化工学院,湖南湘潭 411105)
柑橘是世界第一大水果、第三大国际贸易农产品。2008年开始,我国第一次超越巴西成为世界第一大柑橘生产国[1]。我国柑橘以鲜销为主,成熟期基本集中在9~11月,加之柑橘主产区位于偏远的山区或农村,需要一定的贮藏和运输周期加以调节市场供求的矛盾,在此期间大量的采后损失,如腐烂、营养和水分损失常常发生,造成极大的经济损失[2]。真菌病害侵染是导致贮藏和运输过程中新鲜柑橘果实腐烂的最主要原因。引起柑橘果实在贮藏、运输期间腐烂的真菌性病害有绿霉病(Penicillium digitatum)、青霉病(P.italicum)、酸腐病(Oospora citriaurantii)、黑色蒂腐病(Diplodia natalensis)、褐色蒂腐病(Phomopsis cytosporella)、黑腐病(Alternaria citri)、炭疽病(Colletotrichum gloeosporioides)、褐腐病(Phytophthora citrophthora)等[3]。近年的研究发现,我国柑橘采后腐烂80%由绿霉(指状青霉,P.digitatum)引起,其次是青霉(意大利青霉,P.italicum),此两类病害可导致柑橘采后腐烂率高达30%~50%[4]。越来越多的研究表明,柑橘精油及其潜在抑菌组分对意大利青霉和指状青霉等多种果蔬致病菌有显著的抑制作用,且具有高效、安全无毒、不易诱导致病菌产生抗性等特点,逐渐被人们关注并成功应用于柑橘果实采后病害的控制实践[5-10]。前期研究发现,椪柑精油对菌核青霉、大肠杆菌、金黄色葡萄球菌和黄曲霉等多种食品致病菌具有很好的抑制作用,是一种潜在的广谱生物杀菌剂[11-13]。本研究拟以椪柑为实验材料,通过 GC/MS分析不同发育期果皮精油的组成,对比抑菌性能的变化,从中筛选出潜在的抑菌组分,并通过实验进行验证,为柑橘采后贮藏保鲜提供理论参考。
1 材料与方法
1.1 材料与仪器
椪柑(C.reticulate Blanco)果实采自湘潭大学附近果园,采样时间分别为2011年7月28日,8月28日,9月28日和10月28日,此时期为椪柑果实发育的膨大期;柠檬醛(95%)、壬醛(95%)、辛醛(99%)、癸醛(98%)、β-芳樟醇(95%)和 α-松油醇(90%) 购自西格玛奥德里奇(上海)贸易有限公司;意大利青霉(P.italicum)、指状青霉(P.digitatum) 均由湘潭大学生物与食品工程专业实验室提供。
SPX-250B生化培养箱 上海博迅实业有限公司;BL320H电子天平 SHIMADZU公司;MLS-3020蒸汽灭菌器 日本SANYO电子有限公司;TDL5A台式大容量冷冻离心机 长沙英泰仪器有限公司;FLC-3超净工作台 苏州安瑞净化公司;CL-100电炉 上海日用电炉。
1.2 椪柑精油的提取与分析
选取无机械损伤、无病虫害和成熟度相同的椪柑果实,将果皮剥下,放置在40℃烘箱中干燥,粉碎呈直径为6mm左右的块状,采用水蒸气蒸馏提取果皮精油,无水硫酸钠干燥后置于4℃冰箱密封避光保存备用。
GC-MS分析条件如下:日本岛津 GC-MS(2010QP-Plus)仪,HP-5MS型石英毛细管柱(30m×0.25mm×0.25μm)。气相色谱条件:载气为氦气,柱流量为1.2mL/min,进样口温度:250℃;分流比200∶1,检测器温度220℃。升温程序为:起始温度为40℃,保持 1min,然后以 3℃/min升到 70℃,保持1min,然后以5°C/min升到220°C 保持 10min;进样量为1μL。质谱条件:接口温度为220℃;离子源温度200℃;电子轰击(EI)离子源;电子能量70eV;质量扫描范围5~450m/z。
1.3 不同发育期椪柑精油对意大利青霉和指状青霉的作用
采用琼脂稀释培养法[14]研究不同发育期椪柑精油对意大利青霉和指状青霉菌丝体生长的影响。椪柑精油对意大利青霉作用的终浓度依次为:0.00、0.31、0.62、1.50、2.50、5.00、10.0μL/mL;椪柑精油对指状青霉作用的终浓度依次为:1.25、2.50、5.00、10.0、20.0、40.0μL/mL。每个培养皿接入一个生长一致的菌饼(d=6.0mm),每处理重复3次,置28℃恒温培养箱培养48h,十字交叉法测量菌落直径。以完全没有菌丝生长的最低浓度作为椪柑精油的最低抑菌浓度(MIC)[15]。用0.5%(v/v)的吐温-80 和无菌水作为对照。
1.4 椪柑精油中几种潜在抑菌成分对意大利青霉和指状青霉的作用
采用琼脂稀释培养法[14]研究椪柑精油中6种潜在抑菌组分(柠檬醛、辛醛、壬醛、癸醛、β-芳樟醇和α-松油醇)对意大利青霉和指状青霉菌丝体生长的影响,各组分浓度依次为 0.00、0.06、0.13、0.25、0.50、1.00、2.00μL/mL。
1.5 数据分析
每组实验三次重复,采用常规分析方法来标注标准偏差,数据分析采用SPSS16.0统计分析软件,One-way ANOVA分析差异显著性(p<0.05),不同浓度间比较差异显著性。
2 结果与分析
2.1 椪柑精油成分分析
从表1可以看出,不同发育期椪柑精油按照出峰顺序共鉴定出约50种物质,主要包括萜烯烃类化合物(80.26% ~87.60%)(v/v,下同)、醇(6.01% ~13.26%)、醛(4.51% ~5.63%)和醚(0.12%~0.33%)等萜烯类化合物。其中,含量最高的组分为柠檬烯(47.28%~58.40%),约占总含量的一半,其次为γ-松油烯(8.27% ~13.23%)、β- 芳樟醇(3.48% ~7.86%)、β-月桂烯(6.24%~7.50%)、α-蒎烯(5.07%~6.05%)、β-蒎烯(2.30%~3.45%)、辛醛(2.04% ~2.48%)和异松油烯(1.40%~2.09%)等。不同发育期果实的各种主要组分含量变化较为明显,如主要组分柠檬烯的含量从7月的47.28%上升到10月的55.73%。一些潜在的抑菌组分含量也存在明显变化,如辛醛含量从7月的2.04%增加到10月的2.48%,壬醛从0.27%增加到0.35%,癸醛从0.96%增加到1.50%;而α-柠檬醛从0.39%降低到10月的0.21%,β-芳樟醇从7.86%降低到3.48%,α-松油醇从1.59%降低到1.00%。通过比较不同发育期椪柑果皮精油各类化合物的含量可知,萜烯烃、大部分醛和醚类等化合物含量均呈上升趋势,而醇类含量逐渐下降。
2.2 不同发育期椪柑精油对意大利青霉和指状青霉的作用
由表2可以看出,不同发育期椪柑精油均能抑制意大利青霉菌丝体生长,以7月和8月的抑菌效果较为明显,当精油浓度为0.31μL/mL时既表现出显著的抑制作用(p<0.05);9月和10月果皮精油浓度达到0.62和1.25μL/mL时开始显著抑制意大利青霉生长;当浓度为5.00μL/mL时,不同发育期果皮精油处理的意大利青霉菌丝体直径与对照一样,均为6.0mm,说明意大利青霉菌丝生长受到完全抑制。根据表2结果可以推断,椪柑精油对意大利青霉MIC为5.00μL/mL。
由表3可以看出,不同发育期椪柑精油对指状青霉的抑制作用相对较弱,浓度较低时对指状青霉不起作用甚至促进其生长,当浓度达到40.0μL/mL
时能完全抑制其生长,且不同月间存在较大差别(表3)。如7月果皮精油浓度低于20.0μL/mL时基本无作用;9月果皮精油在较低浓度(1.25μL/mL)时不起作用,当浓度为2.50μL/mL时显著促进指状青霉生长(p<0.05),浓度达到10.0μL/mL时开始出现抑制。根据表3结果可以推断,椪柑精油对指状青霉MIC 为40.0μL/mL。
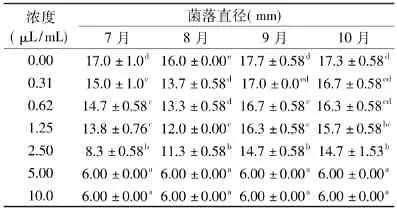
表2 不同发育期椪柑精油对意大利青霉菌丝体生长的影响(n=3)Table2 Effect of Ponkan essential oils at different ripening stage on mycelium of P.italicum(n=3)
2.3 椪柑精油中几种潜在抑菌成分对意大利青霉和指状青霉的作用
表4和表5的结果显示,椪柑精油中6种潜在抑菌组分对意大利青霉和指状青霉菌丝体生长均有不同程度的抑制,以辛醛的抑制作用最强,β-芳樟醇和α-松油醇最弱,且不同菌株之间存在较大差别;β-芳樟醇对意大利青霉和指状青霉菌丝生长表现出明显抑制需要一定的浓度(分别为0.50和0.25μL/mL),α-松油醇对指状青霉菌丝生长表现出明显抑制需要一定浓度(0.25μL/mL),其余抑菌组分均在更小的浓度时(0.06或0.13μL/mL)表现出明显的抑制(p<0.05)。
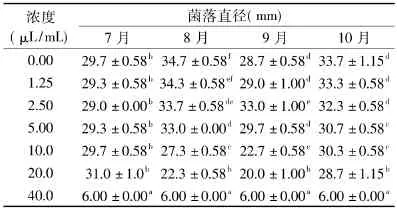
表3 不同发育期椪柑精油对指状青霉菌丝体生长的影响(n=3)Table3 Effect of Ponkan essential oils at different ripening stage on mycelium of P.digitatum(n=3)
柠檬醛和辛醛对意大利青霉抑制作用最强,MIC均为0.50μL/mL,壬醛和癸醛对意大利青霉的 MIC均为1.00μL/mL,而β-芳樟醇和α-松油醇对意大利青霉的 MCI为2.00μL/mL(表4)。对指状青霉而言,辛醛和壬醛的MIC为0.50μL/mL,癸醛的MIC为1.00μL/mL,柠檬醛、β-芳樟醇和 α-松油醇的 MIC均为2.00μL/mL(表5)。通过比较MIC可以看出,与椪柑精油的作用效果类似,所测6种抑菌成分对意大利青霉的作用效果要强于指状青霉。
3 讨论与结论
利用水蒸气蒸馏法提取出不同发育期椪柑果皮精油,并通过GC-MS测定了其组成。与以往报道类似[11,16-17],椪柑精油主要以烯烃类为主,占总组分的80.26%~87.60%,以柠檬烯的含量最高,达47.28%~58.40%,椪柑果实发育过程中醇类(6.01%~13.26%)和醛类(4.51%~5.63%)含量变化较大。醇类物质中,β-芳樟醇含量随着果实成熟急剧下降,从7月的7.86%下降到10月的3.48%;α-松油醇含量也略微下降,从7月的1.59%下降到10月的1.00%。醛类物质中,辛醛从7月的2.04%增长到10月的2.48%;壬醛在7月果皮精油中未检测到,8月增加到0.27%,逐渐增加到10月的0.35%;α-柠檬醛从7月的0.39%下降到10月的0.21%。

表4 六种潜在抑菌组分对意大利青霉菌丝体生长的影响Table4 Effect of six potential antifungal components on mycelium of P.italicum

表5 六种潜在抑菌组分对指状青霉菌丝体生长的影响Table5 Effect of six potential antifungal components on mycelium of P.digitatum
抑菌实验结果表明,不同发育期椪柑精油对意大利青霉菌丝体的抑制作用要强于指状青霉,当精油浓度为5.00μL/mL时,就可以完全抑制意大利青霉的生长;而要完全抑制指状青霉生长,精油浓度需达到40.0μL/mL。出现这一结果可能与不同青霉菌株有关[13,18],也可能与其所含的组分有关。通常认为,植物精油的抑菌性能归功于精油中某种单一组分或多种次要组分(minor compounds)的复合拮抗效应[19]。如前所述,椪柑精油中含有柠檬醛、辛醛、壬醛、癸醛、芳樟醇和α-松油醇等组分,这些组分已被证实对青霉菌生长有不同程度的抑制[5,18-22]。本研究分析了上述组分对意大利青霉和指状青霉菌丝体生长的影响。结果表明,6种抑菌组分中辛醛的效果最好,其次为柠檬醛、壬醛、癸醛、β-芳樟醇和α-松油醇;0.50μL/mL柠檬醛可完全抑制意大利青霉的生长,而完全抑制指状青霉菌丝生长的浓度需达到2.00μL/mL;0.50μL/mL辛醛可完全抑制意大利青霉和指状青霉的生长;β-芳樟醇和α-松油醇的浓度需要达到2.00μL/mL才可以完全抑制意大利青霉和指状青霉的生长。
比较不同成熟期果皮椪柑精油的组成可以看出,随着果实发育,椪柑果皮中的抑菌物质如辛醛、癸醛和壬醛含量逐渐增加,而柠檬醛、芳樟醇和α-松油醇等含量逐渐下降。与之对应的是,精油的抑菌性能总体相对稳定,MIC值保持一致,说明这几种抑菌物质含量的变化在一定程度上决定了椪柑精油的抑菌效果。但不同月精油也存在细微的差别,如7月和8月果皮精油对意大利青霉的抑菌效果要好于9、10月;8、9月果皮精油对指状青霉的抑菌效果优于7月和10月,且9月果皮精油低浓度(2.50μL/mL)还促进指状青霉生长。出现这种情况可能与椪柑精油中的其他待鉴定的抑菌物质有关,也可能与其中促进生长的物质如柠檬烯、β-蒎烯和 β-月桂烯有关[6,8-9,18,23]。
综上可知,椪柑精油对意大利青霉和指状青霉的抑菌作用主要取决于柠檬醛、辛醛、壬醛、癸醛、β-芳樟醇和α-松油醇等的复合作用。本实验研究了单一组分的抑菌作用,双组分或多组分的复合效应有待下一步研究,相关研究正在进行中。
[1]高玉妹,陶能国,刘跃进,等.硫酸水解冰糖橙皮渣工艺研究[J].食品与发酵工业,2010,36(12):115-118.
[2]田世平,范青.控制果蔬采后病害的生物学技术[J].植物学通报,2000,17(3):211-217.
[3]邓雨艳,曾凯芳.柑橘果实采后侵染性病害防治技术研究进展[J].食品科技,2008,33(4):211-214.
[4]龙超安,邓伯勋,何秀娟.柑橘青、绿霉病高效拮抗菌34-9的筛选及其特性研究[J].中国农业科学,2005,38(12):2434-2439.
[5]Caccioni D R L,Guizzardi M,Biondi D M,et al.Relationship between volatile components of citrus fruit essential oils and antimicrobial action on Penicillium digitatum and Penicillium italicum[J].Int J Food Microb,1998,43(1-2):73-79.
[6]Stange R R,Midland S L,Sims J J,et al.Differential effects of citrus peel extracts on growth of Penicillium digitatum,P.italicum,and P.expansum[J].Physiol Mol Plant P,2002,61(5):303-311.
[7]Sharma N,Tripathi A.Fungitoxicity of the essential oil of Citrus sinensis on post- harvest pathogens[J].World J Microbiol Biotechnol,2006,22(6):587-593.
[8]Droby S,Eick A,Macarisin D,et al.Role of citrus volatiles in host recognition,germination and growth of Penicillium digitatum and Penicillium italicum[J].Postharvest Biol Tech,2008,49(3):386-396.
[9]du Plooy W,Regnier T,Combrinck S.Essential oil amended coatings as alternatives to synthetic fungicides in citrus postharvest management[J].Postharvest Biol Tech,2009,53(3):117-122.
[10]Sánchez- González L,Cháfer M,Chiralt A,et al.Physical properties of edible chitosan films containing bergamot essential oil and their inhibitory action on Penicillium italicum[J].Carbohyd Poly,2010,82(2):277-283.
[11]Tao N G,Liu Y J,Tang Y F,et al.Essential oil composition and antimicrobial activity of Citrus reticulata[J].Chem Nat Compd+ ,2009,45(3):437-438.
[12]Gao YM,Tao NG,Liu YJ,et al.Antimicrobial activity of the essential oil from the peel of Ponkan(Citrus reticulata Blanco)[J].J Essent Oil Bear Pl,2010,13(2):230-236.
[13]王华,陶能国,王长锋,等.椪柑精油及其主要抑菌组分对菌核青霉的抑制作用[J].中国生物工程杂志,2012,32(3):53-58.
[14]Sharma N,Tripathi A.Effects of Citrus sinensis(L.)Osbeck epicarp essential oil on growth and morphogenesis of Aspergillus niger(L.)Van Tieghem[J].Microbiol Res,2008,163(3):337-344.
[15]Tao N G,Liu Y J,Zhang M L.Chemical composition and antimicrobial activities of essential oil from the peel of bingtang sweet orange(Citrus sinensis Osbeck)[J].Int J Food Sci Tech,2009,44(7),1281-1285.
[16]Sawamura M,Thiminhtu,Onishi Y,et al.Characteristic odor components of Citrus reticulata Blanco(ponkan)cold-pressed oi[J].Biosci Biotechnol Biochem,2004,68(8):1690-1697.
[17]许有瑞,顾生玖,朱开梅,等.椪柑幼果挥发油化学成分的 GC-MS 分析[J].安徽农业科学,2010,38(16):8410-8411.
[18]Scora K M,Scora R W.Effect of Volatiles on mycelium growth of Penicillium digitatum.P.italicum and P.ulaiense[J].J Basic Microbiol,1998,38(5-6):405-413.
[19]Fisher K,Phillips C.Potential antimicrobial uses of essential oils in food:is citrus the answer? [J]Trends Food Sci Tech,2008,19(3):156-164.
[20]Daferera D J,Ziogas B N,Polissiou M G.GC-MS analysis of essential oilsfrom some Greek aromatic plantsand their fungitoxicity on Penicillium digitatum[J].J Agric Food Chem,2000,48(6):2576-2581.
[21]Wolken W A,Tramper J,van der Werf M J.Toxicity of terpenes to spores and mycelium of Penicillium digitatum[J].Biotechnol Bioeng,2002,80(6):685-690.
[22]Linde J H,Combrinck S,Regnier T J C,et al.Chemical composition and antifungal activity of the essential oils of Lippia rehmannii from South Africa[J].S Afr J Bot,2010,76(1):37-42.
[23]Eckert J W,Ratnayake M.Role of volatile compounds from wounded oranges in induction of germination of Penicillium digitatum conidia[J].Phytopathology,1994,84(7):746-750.
——以渤海湾盆地渤海BZ25油田新近系明化镇组下段为例

