转录因子PDIDSM_85260对指状青霉生物学特性的影响
陈 燕,赵仁勇,张璐璐
河南工业大学 粮油食品学院,河南 郑州 450001
指状青霉(Penicilliumdigitatum)不仅是导致柑橘类水果腐败变质的主要病原菌之一[1],同时也是一类应用前景广阔的微生物资源。指状青霉DSM 62840能够参与柠檬烯的微生物转化,并且能够将柠檬烯转化生成α-松油醇[2]。α-松油醇(alpha-Terpineol)是一种具有紫丁香香气的单环萜醇类化合物,是我国重要的出口香料品种[3]。由于α-松油醇独特的感官特性以及抗菌、抗氧化、抗惊厥、抗炎症、抗溃疡、抗腹泻、抗痉挛、抗癌等生物学活性[4-7],其已经在食品、化妆品、农药、医学等行业中被广泛应用。
张璐璐等[8]发现转录因子PDIDSM_85260可能是指状青霉转化柠檬烯生产α-松油醇过程中的一个重要转录调控因子。该编码基因含有一个类似GAL4型的Zn2Cys6双核簇DNA结合域(GAL4-like Zn2Cys6binuclear cluster DNA-binding domain, GAL4)和一个真菌转录因子调控域(fungal transcription factor regulatory middle homology region, fungal_TF_MHR)。沉默该基因能够影响柠檬烯的微生物转化,降低α-松油醇的生成量。锌指蛋白属于指状结构域的转录因子,主要负责调控基因的表达[9-10]。Zn2Cys6型转录因子是真菌特有的锌指类转录因子,对其基础代谢、次级代谢及抗药性等具有调控功能,在真菌的生长和代谢过程中发挥着重要的作用[11-13]。当面临不同环境胁迫的情况时,真菌能够通过启动转录调控因子对菌体的生长、繁殖以及相关代谢途径进行适应性转录调控,从而对不同次级代谢产物的合成和分泌造成影响[14-15]。
真菌的形态分化常伴随着代谢物的合成,因此对真菌调控基因及其表型的研究有助于后续代谢产物的研究。作者在前期研究的基础上,比较基因PDIDSM_85260的沉默型菌株与野生型菌株在孢子萌发过程、菌丝形态、菌株生长速率、氧化胁迫、盐胁迫等方面的差异,探究转录因子PDIDSM_85260在指状青霉生长过程中的生理功能,为进一步研究PDIDSM_85260的功能奠定基础。
1 材料与方法
1.1 材料与试剂
野生型菌株指状青霉DSM 62840购自德国微生物菌种保藏中心。基因PDIDSM_85260沉默型菌株通过RNA干扰技术获得[8]。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:称取4.6 g PDA粉末溶于100 mL水中。
NaCl、吐温80:天津市大茂化学试剂厂;H2O2:洛阳昊华化学试剂有限公司;KCl、CaCl2、CuCl2、FeSO4、MgSO4:分析纯,天津市科密欧化学试剂有限公司。
1.2 仪器与设备
MB-11-2光学显微镜:海彼爱姆光学仪器制造有限公司;101培养箱:北京市永光明医疗仪器有限公司;YX280/15高压蒸汽灭菌锅:上海三申医疗器械有限公司;SP-DJ超净工作台:上海浦东物理光学仪器制造厂;血球计数板:上海市求精生化试剂有限公司。
1.3 试验方法
1.3.1 指状青霉DSM 62840孢子悬浮液的配制
孢子悬浮液的配制参考台亚楠[16]的方法,并稍做修改。将在PDA培养基中培养7 d的指状青霉孢子用无菌接种环轻轻刮下,并悬浮在含有0.1%吐温80的无菌水中,轻轻摇动使菌丝分布均匀,然后对悬浮液进行过滤,除去其中的菌丝和培养基碎片等杂质,最终得到孢子悬浮液。将少量悬浮液滴在血球计数板上并进行计数,配制终浓度为1.0×106spores mL-1的孢子悬浮液,待后续试验使用。
1.3.2 基因PDIDSM_85260对指状青霉孢子萌发过程的影响
配制0.5% PDA培养基,将其置于已灭菌的载玻片上并等待凝固。接种5 μL浓度为1.0×106spores mL-1的野生型菌株和沉默型菌株的孢子悬浮液于培养基上,并将其放在灭菌的培养皿中,每个载玻片接种3处。置于25 ℃的条件下分别培养8 h和12 h,观察孢子的萌发情况。孢子长度大于直径的1/2则为萌发的孢子。
孢子萌发率的计算公式如下:

1.3.3 基因PDIDSM_85260对指状青霉菌丝形态的影响
将200 μL浓度为1.0×106spores mL-1的野生型菌株和沉默型菌株的孢子悬浮液接种在PDA培养基上,均匀涂布后斜插入盖玻片于培养基中。25 ℃的条件下培养72 h,待菌丝爬上盖玻片,将其取出,并在显微镜下观察菌丝形态。
1.3.4 基因PDIDSM_85260对指状青霉生长的影响
将200 μL浓度为1.0×106spores mL-1的野生型菌株和沉默型菌株的孢子悬浮液均匀涂布在PDA培养基上,培养至平板刚长出菌丝且无分生孢子出现即可。在PDA平板上用直径8 mm的打孔器均匀地打出多个小菌饼,用无菌镊子将小菌饼反贴至PDA培养基中。在25 ℃的条件下培养8 d,每日定时观察并采用十字交叉法测量菌饼直径。试验重复3次。
1.3.5 基因PDIDSM_85260对不同离子胁迫环境下指状青霉生长特性的影响
将200 μL浓度为1.0×106spores mL-1的野生型菌株和沉默型菌株的孢子悬浮液均匀涂布在PDA培养基上,培养至平板刚长出菌丝且无分生孢子出现即可。在PDA平板上用直径8 mm的打孔器均匀地打出多个小菌饼,并将小菌饼反贴至含有不同浓度的FeSO4、MgSO4、NaCl、KCl、CuCl2和CaCl2的PDA培养基中。在25 ℃的条件下培养8 d,每日定时观察并采用十字交叉法测量菌饼直径。试验重复3次。以正常PDA培养条件下野生型菌株和沉默型菌株的菌饼直径作为空白对照,计算离子胁迫条件下各菌株的相对抑制率。
相对抑制率=(PDA中各菌株菌饼直径-胁迫条件下各菌株菌饼直径)/PDA中各菌株菌饼直径×100%。
1.3.6 基因PDIDSM_85260对活性氧胁迫环境下指状青霉生长特性的影响
将200 μL浓度为1.0×106spores mL-1的野生型菌株和沉默型菌株的孢子悬浮液均匀涂布在PDA培养基上,培养至平板刚长出菌丝且无分生孢子出现即可。在PDA平板上用直径8 mm的打孔器均匀地打出多个小菌饼,并将小菌饼反贴至含有不同浓度的H2O2的PDA培养基中。在25 ℃的条件下培养8 d,每日定时观察并采用十字交叉法测量菌饼直径。试验重复3次。以正常PDA培养条件下野生型菌株和沉默型菌株的菌饼直径作为空白对照,计算活性氧胁迫条件下各菌株的相对抑制率。
1.4 数据处理
使用Excel和GraphPad Prism 5软件处理数据和作图,采用SPSS 24.0软件对数据进行单因素方差分析,并应用邓肯法对其进行显著性分析(P<0.05,P<0.01)。所有数据均为3次重复试验所得。
2 结果与分析
2.1 基因PDIDSM_85260对指状青霉孢子萌发过程的影响
孢子萌发率是表明孢子活性的一个重要指标。为了研究基因PDIDSM_85260对指状青霉孢子萌发过程的影响,本试验对指状青霉野生型菌株和PDIDSM_85260沉默型菌株进行了孢子萌发情况的测定。如图1所示,在孢子萌发试验中,萌发8 h时,野生型菌株的孢子萌发率为77%,沉默型菌株的孢子萌发率为78%,无显著差异;萌发12 h时,野生型菌株和沉默型菌株的孢子萌发率分别为92%和93%。结果表明,基因PDIDSM_85260对指状青霉孢子萌发过程的影响较小。

图1 基因PDIDSM_85260对指状青霉DSM 62840孢子萌发过程的影响Fig.1 Effect of PDIDSM_85260 on spore germination of Penicillium digitatum DSM 62840
2.2 基因PDIDSM_85260对指状青霉菌丝形态的影响
为了研究基因PDIDSM_85260对指状青霉菌丝形态的影响,本试验利用显微镜观察了指状青霉野生型菌株和PDIDSM_85260沉默型菌株的菌丝形态。由图2可知,在野生型菌株和沉默型菌株中,均观察到菌丝生长形态似扫帚状且枝较大,孢子梗顶端形成多个分支,菌株的分生孢子多为串生,形状似椭圆,与其他研究人员所观察到指状青霉的菌丝形态结果一致[17-19]。结果表明基因PDIDSM_85260对指状青霉菌丝形态的影响较小。

图2 基因PDIDSM_85260对指状青霉DSM 62840菌丝生长形态的影响Fig.2 Effect of PDIDSM_85260 on the mycelial morphology of Penicillium digitatum DSM 62840
2.3 基因PDIDSM_85260对指状青霉生长的影响
菌落形态的观察可以发现菌落是否正常生长,菌饼直径是菌丝生长量的直观反映。为了研究基因PDIDSM_85260对指状青霉生长的影响,本试验将指状青霉野生型菌株和PDIDSM_85260沉默型菌株的菌饼分别反贴于PDA培养基中,观察其生长情况,结果如图3所示。由图3a可知,沉默型菌株的菌饼直径明显大于野生型菌株,但菌落形态无显著差别。进一步测定菌丝体的生长曲线(图3b)发现,沉默型菌株的菌落直径在整个培养期间均大于野生型菌株。结果表明基因PDIDSM_85260会影响指状青霉的生长,基因PDIDSM_85260沉默会导致指状青霉生长速率增加,产孢量增加,但菌落形态无明显差别。
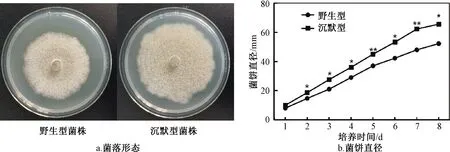
注:*表示存在显著性差异(P<0.05),**表示存在极显著性差异(P<0.01)。图4、图5同。图3 基因PDIDSM_85260对指状青霉DSM 62840生长的影响Fig.3 Effect of PDIDSM_85260 on the growth of Penicillium digitatum DSM 62840
2.4 基因PDIDSM_85260对不同离子胁迫环境下指状青霉生长特性的影响
为了研究基因PDIDSM_85260对不同离子胁迫环境下指状青霉生长特性的影响,本试验测定了指状青霉野生型菌株和沉默型菌株在Na+、K+、Mg2+、Cu2+、Fe2+、Ca2+6种金属离子胁迫环境下的相对抑制率,结果如图4所示。
指状青霉Na+和K+胁迫试验的结果(图4a和4b)显示,随着Na+和K+浓度(0~1.5 mol·L-1)的增加,野生型菌株和沉默型菌株均出现生长抑制的现象,在1.5 mol·L-1的Na+和K+胁迫环境下,野生型菌株的相对抑制率分别是84.66%和71.16%,沉默型菌株的相对抑制率分别是87.80%和73.04%。此外,在Na+的胁迫下,沉默型菌株的相对抑制率显著高于野生型菌株,基因PDIDSM_85260沉默增加了指状青霉对Na+的敏感性,表明基因PDIDSM_85260参与了指状青霉Na+胁迫的应答反应。在K+的胁迫下,沉默型菌株在低浓度(0.5 mol·L-1)下的相对抑制率显著低于野生型菌株(P<0.05),在高浓度(1.0、1.5 mol·L-1)下不显著。
指状青霉Ca2+和Mg2+胁迫试验的结果(图4a和4b)显示,随着Ca2+浓度的增加,野生型菌株和沉默型菌株均出现生长抑制的现象,野生型菌株在低浓度(0.5、0.7 mol·L-1)下的相对抑制率显著低于沉默型菌株(P<0.05),在高浓度(1.0 mol·L-1)下不显著。随着Mg2+浓度的增加,野生型菌株和沉默型菌株在不同浓度下均抑制生长,但相对抑制率没有显著差别。
指状青霉Fe2+和Cu2+胁迫试验的结果(图4a和4b)显示,随着Fe2+浓度(0~5 mmol·L-1)的增加,野生型菌株和沉默型菌株均出现生长抑制
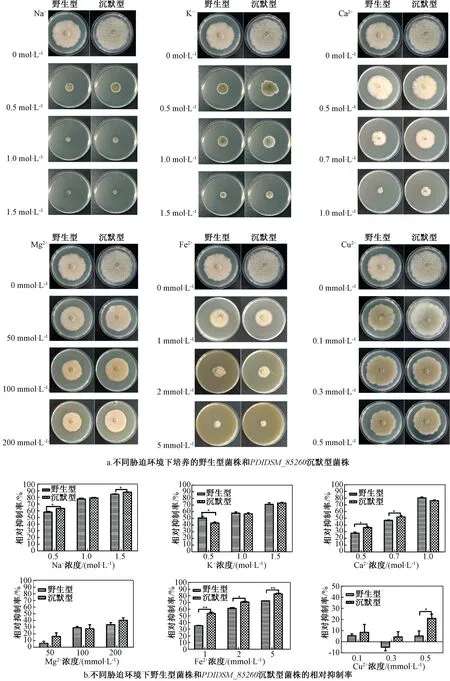
图4 基因PDIDSM_85260对指状青霉DSM 62840离子胁迫环境适应性的影响Fig.4 Effect of PDIDSM_85260 on environmental adaptability of Penicillium digitatum DSM 62840 to ion stress
的现象,在5 mmol·L-1的Fe2+胁迫环境下,野生型菌株和沉默型菌株的相对抑制率分别是72.62%和82.95%。此外,在Fe2+的胁迫下,沉默型菌株的相对抑制率均显著高于野生型(P<0.05),基因PDIDSM_85260沉默增加了指状青霉对Fe2+的敏感性,表明基因PDIDSM_85260参与了指状青霉Fe2+胁迫的应答反应。随着Cu2+浓度(0~0.5 mmol·L-1)的增加,沉默型菌株均出现生长抑制的现象,在0.5 mmol·L-1的Cu2+胁迫环境下,沉默型菌株的相对抑制率是21.05%。值得注意的是,当Cu2+浓度为0.1、0.5 mmol·L-1时,野生型菌株抑制生长,但Cu2+浓度为0.3 mmol·L-1时,野生型菌株出现促进生长的现象,这可能是由于Cu2+作为生物体中某些酶的辅酶或激活因子参与反应,在Cu2+胁迫环境下,真菌可以调节体内Cu2+稳态从而维持生长[20-21]。
2.5 基因PDIDSM_85260对活性氧胁迫环境下指状青霉生长特性的影响
指状青霉氧化胁迫敏感性试验结果(图5)表明:随着H2O2浓度的增加,野生型菌株与沉默型菌株均出现低浓度(10 mmol·L-1)促进生长现象,增长率分别为0.03%和4.94%;高浓度(20、40 mmol·L-1)抑制生长,且沉默型菌株的相对抑制率均高于野生型菌株。在40 mmol·L-1的H2O2胁迫环境下,野生型菌株的相对抑制率为24.41%,沉默型菌株的相对抑制率为32.78%,以上结果表明,基因PDIDSM_85260参与了指状青霉氧胁迫的应答反应。

图5 基因PDIDSM_85260对指状青霉DSM 62840在H2O2胁迫环境下的影响Fig.5 Effect of PDIDSM_85260 on environmental adaptability of Penicillium digitatum DSM 62840 to H2O2 stress
3 讨论与结论
转录因子能够与特定目的基因的5′端上游序列特异性结合,使目的基因在一定的空间和时间内按照特定的强度进行表达,调控生物体的生长发育和胁迫应答。Zn2Cys6型转录因子是真菌生长发育过程中重要的转录调控因子,参与调节丝状真菌的初级代谢、次级代谢过程以及外界胁迫应答反应,影响菌体的耐受性、生长形态以及次级代谢产物的合成和分泌[22]。有研究表明缺失Zn2Cys6型转录因子PdMut3会影响指状青霉的致病力、菌株的生长、分生孢子发育、菌丝形态以及细胞壁的完整性[23]。含有Zn2Cys6结构的转录因子TP05746能够通过调控相关基因的表达来调节褐红篮状菌菌丝的生长及分生孢子的形成[24]。Son等[25]的研究表明Zn2Cys6型转录因子ZcfA基因能够影响拟曲霉和黄曲霉菌丝的生长以及分生孢子萌发,过表达ZcfA基因能够提高菌株的产孢量和菌饼直径,而缺失该基因则会导致菌株的菌饼直径和产孢量小于野生型菌株。而在Wang等[26]的研究中,缺失Zn2Cys6型转录因子MoIRR基因并不影响稻瘟病菌菌丝的生长、分生孢子产生以及孢子萌发。在本研究中,基因PDIDSM_85260沉默型菌株的孢子萌发率和菌丝形态与野生型菌株相比没有显著差异,说明转录因子PDIDSM_85260对指状青霉孢子萌发过程和菌丝形态的影响较小。然而,基因PDIDSM_85260能够影响指状青霉的生长,基因PDIDSM_85260沉默会导致指状青霉生长速率增加、产孢量增加,但菌落形态无明显差别。
Zn2Cys6型转录因子能够参与调节真核生物的离子稳态。在本研究中,除Cu2+以外,在其他金属离子胁迫环境下,野生型菌株和基因PDIDSM_85260的沉默型菌株均表现出生长抑制的现象,这可能是由于高盐环境破坏了真菌细胞的渗透压,造成细胞质壁分离,抑制真菌的生长[27-28]。此外,基因PDIDSM_85260沉默型菌株对胞外高浓度的K+、Na+、Fe2+和Ca2+的敏感性较高,推测是由于沉默型菌株维持离子稳态的功能存在缺陷导致其对金属离子的敏感性增加,表明转录因子PDIDSM_85260在维持细胞离子稳态方面起重要的作用。Ma等[29]的研究发现Na+、Ca2+和Mg2+能够抑制指状青霉菌株的生长,并且PdMpkB基因缺失会增加对盐胁迫的敏感性,说明PdMpkB基因参与指状青霉盐胁迫的应答反应。李执[30]研究也发现,缺失全局调控因子McrA会导致黑曲霉对Na+环境的敏感性升高,但对K+、Cu2+和Zn2+环境的敏感性降低,并且低浓度的Cu2+环境有益于黑曲霉菌株的生长,表明McrA对黑曲霉表型的调控可能受环境的影响。
Zn2Cys6型转录因子在维持真核生物氧化应激方面也发挥着一定作用。H2O2被认为是活性氧的主要化合物之一,可能抑制丝状真菌的生长[31]。添加H2O2会增加菌株胞内的活性氧(reactive oxygen species, ROS)含量,当细胞内的H2O2达到一定浓度时,能够导致细胞核和线粒体等生物体迅速氧化,致使细胞死亡[32]。Chen等[33]研究表明Zn2Cys6型转录因子Bbcmr1能够参与丝状真菌球孢白僵菌分生孢子的成熟过程,调节细胞壁结构和细胞壁相关蛋白的表达以及海藻糖的合成。在H2O2胁迫环境下,与野生型菌株相比,缺失Bbcmr1会导致分生孢子萌发率降低23%,表明Bbcmr1对球孢白僵菌的调控受氧胁迫的影响。李国旗[34]研究发现缺失PdCaMK1基因增加了指状青霉对H2O2的耐受性,表明PdCaMK1参与了指状青霉氧化胁迫的应答反应。王地广等[35]也发现Zn2Cys6型转录因子CsGcc1参与调控暹罗炭疽菌对H2O2的敏感性,CsGcc1的缺失会造成敲除菌株对H2O2更加敏感。在本研究中,高浓度的H2O2能够抑制指状青霉菌株的生长,并且基因PDIDSM_85260沉默使得指状青霉对H2O2胁迫的敏感性增加,表明转录因子PDIDSM_85260在维持活性氧水平和氧化应激方面起重要的作用。
综上所述,转录因子PDIDSM_85260在指状青霉的生长、离子稳态系统的维持、活性氧水平和氧化应激方面发挥着重要作用。本研究为进一步了解转录因子PDIDSM_85260的功能奠定了一定基础。

