VC纳米脂质体悬浮液及其前体脂质体的制备与稳定性研究
鲍士宝,喻婷婷,马福敏
(1.安徽科技学院食品药品学院,安徽凤阳233100;2.辽宁中医药大学大连药学院,辽宁大连116600)
VC是一种水溶性维生素,具有强还原性,被广泛应用于食品、药品和化妆品中,保护其他有效成分不被氧化、抑制酶促褐变或脱色、营养强化等[1]。但VC对光、氧、pH以及温度等环境条件非常敏感,易氧化变质,因此其贮藏稳定性是一个需要解决的问题[2-4]。为了提高 VC的稳定性和利用率,有关研究人员利用各种脂质体自组装技术制备了VC脂质体,以期提高VC的稳定性,但已有的研究报道中制备的VC脂质体普遍存在着包封率不高、粒径过大等问题[5-8]。虽有新近报道表明,采用新的脂质体基质或多重包埋方法可以在一定程度上提高VC脂质体的包封率和稳定性,但增加了其平均粒径[9-12]。目前制备脂质体的方法主要有物理分散法、两相分散法与表面活性剂增溶法三大类[13-15];为了细化脂质体的粒径,常采用超声、高压均质等后处理。乙醇注入法是属于两相分散法中的一种,该方法制备脂质体具有操作简单、重现性好、产品粒径小、不使用无毒试剂等优点。本实验通过单因素与正交实验优化乙醇注入-高压均质法制备VC纳米脂质体悬浮液的工艺,得到包封率较高、粒径在纳米级别(<100nm)的VC纳米脂质体悬浮液,并在此基础上制备VC前体脂质体,研究VC纳米脂质体悬浮液及其前体脂质体的贮存稳定性。
1 材料与方法
1.1 材料与仪器
蛋黄卵磷脂 纯度为99%,购于华东师范大学化工厂;VC、胆固醇、Tween80、甘油、无水乙醇、盐酸、硫酸、硫脲、活性炭、2,4-二硝基苯肼、磷酸氢二钠、磷酸二氢钾、海藻糖 均为分析纯,购于上海国药集团化学试剂有限公司。
RE-52A型旋转蒸发器 上海青浦沪西仪器厂;SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司;AH-100D型超高压纳米均质机 加拿大ATS公司;755B型紫外-可见分光光度计 上海分析仪器总厂;Nano-Zs90型粒径分析仪 英国Malvern公司;DW-86L386型超低温保存箱 青岛海尔低温技术有限公司;LGJ-10型冷冻干燥机 北京松源华兴科技发展有限公司。
1.2 实验方法
1.2.1 VC纳米脂质体悬浮液及其前体脂质体的制备
1.2.1.1 单因素实验 采用乙醇注入法制备VC纳米脂质体悬浮液,操作如下:
称取一定质量的VC和Tween80溶解于40mL、pH6.5、0.05mol/mL 的 Na2HPO4-KH2PO4缓冲液(PBS)中。另称取400mg蛋黄卵磷脂和一定量的胆固醇溶解于8mL的无水乙醇中。用注射器将上述脂质乙醇溶液快速注入溶有VC和Tween80的PBS中,控制水合温度,水合一定时间,得到VC脂质体悬浮液。将悬浮液移入150mL圆底烧瓶内,经40℃减压旋转蒸发15min,挥去残留乙醇。
选择 VC添加量(80、120、160、200、240mg)、胆固醇与卵磷酯质量比(1∶6、1∶5、1∶4、1∶3、1∶2)、Tween80与卵磷脂质量比(1∶5、2∶5、3∶5、4∶5、1∶1)、水合温度(50、55、60、65、70℃)、水合时间(20、30、40、50、60min)为考察因素,研究各因素对悬浮液中VC脂质体包封率的影响。
1.2.1.2 正交实验设计 固定卵磷脂用量为400mg,水合时间为30min、乙醇用量为8mL、PBS用量为40mL,选取VC添加量(A)、胆固醇与卵磷脂质量比(B)、Tween80与卵磷脂质量比(C)、水合温度(D)作为考察因素,以包封率为指标,通过L9(34)正交实验进一步优化VC纳米脂质体悬浮液的制备工艺,因素水平表设计如下。
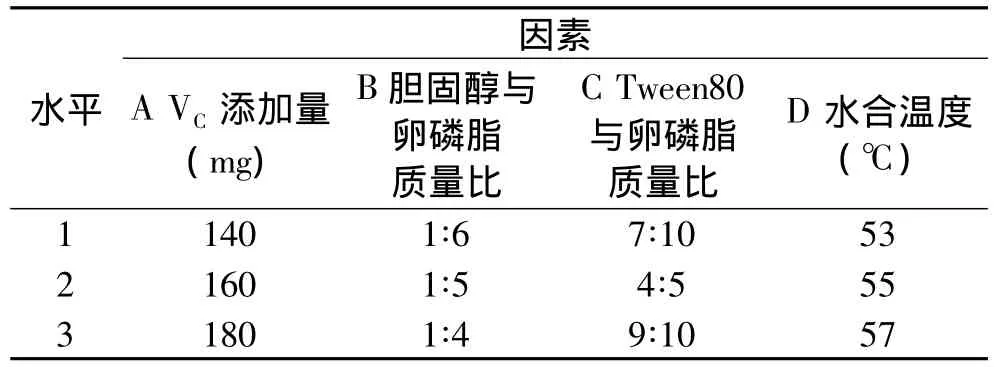
表1 正交实验因素水平Table 1 Factors and levels of the orthogonal test
用于性质研究的VC纳米脂质体悬浮液为上述优化后的最佳工艺制备所得,为了获得粒径较小的VC纳米脂质体悬浮液,采用100MPa高压均质循环处理3次。
1.2.1.3 VC前体脂质体的制备 参照1.2.1.1中的操作,向PBS中添加1600mg海藻糖,按照1.2.1.2中的最佳工艺制备得到含海藻糖的VC纳米脂质体悬浮液。将此悬浮液装于安培瓶中,-60℃预冻24h,后经冷冻干燥(温度-20℃;真空度<20Pa)24h,得VC前体脂质体。
1.2.2 包封率的测定
1.2.2.1 VC标准曲线的制作 以PBS作为溶剂,配制浓度分别为 0、8、16、32、48、64、80、96μg/mL 的 VC标准溶液。参照GB/T5009.86-2003中的2,4-二硝基苯肼法[16],制作 VC标准曲线(见图 1),求得线性回归方程为y=0.00341x+0.0168,R2=0.9998。由此可知在0~96μg/mL浓度范围内,VC溶液与吸光度线性关系良好。
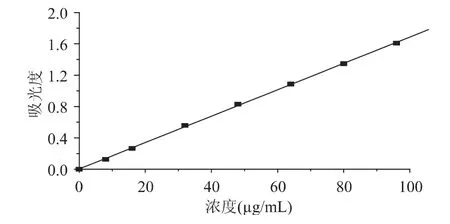
图1 VC标准曲线Fig.1 Standard curve of VC
1.2.2.2 包封率的测定 取VC脂质体悬浮液5mL置于已处理过的透析袋中,封口,以200mL PBS作为透析外液,室温下透析16h。取25mL透析外液,参照VC溶液标准曲线的制作方法,测定透析外液中VC的浓度C(μg/mL)。按式(1)计算包封率(EE):
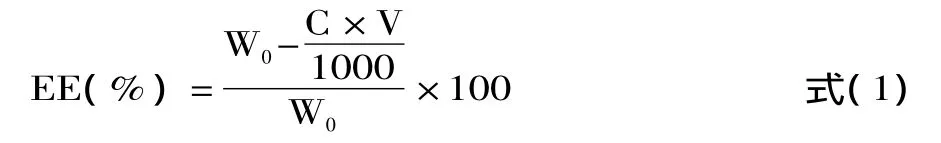
式中:W0为VC添加量(mg);V为透析外液与内液的总体积(mL)。
VC前体脂质体经PBS复水重建后按上述方法测定包封率。
1.2.3 粒径的测定 取VC纳米脂质体悬浮液或VC前体脂质体适量,以双蒸水稀释到适当浓度,取适量置于粒径分析仪的聚苯乙烯比色皿中(折光指数1.33),25℃保温3min,测定平均粒径和多分散指数。
1.2.4 贮存稳定性实验 取若干份新制备的VC纳米脂质体悬浮液(每份20mL)与前体脂质体(每份800mg),置于25mL的敞口试管内,分别在4℃与25℃条件下贮存 30、60、90、120、150、180d,测定平均粒径与渗漏率。按式(2)计算渗漏率(LR):

式中,EEt为t时刻的包封率;EE0为初始时刻的包封率。
2 结果与分析
2.1 VC纳米脂质体悬浮液的制备工艺优化结果
2.1.1 单因素实验
2.1.1.1 VC添加量的影响 由图2可知,在VC添加量较低的情况下,由于溶质分子的浓度较低,增加了脂质体在形成过程中对VC分子的“捕捉”难度,造成脂质体对目标物分子的包封率小。当VC添加量为160mg时,VC脂质体悬浮液的包封率最高,达到75.64%。但超过160mg的添加量,又导致VC的包封率降低,这是因为在一定的条件下,一定的磷脂用量形成的脂质体数量是有限的,一定数量的脂质体对于溶液中VC分子只表现有限的包封率,故当VC添加量超过160mg并继续增加时,包封率呈下降趋势。因此,选择VC添加量为160mg进行下一步实验。

图2 VC添加量对包封率的影响Fig.2 Effect of the content of VCon encapsulation efficiency
2.1.1.2 胆固醇与卵磷脂质量比的影响 由图3的结果可以看出,当胆固醇与卵磷脂的质量比在1∶6~1∶4范围内时,得到的包封率较高,其中1∶5时达到包封率最大值。当胆固醇用量继续增加时(1∶5~1∶2),包封率不断降低,这是由于胆固醇的加入,会增强脂质体双分子层膜的刚性和致密度,提高了脂质体的稳定性,防止VC的泄漏,确保了脂质体对VC的有效包封。但是,当胆固醇的加入比例超出一定范围,脂质体双分子层膜中的胆固醇嵌入量过高时,会干扰双分子层结构的形成,导致VC分子从脂质体中的泄漏[17]。因此,选择胆固醇与卵磷脂质量比为1∶5进行下一步实验。

图3 胆固醇与卵磷脂质量比对包封率的影响Fig.3 Effect of cholesterol to egg PC mass ratios on encapsulation efficiency
2.1.1.3 Tween80与卵磷脂质量比的影响 图4的结果表明,随着Tween80添加比例的增加,包封率增大,当Tween80的添加比例超过4∶5时,包封率呈现下降的趋势。Tween80的加入会使脂质体表面产生“稠化效应”[18],增加脂质体双分子层的有效厚度,提高对VC的包封效果;但Tween80对脂质体还存在着一定的增溶作用,过量的Tween80会造成脂质体结构的破坏,会导致VC的泄漏。所以Tween80的添加量要控制在一定的范围内,既能达到对悬浮液中脂质体的空间稳定效果,又要保证脂质体双分子层结构的完整性。因此,选择Tween80与卵磷脂质量比为4∶5进行下一步实验。

图4 Tween80与卵磷脂质量比对包封率的影响Fig.4 Effect of Tween80 to egg PC mass ratios on encapsulation efficiency
2.1.1.4 水合温度的影响 图5为水合温度对VC脂质体悬浮液包封率的影响,结果显示55℃时包封率最高,低于或高于55℃包封率都有所下降。在脂质体的制备过程中,必须控制水合温度高于磷脂的相变温度,这样才能使磷脂在PBS中分散均匀,有利于形成结构良好的脂质体,提高对芯材的包封率;而较高的水合温度可能会使得卵磷脂发生部分氧化,影响脂质体的形成与对芯材的包封率,同时过高温度也会加速VC的氧化。因此,选择水合温度为55℃进行下一步实验。

图5 水合温度对包封率的影响Fig.5 Effect of hydration temperature on encapsulation efficiency
2.1.1.5 水合时间的影响 由图6结果可知,在20~30min范围内,水合时间的变化对包封率的影响不明显,水合30min得到的包封率最大,水合60min得到的包封率最小,但两者相差仅为5.9%。考虑水合时间越长,可能造成的VC与卵磷脂氧化程度越大,因此水合时间不应选择过长,故选择30min进行正交实验。

图6 水合时间对包封率的影响Fig.6 Effect of hydration time on encapsulation efficiency
2.1.2 正交实验 正交实验结果见表2,可以看出:胆固醇与卵磷脂质量比是影响包封率的最重要因素,其次是VC添加量、Tween80与卵磷脂质量比,而水合温度影响程度最小;最优组合为A2B2C2D2。
由于A2B2C2D2组合没有出现在所设计的正交实验中,因此将 A2B2C2D2组合与正交实验中的A2B2C3D1组合进行三次平行验证实验,结果见表3。
由表 3中的结果可知,A2B2C2D2组合优于A2B2C3D1组合。最终确定乙醇注入法制备VC脂质体悬浮液的最佳工艺条件为:VC添加量为160mg,胆固醇与卵磷脂的质量比为1∶5,Tween80与卵磷脂质量比为4∶5,水合温度为55℃。在该工艺条件下制备的VC脂质体悬浮液的平均包封率为78.11%,高于童桂鸿、杨水平、陈婷婷以及赵华等人[5-8]分别采用薄膜分散法、逆相蒸发法、复乳法制备得到的VC脂质体悬浮液的包封率。

表2 正交实验结果Table 2 Results of the orthogonal test

表3 验证实验结果Table 3 Results of verification experiments
2.2 VC纳米脂质体悬浮液及其前体脂质体的贮存稳定性
测得新制备的VC纳米脂质体悬浮液及其前体脂质体的平均粒径分别为89.62、121.14nm,多分散指数分别为0.160、0.195。结果表明,制备的VC纳米脂质体粒径在纳米级别(<100nm),且粒径分布范围较窄、分布均匀;与VC纳米脂质体悬浮液相比,前体脂质的平均体粒径和多分散指数有所增大,可能是干燥过程中部分脂质体的相互融合所致。
图7结果显示,在4和25℃的贮存温度下,VC纳米脂质体悬浮液及其前体脂质体的平均粒径与渗漏率都随贮存时间的延长而增大;但后者变化趋势小于前者,这表明经冷冻干燥后VC脂质体的贮存稳定性得到提高。另外,与4℃相比,在25℃的贮存温度下,VC纳米脂质体悬浮液及其前体脂质体的平均粒径、渗漏率随贮存时间的延长增加趋势要大得多,这说明随着贮存温度的升高,两种VC脂质体体系的稳定性都是下降的。
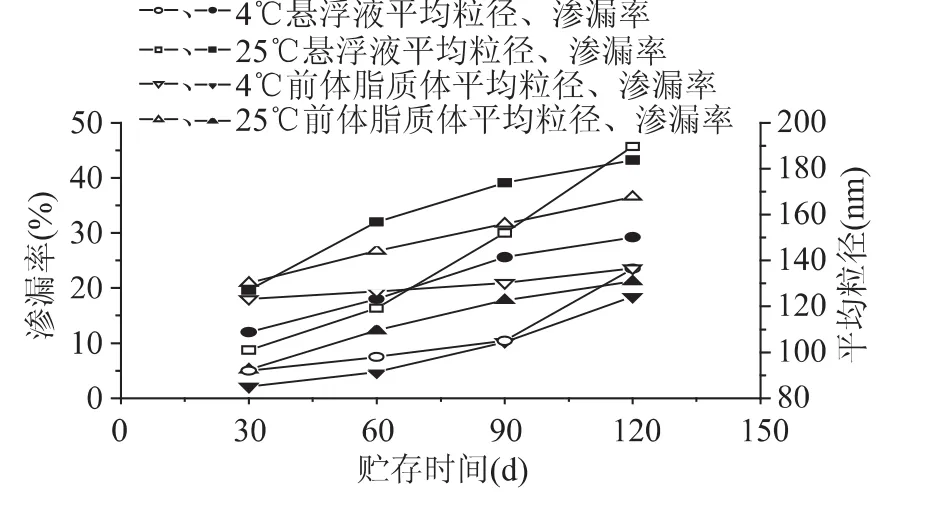
图7 VC纳米脂质体悬浮液及其前体脂质体的贮存稳定性Fig.7 Stability of VCnanoliposomes suspension and VCproliposomes during storage period
3 结论
通过单因素实验和正交实验优化了乙醇注入法制备VC纳米脂质体悬浮液的工艺,得到最佳制备工艺为:卵磷脂用量400mg、乙醇用量8mL、PBS用量40mL,VC添加量160mg、胆固醇与卵磷脂的质量比1∶5、Tween80 与卵磷脂质量比 4∶5、水合温度 55℃、水合时间30min,采用100MPa高压均质后处理,循环次数为3次,得到平均包封率为78.11%。按此最佳制备工艺得到的VC纳米脂质体悬浮液的平均粒径为89.62nm,多分散指数为0.160;该悬浮液经冷冻干燥后得到平均粒径为121.14nm、多分散指数为0.195的VC前体脂质体。贮存稳定性实验结果表明,两种VC脂质体体系的稳定性都受到贮存时间与贮存温度的影响,但前体脂质体的稳定性高于VC纳米脂质体悬浮液。
[1]夏延斌 .食品化学[M].北京:中国农业出版社,2004:165-166.
[2]Austria R,Semenzato A,Bettero A.Stability of vitamin C derivatives in solution and topical formulations[J].Journal of Pharmaceutical and Biomedical Analysis,1997,15:795-801.
[3]李书国,薛文通,李雪梅,等.乙基纤维素微胶囊化VC及其活性保护的研究[J].食品工业科技,2005,26(5):143-148.
[4]王亚楠,李钐,崔翠,等.菠菜汁中 VC稳定性的研究[J].浙江农业科学,2010(3):554-557.
[5]童桂鸿.维生素C纳米脂质体的制备及其性质的研究[D].南昌:南昌大学,2011.
[6]杨水平,刘成梅,刘伟,等.VC脂质体的制备与稳定性研究[J].食品科学,2010,31(20):230-234.
[7]陈婷婷.维生素 C脂质体的研究[D].无锡:江南大学,2008.
[8]赵华,董银卯,何聪芬,等.维生素C脂质体的制备与研究[J].香料香精化妆品,2006(3):17-20.
[9]杨水兵,刘伟,刘成梅,等.中链脂肪酸-维生素C冻干脂质体的制备工艺研究[J].食品工业科技,2011,32(11):244-248.
[10]郭成峰,张伟,刘宁.制备乳脂肪球膜磷脂-维生素A脂质体的工艺优化[J].食品工业科技,2011,32(2):195-198.
[11]Monroig ó,Navarro J C,Amat F,et al.Enrichment of Artemia nauplii in vitamin A,vitamin C and methionine using liposomes[J].Aquaculture,2007,269:504-513.
[12]Liu N,Park H J.Factors effect on the loading efficiency of Vitamin C loaded chitosan-coated nanoliposomes[J].Colloids and Surfaces B:Biointerfaces,2010,76:16-19.
[13]吴韶敏,曹劲松.脂质体技术应用于食品工业的最新研究进展[J].中国油脂,2007,32:42-46.
[14]许时婴,夏书芹,张晓鸣,等.微胶囊技术-原理与应用[M].北京:化学工业出版社,2006:112-115.
[15]Lasic D D.Liposomes:from physics to applications[M].New York:Elsevier Science Publishers,1993:302-305.
[16]中华人民共和国标准化管理委员会.GB/T5009.86-2003:中华人民共和国国家标准[S].北京:中国标准出版社,2003.
[17]Agarwal R,Katare O P,Vyas S P.Preparation and in vitro evaluation of liposomal/niosomal delivery systems for antipsoriatic drug dithranol[J].International Journal of Pharmaceutics,2001,228:43-52.
[18]范明辉.红景天苷纳米脂质体的研制[D].无锡:江南大学,2008.

