UPLC-MS/MS定性测定紫薯花青苷方法研究
高 玥,李新生,2,3,* ,韩 豪,朱渭兵,马娇燕,杨智勇
(1.陕西理工学院,陕西汉中723000;2.陕西省资源生物重点实验室,陕西汉中723000;3.陕西省黑色有机食品工程技术研究中心,陕西汉中723000;4.杨凌金薯种业科技有限公司,陕西杨凌712100)
紫薯(Ipomoea batatas(L.)Lam),属旋花科甘薯属草本植物,薯肉呈紫色至深紫色,又叫黑薯、紫心甘薯或紫肉甘薯,它不仅含普通甘薯的营养成分,而且含有大量的花青苷和硒元素[1]。紫薯花青苷主要为酰基化花青苷[2],因此,紫薯花青苷作为食品添加剂具有较好的着色能力和稳定性。据文献报道紫薯花青苷具有抗氧化、抗突变、抗肿瘤、增强记忆等多种生理功能[3-5]。根据国内外研究现状,目前花青苷常用的检测方法有可见分光光度法、紫外-可见分光光度法、高效液相色谱法等[6-8],但单纯使用 UV 或HPLC均存在检测灵敏度低,检测用时长等不足。关于紫薯花青苷超高效液相色谱—三重四级杆串联质谱(UPLC/MS-MS)测定方法尚未见报道。本实验以紫薯为实验材料,建立UPLC/MS-MS测定方法,分析紫薯花青苷的组分,旨在为紫薯花青苷的分析检测提供新的方法。
1 材料与方法
1.1 材料与仪器
紫薯样品 农林47、紫薯1号,杨凌金薯种业科技有限公司;乙腈、甲醇 色谱纯,霍尼韦尔公司;甲酸 色谱纯,天津科密欧化学试剂有限公司;矢车菊素-3-葡萄糖苷(Cy-3-glu)Cas No.7084-24-4,C21H21O11,相对分子质量449.38,含量99.5%,sigma公司;芍药素-3-葡萄糖苷(Pn-3-glu)Cas No.6906-39-4,C22H23ClO11,相对分子质量 498.9,含量99.5%,sigma公司。
超高效液相—三重四极杆串联质谱联用仪 配电喷雾离子源,美国waters公司;BSA224S型电子分析天平 赛多利斯科学仪器有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;LC-800离心机 科大创新股份有限公司;DZF6050真空干燥箱 上海一恒科学仪器有限公司;KQ-100DA型数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 样品溶液制备
1.2.1.1 材料预处理 将选好的紫薯块根清洗干净,切片(厚度约2~5mm的薄片),在45℃温度下烘干(失水70%左右),然后用粉碎机粉碎,过筛80目,放置干燥、避光的地方,待用。
1.2.1.2 样品制备 准确称取5g样品倒入50mL的平底烧瓶内,加入50mL 90%甲醇溶液(含0.1%甲酸),超声提取30min,取上清液于100mL棕色容量瓶中,二次加50mL 90%酸性甲醇(含0.1%甲酸)超声提取30min,合并两次提取液,摇匀,用旋转蒸发仪浓缩10倍后再置40℃真空干燥箱中干燥至溶剂挥干,然后用6%甲酸水溶液溶解,并定容于25mL棕色容量瓶中。离心后,分别取2.5mL紫薯花青苷样品紫薯1号和农林47的定容液于50mL容量瓶中,用6%甲酸水溶液再次定容后,用0.2μm的针头过滤器过滤,于超高效液相-三重四极杆串联质谱仪测定。
1.2.2 标准溶液的配制 精密称取1mg花青苷标准品,用6%的甲酸水溶液溶解并定容至25mL棕色容量瓶中,摇匀后静置,即为40μg/mL的花青苷标准品母液。再将标准品母液稀释40倍即为1μg/mL的标准品工作液,4℃下保存,储备时间不超过48h。
1.2.3 色谱流动选择 选用矢车菊素-3-葡萄糖苷和芍药素-3-葡萄糖苷为分离实验样,UPLC C18(2.1mm×50mm,1.7μm)为样品色谱分离柱,柱温:40℃,流速:0.3mL/min,进样量:10μL为实验条件,分别采用0.5%甲酸水溶液、1%甲酸水溶液、6%甲酸水溶液、10%甲酸水溶液和乙腈等溶剂作为流动相,以实验样分离度、色谱峰形为考核指标,选择适用于流动相的溶剂及梯度洗脱条件。
1.2.4 质谱条件选择 离子源:电喷雾离子源(ESI);扫描方式:正离子扫描;检测模式:多反应监测;毛细管电压:3kV;离子源温度:110℃;脱溶剂气温度:400℃;脱溶剂气流量:800L/h;锥孔气流量:50L/h。并分别采用300ng/mL矢车菊素-3-葡萄糖苷和芍药素-3-葡萄糖苷标准溶液在电喷雾离子源(ESI)正离子模式下进行母离子全扫描,确定矢车菊素-3-葡萄糖苷和芍药素-3-葡萄糖苷的分子母离子,并对其子离子进行全扫描,确定两个特征子离子,比较碰撞电压和锥孔电压对检测的影响,优化质谱参数。
1.2.5 花青苷测试样溶液配制溶剂的选择 分别采用蒸馏水、50%甲醇、甲醇、甲醇(含6%甲酸)、50%甲醇(含6%甲酸)、6%甲酸水溶液配制花青苷标准溶液,在最佳的质谱和色谱条件下,采用多反应监测模式进行监测,优化其溶剂。
2 结果与分析
2.1 色谱条件
选择出的流动相:A为乙腈,B为6%的甲酸水溶液,梯度洗脱条件如表1所示。

表1 超高效液相色谱参数Table 1 The table of UPLC gradient elution
2.2 质谱条件
在ESI正离子模式下进行母离子全扫描,确定了矢车菊素-3-葡萄糖苷的分子离子为m/z 449.1,与文献报道一致[9]。以m/z 449.1为母离子,对其子离子进行全扫描,m/z 287、m/z 136.9两个子离子丰度较强,作为矢车菊素-3-葡萄糖苷定性分析子离子,其可能的结构式见图1所示。以MRM正离子模式优化确定了最佳碰撞电压和锥孔电压的参数为锥孔电压为32V,碰撞电压分别为56、22V时,m/z 287和m/z 136.9碎片离子的强度较大。

图1 矢车菊素-3-葡萄糖苷质谱裂解方式Fig.1 Proposed fragmentation pathways of cyaniding-3-glucoside
在ESI正离子模式下进行母离子全扫描,确定了芍药素-3-葡萄糖苷的分子离子为m/z 623.9,以m/z 623.9为母离子,对其进行子离子全扫描,m/z 311和150.9两个子离子丰度较强,作为芍药素-3-葡萄糖苷的定性分析子离子,其可能的结构式见图2所示。以MRM正离子模式优化确定了最佳碰撞电压和锥孔电压的参数为锥孔电压为30V,碰撞电压分别为22、38V时,m/z 311和 m/z 150.9碎片离子的强度较大。
2.3 溶剂的优化

图2 芍药素-3-葡萄糖苷质谱裂解方式Fig.2 Proposed fragmentation pathways of peonidin-3-glucoside
结果表明:a.用蒸馏水配制的标准溶液响应值较低;b.50%甲醇、甲醇、甲醇(含6%甲酸)、50%甲醇(含6%甲酸)均出现峰形前伸的现象;c.6%的甲酸水溶液配制的标准溶液,响应值最高,峰形最好(如图3所示)。
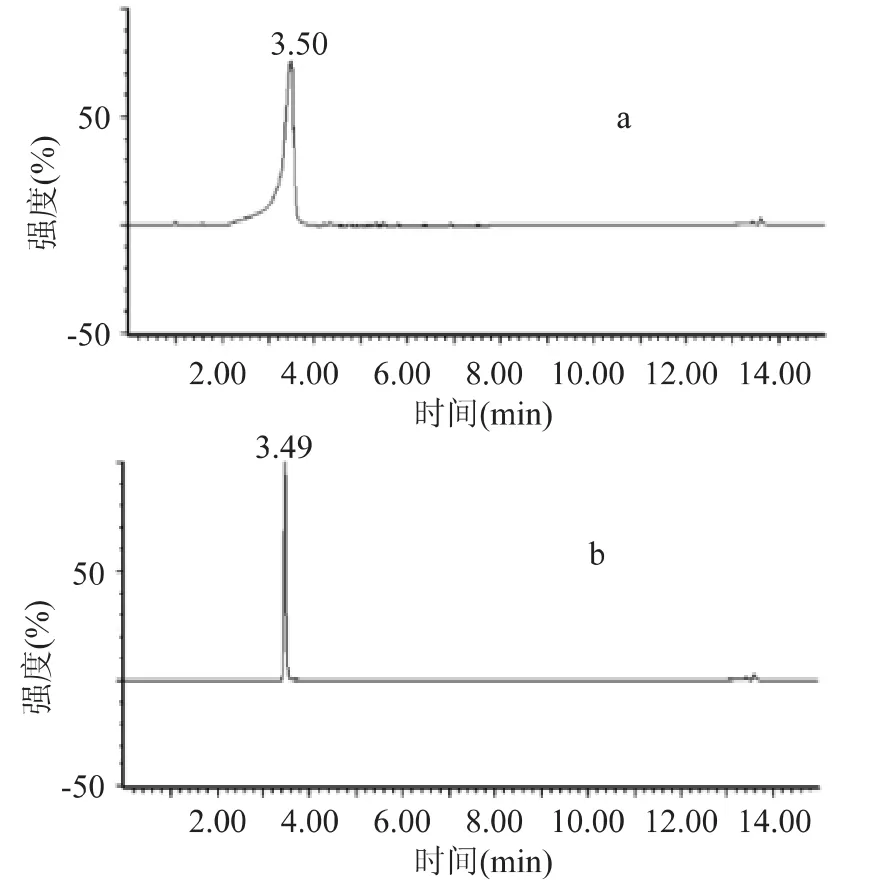
图3 矢车菊素-3-葡萄糖苷标准品的总离子色谱图Fig.3 Total ion current of cyanidin 3-glucoside standard solution
2.4 紫薯花青苷样品组分的测定
2.4.1 紫薯1号样品花青苷组分的测定
2.4.1.1 矢车菊素-3-葡萄糖苷标准溶液的MRM扫描 在优化的液相和质谱条件下,对矢车菊素-3-葡萄糖苷花青苷标准样进样,以m/z 449.1>287和m/z 449.1>136.9为定性离子对,矢车菊素-3-葡萄糖苷标准溶液在锥孔电压为32V,碰撞电压分别为22、56V时,其保留时间3.49min。(色谱图见图4)。

图4 矢车菊素-3-葡萄糖苷标准品的总离子色谱图Fig.4 Total ion current of cyaniding-3-glucoside standard solution
2.4.1.2 紫薯1号样品溶液MRM扫描 在矢车菊素-3-葡萄糖苷标准溶液相同的仪器参数条件下,以m/z 449.1>287和m/z 449.1>136.9为定性离子对,分析紫薯1号中花青苷是否有矢车菊素-3-葡萄糖苷。由紫薯1号花青苷提取液的总离子色谱图(见图5)可得,三个主要色谱峰为 3.49、5.19和13.43min,其中保留时间为3.49min的色谱峰与矢车菊素-3-葡萄糖苷的保留时间一致,且分子量相同,两个特征子离子分别为m/z 287和m/z 136.9,与标准品一致,确定为矢车菊素-3-葡萄糖苷。保留时间为5.19min的色谱峰的分子量与矢车菊素-3-葡萄糖苷的分子量相同,具有相同的特征离子对,但是保留时间与矢车菊素-3-葡萄糖苷不同,可见该化合物是矢车菊素-3-葡萄糖苷的同分异构体,但是具体结构还有待进一步研究。由于流动相为梯度洗脱,样品分析时间在0~12,12~15min为清洗色谱柱和平衡色谱柱压力时间,故保留时间为13.43min的色谱峰为流动相变化明显产生的溶剂峰,而非样品出的峰。

图5 紫薯1号的总离子色谱图Fig.5 Total ion current of Purple sweet potato(Zishu No.1)
2.4.2 农林47样品花青苷组分的测定
2.4.2.1 芍药素-3-葡萄糖苷标准溶液 MRM扫描 在优化的液相和质谱条件下,对芍药素-3-葡萄糖苷花青苷标准样进样,以m/z 623.9>311和m/z 623.9>150.9为定性离子对,矢车菊素-3-葡萄糖苷标准溶液在锥孔电压为30V,碰撞电压分别为22、38V时,其保留时间4.32min。(色谱图见图6)
2.4.2.2 农林47样品溶液MRM扫描 在芍药素-3-葡萄糖苷标准溶液相同的仪器参数条件下,以m/z 623.9>311和m/z 623.9>150.9为定性离子对,分析农林47中花青苷是否有芍药素-3-葡萄糖苷。由农林47花青苷提取液的总离子色谱图(见图7)可得,四个主要色谱峰为 4.32、5.44、6.82、9.16、16.23min,其中保留时间为4.32min的色谱峰与芍药素-3-葡萄糖苷的保留时间一致,且分子量相同,两个特征子离子分别为m/z 623.9>311和 m/z 623.9>150.9m/z,与标准品一致,确定为芍药素-3-葡萄糖苷。保留时间为5.44、6.82和9.16min的色谱峰的分子量与芍药素-3-葡萄糖苷的分子量相同,具有相同的特征离子对,但是保留时间与芍药素-3-葡萄糖苷不同,可见该两种化合物是芍药素-3-葡萄糖苷的同分异构体,但是具体结构还有待进一步研究。由于流动相为梯度洗脱,样品分析时间在0~12、12~15min为清洗色谱柱和平衡色谱柱压力时间,故保留时间为13.23min的色谱峰为流动相变化明显产生的溶剂峰,而非样品出的峰。
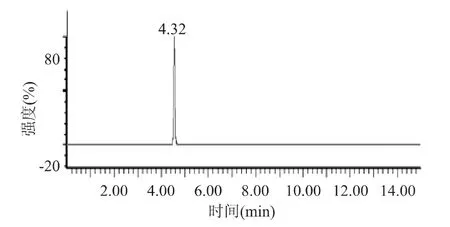
图6 芍药素-3-葡萄糖苷标准品的总离子色谱图Fig.6 Total ion current of Pn-3-glu standard solution

图7 农林47的总离子色谱图Fig.7 Total ion current of Purple sweet potato(Nonglin 47)
3 结论
本实验采用UPLC-MS/MS测定方法,从紫薯1号、农林47花青苷提取液中检测出两种紫薯花青苷组分,分别为矢车菊素-3-葡萄糖苷和芍药素-3-葡萄糖苷,目前对此紫薯1号、农林47两种样品的花青苷分析尚未见报道。
根据相关文献报道采用高效液相色谱法分析矢车菊素-3-葡萄糖苷的保留时间为 13.551min[10],采用UPLC/MS-MS法分析矢车菊素-3-葡萄糖苷的出峰时间为3.49min,相比较UPLC/MS-MS法分析保留时间明显缩短。HPLC分析定性分析是依据样品保留时间是否与标准品的保留时间一致作为鉴别标准进行分析,而UPLC/MS-MS法是通过对母离子、子离子和保留时间双重标准进行定性分析,因此采用UPLC/MS-MS法分析花青苷具有准确度高、有简单、快速的特点,解决了液相色谱检测用时长等问题。
[1]张明,王燕.紫甘薯中的功能性成分研究[J].农产品加工,2010(5):65-70.
[2]Fan Qiu,Jianguang Luo,Shun Yao,et al.Preparative isolation and purification of anthocyanins from purple sweet potato by high speed counter-current chromatography[J].J Sep Sci,2009,32:2146-2151.
[3]Makoto YOSHIMOTO,Shigenori OKUNO.Antimutagenicity of Sweetpotato(Ipomoea batatas)Roota[J].Biosci Biotechnol Biochem,1999,63(3):537-541.
[4]Dong-Tiann HUANG,Chun-Der LIN,Hsien-Jung CHEN,et al.Antioxidant and antiproliferative activities of sweet potato(Ipomoea batatas[L.]Lam ‘Tainong 57’)constituents[J].Bot Bull Acad Sin,2004,45:179-186.
[5]Jungsook Cho,Jong Seong Kang,Pham Seet Long.Antioxidant and memory enhancing effects of purple sweet potatoes anthocyanin and cordyceps mushroom extract[J].Arch Pharm Res,2003,26(10):821-824.
[6]J B Harborne.Spectral methods of characterizing anthocyanins[J].Biochem J,1958,70(1):22-28.
[7]韩豪,李新生,张志键,等.膜技术在黑米花青苷色素脱脂和浓缩中的应用[J].食品科学,2012,33(6):297-300.
[8]毛建霏,付成平,郭灵安,等.可见分光光度法测定紫甘薯总花青素含量[J].食品与发酵科技,2010,46(2):201-204.
[9]Abdel- Aal E S M,Young J C,Rabalski I.Anthocyanin composition in black,blue,pink,purple,and red cereal grains[J].J Agric Food Chem,2006,54(13):4696-4704.
[10]薛晓丽.HPLC法测定黑米中花青素的主要成分及含量[J].安徽农业科学,2009,37(11):4854-4855.

