成纤维细胞生长因子23与血液透析患者血磷和甲状旁腺激素浓度的关系
徐丰博 刘惠兰 孙 懿
(首都医科大学附属复兴医院肾内科,北京100038)
成纤维细胞生长因子23(fibroblast growth factor 23,FGF23)是一种体内参与血磷及1,25-二羟活性维 生 素 D3[1,25-dihydroxy-cholecalciferol,1,25-(OH)2D3]调节的重要因子,其不仅在钙磷代谢中起重要作用,而且与甲状旁腺激素(parathyroid hormone,PTH)关系密切。2009年K/DOQI骨代谢和矿物质代谢指南的新问题中指出:FGF23是血磷的主要调节激素,可作为慢性肾脏病(chronic kidney disease,CKD)进展和CKD透析患者死亡的主要标志,并可能成为指导骨和矿物质代谢调控的指标工具[1]。本研究旨在探讨维持性血液透析(maintenance hemodialysis,MHD)患者及继发性甲状旁腺功能亢进者FGF23的浓度及其与血磷、血甲状旁腺激素(parathyroid hormone,PTH)间的关系。
1 材料与方法
1.1 研究对象
来自首都医科大学附属复兴医院血液净化中心的稳定MHD患者50例,男21例,女29例,年龄34~86岁,平均(65.86±5.08)岁,MHD时间>3个月,每周透析3次及以上,每次透析时间4~4.5 h,透析液钙浓度1.5 mmol/L。选择同时期健康体检者30人,男11例、女19例,年龄51~83岁,平均(66.50±10.21)岁,以上均排除严重感染、肝功能损害、甲状旁腺疾病、恶性肿瘤、骨折者。试验得到医院伦理委员会批准,所有入选患者签署知情同意书。
1.2 研究方法
根据PTH浓度分为A1组(PTH<300 pg/mL)、A2组(PTH为300~500 pg/mL)、A3组(PTH>500 pg/mL)。
1.3 观察指标
所有检测对象过夜禁食10~12 h后,于清晨空腹抽取肘正中静脉血,测定FGF23及1,25-(OH)2D3所需标本均离心后取血清分离,-70℃冰箱保存,3月内测定。血钙、血磷(phosphorus,P)、血白蛋白(albumin,ALB)、碱性磷酸酶(alkaline phosphatase,ALP)由复兴医院检验科在日本日立7170S+ISE全自动化学分析仪上进行检测。校正钙(calcium,Ca)根据公式:校正钙(mmol/L)=[测定钙×4+(4.0-血清白蛋白)×0.8]/4。血清PTH采用瑞士罗氏-E170全自动免疫分析仪化学发光免疫法测定。FGF23及1,25-(OH)2D3均采用酶联免疫吸附双抗体夹心方法测定,FGF23试剂盒购于美国 Millipore公司,1,25-(OH)2D3试剂盒购于英国IDS公司。
1.4 统计学方法
采用SPSS11.0统计学软件进行分析,计量资料采用均数±标准差(±s)表示,非正态分布资料应用常用对数进行转换。两组间均数资料的比较,方差齐时采用t检验,方差不齐时采用t'检验;多组均数的比较采用方差分析。回归分析FGF23与其他指标相关性;多元线性回归分析影响FGF23的因素。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
50例MHD患者中,原发病分别为:高血压肾损害15例、慢性肾小球肾炎12例、糖尿病肾病9例、慢性间质性肾炎4例、多囊肾3例、慢性肾盂肾炎3例、原发性肾病综合征2例、泌尿系肿瘤2例。
2.2 MHD组与对照组临床资料比较
两组间性别构成比及年龄差异均无统计学意义(P>0.05),具有可比性。MHD组的血磷(P=0.000)、钙磷乘积(P=0.000)、LogALP(P=0.014)、LogPTH(P=0.000)、LogFGF23(P=0.000)均高于对照组,而 Log1,25-(OH)2D3低于对照组(P=0.000),详见表1。
2.3 MHD患者根据PTH分组后各组临床资料比较
PHT>500 ng/mL组较PTH<300 ng/mL组血磷(P=0.000)、钙磷乘积(P=0.000)、Log FGF23(P=0.007),LogALP(P=0.003)明显升高,PHT>500 ng/mL组及PTH在300~500 ng/mL组较PTH<300 ng/mL组应用1,25-(OH)2D3比例明显升高,详见表2。
2.4 MHD 患者 FGF23与血磷、PTH、1,25-(OH)2D3的相关性分析
Log FGF23 与 LogPTH(r=0.713,P=0.000)、血磷(r=0.593,P < 0.000)、Log ALP(r=0.240,P=0.032)呈正相关,与 Log 1,25-(OH)2D3(r=-0.584,P=0.000)呈负相关。

表1 MHD组与对照组资料比较Tab.1 Baseline characteristics of patients of the two groups
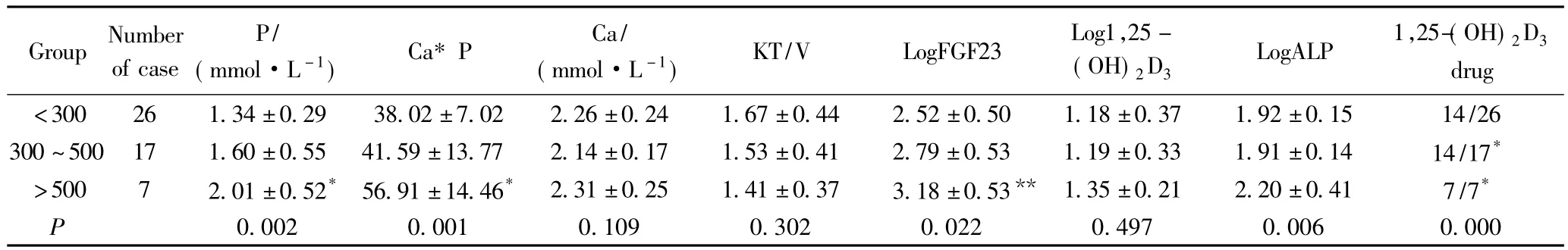
表2 MHD患者根据PTH分组临床资料比较Tab.2 Biochemical parameters of different PTH groups
2.5 MHD患者FGF23影响因素多元回归分析
逐步多元线性回归分析显示,血清 P(β=-0.572,P=0.005)、Ca·P(β =0.850,P=0.000)、Log PTH(β=0.453,P=0.017)是影响 Log FGF23的独立影响因素。
3 讨论
健康人循环中有低浓度的FGF23,由骨分泌,对抗饮食中磷负荷和1,25-(OH)2D3浓度的升高。FGF23可刺激尿磷的生成,抑制近端肾小管对磷的重吸收,使1,25-(OH)2D3生成下降,减少肠道磷吸收,从而维持机体正常血磷浓度[2-3]。成纤维细胞生长因子受体 1c(fibroblastgrowth factorreceptor 1C,FGFR1c)可能是FGF23调节尿磷的主要受体,而主要表达在组织的Ⅰ型跨膜蛋白Klotho蛋白可能具有调节FGF23的作用。Klotho蛋白是FGF23信号传导通路的关键因子,可提高FGF23和FGFR1c的亲和力。
在大多数透析患者中,FGF23远远高于正常浓度,来自美国一项10 044例血液透析患者的大型研究中,以血磷1.13~1.45 mmol/L为参照,发现血磷>1.78 mmol/L患者的病死率增加20%,而从中选取血液透析开始后1年死亡和存活的各200例进行研究显示:死亡组患者的血清FGF23浓度明显升高,且FGF23升高患者的死亡危险度增加50%,其中除外血磷>1.78 mmol/L的患者,高浓度的血清FGF23患者死亡危险度增加80%,提示血清FGF23能很好地预测血液透析患者的死亡风险[4]。本研究显示:透析患者较健康对照组相比,FGF23升高,同时血磷、钙磷乘积、PTH升高,推测透析患者FGF23升高的原因可能为:①动物实验[5]表明,小鼠饮食中的磷负荷增加可导致骨FGF23 mRNA和血清FGF23升高,对于透析患者,摄入含磷食物后血磷不能有效清除,本研究中透析患者血磷明显升高,血磷的升高刺激FGF23升高,而血液透析并不能清除 FGF23,本研究也显示FGF23与透析充分性无关,这间接提示FGF23并不能通过普通透析清除,从而导致大多数透析患者FGF23远远高于正常;②本研究多元线性回归显示,PTH升高为FGF23的独立危险因素。我们推测,甲状旁腺功能亢进可能促进了MHD患者体内FGF23的活性增加。在动物实验[6]中对正常肾功能的大鼠注射PTH,3日后便可使大鼠血清中FGF23浓度及颅骨中FGF23 mRNA表达升高。但来自日本学者的研究[7]却表明PTH并不能影响正常大鼠及尿毒症大鼠颅骨中FGF23及其mRNA的水平。可见,这一推测尚需进一步实验的证实。③本研究中大部分MHD患者应用了活性维生素D3。有学者[7]应用正常大鼠和尿毒症大鼠进行实验,应用活性维生素D3治疗后两者颅骨中FGF23浓度均升高,且在尿毒症大鼠组中FGF23明显升高。可见,在本研究中,活性维生素D3的应用在FGF23的升高中也起到了一定作用。
本研究中透析组即使应用了活性维生素D3,1,25-(OH)2D3浓度仍明显低于对照组,我们的研究同时显示,Log FGF23与Log1,25-(OH)2D3呈负相关,这与Ibrahim等[8]对50例埃及透析患者的临床观察的结论相同。考虑透析患者1,25-(OH)2D3浓度下降与CKD患者肾脏内分泌功能障碍,1-α羟化酶活性下降有关。同时透析患者FGF23升高,可以间接降低1,25-(OH)2D3。动物实验[9]表明,给小鼠注射重组FGF23,2 h后肾脏分泌的1-α羟化酶表达下降,而24-羟化酶表达升高,提示FGF23是通过此途径来降低1,25-(OH)2D3浓度。
FGF23不仅在钙磷代谢中起着重要作用,而且与透析患者继发性甲状旁腺功能亢进关系密切。本研究根据PTH水平将透析患者分成PTH<300 pg/mL组、PTH为300~500 pg/mL组以及PTH>500 pg/mL组,结果显示:PHT>500 ng/mL组较PTH<300 ng/mL组血磷、钙磷乘积、Log FGF23明显升高,同时多元回归提示Log PTH是影响Log FGF23的独立影响因素。可见在MHD继发性甲状旁腺功能亢进患者中FGF23是明显升高的,且FGF23的浓度和PTH浓度有一定关系。Kawata等[10]研究表明:在原发性甲状旁腺功能亢进模型小鼠中,FGF23的浓度与血PTH、血钙水平密切相关,与血磷水平呈负相关。这与我们的结论相似。目前考虑PTH可能是通过活化成骨细胞来调节血浆FGF23浓度的。
总之,CKD维持性血液透析患者的FGF23浓度升高,且在继发性甲状旁腺亢进患者中FGF23明显升高。
[1]Ramon I,Kleynen P,Body J J,et al.Fibroblast growth factor 23 and its role in phosphate hoestasis[J].Eur J Endocrinol,2010,162(1):1-10.
[2]Prié D,Ureña Torres P,Friedlander G.Latest findings in phosphate homeostasis [J].Kidney Int,2009,75(9):882-889.
[3]Komaba H,Fukagawa M.FGF23-parathyroid interaction:implications in chronic kidney disease[J].Kidney Int,2010,77(4):292-298.
[4]Gutiérrez O M,Mannstadt M,Isakova T,et al.Fibroblast growth factor 23 and mortality among patients undergoing hemodialysis[J].N Engl J Med,2008,359(6):584-592.
[5]Pewad F,Azam N,Zhang M Y,et al.Dietary and serum phosphorus regulate fibroblast growth factor 23 expression and 1,25-dihydroxyvitamin D metabolism in mice[J].Endocrinology,2005,146(12):5358-5364.
[6]Lavi-Moshayoff V,Wasserman G,Meir T,et al.PTH increases FGF23 gene expression and mediates the high-FGF23 levels of experimental kidney failure:a bone parathyroid feedback loop[J].Am J Physiol Renal Physiol,2010,299(4):F882-F889.
[7]Saji F,Shigematsu T,Sakaguchi T,et al.Fibroblast growth factor 23 production in bone is derectly regulated by 1α,25-dihydroxyvitamin D,but not PTH[J].Am J Physiol Renal Physiol,2010,299(5):F1212-F1217.
[8]Ibrahim S,Rashed L.Serum fibroblast growth factor-23 levels in chronic haemodialysis patients[J].Int Urol Nephrol,2009,41(1):163-169.
[9]Shimada T,Hasegawa H,Yamazaki Y,et al.FGF-23 is a potent regulator of vitamin D metabolism and phosphate homeostasis[J].J Bone Miner Res,2004,19(3):429-435.
[10]Kawata T,Imanishi Y,Kobayashi K,et al.Parathyroid hormone regulates fibroblast growth fator-23 in a mouse model of primary hyperparathyroidism[J].J Am Soc Nephrol,2007,18(10):2683-2688.

