通过液质联用鉴定蛋白质相互作用方法的建立
胡 家 郑 帅 胡 科 殷爱红*
(1.首都医科大学医学实验与测试中心,北京100069;2.首都医科大学基础医学院生物化学与分子生物学系,北京100069;3.首都师范大学生命科学学院细胞生物学系,北京100048)
蛋白质是生命功能的执行者,但大多数蛋白质并不能单独行使其功能,而是通过与其他蛋白质相互作用来参与细胞或组织的生理活动[1]。蛋白质组学研究的轰轰烈烈兴起开启了人们解析各种生命活动以及生理功能的新思路,近些年已经由比较蛋白质组学研究逐渐过渡到功能蛋白质组学研究。构建蛋白质相互作用网络能展示出两种以上蛋白质之间的相互依赖性以及这些蛋白质相互作用所起到的重要生理功能[2]。对于蛋白质相互作用研究的方法不断涌现,有蛋白芯片技术,X-射线晶体学技术、酵母双杂交、带标签-pull down技术、免疫共沉淀技术、多肽阵列技术以及荧光显微镜技术[3]。首都医科大学医学实验与测试中心蛋白质组学研究测试室已经开展将pull-down或免疫共沉淀之后的样品再经液质联用来鉴定相互作用的蛋白,本文介绍一种通过谷胱甘肽-s-转移酶(glutathione S-transferase,GST)-pull down技术寻找大鼠肾组织中与诱饵蛋白相互作用的蛋白,再通过聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)对pull down样品进行分离,最后通过液质联用技术来鉴定与诱饵蛋白相互作用的其他蛋白的方法。
1 材料和方法
1.1 材料
1)实验样品:带GST标签的诱饵蛋白,ZS蛋白(由于研究成果权限的原因,特此命名),其表达载体由首都医科大学贺俊崎教授实验室构建提供;大鼠[购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001]肾组织也是该实验室提供。
2)试剂:过硫酸铵,丙烯酰胺,甲叉双丙烯酰胺,TEMED,二硫苏糖醇(dithiothreitol,DTT),碘乙酰胺,SDS,甘氨酸,Tris,CHAPS均为美国 GE公司产品;胰蛋白酶(测序级)为美国Promega公司产品;乙腈,甲酸,考马斯亮蓝G250为美国Sigma公司产品。
1.2 大鼠肾组织GST-pull down实验
实验方法参考文章[4-5],取新鲜大鼠肾组织称质量后剪成碎块,用预冷的裂解缓冲液(HEPES 10 mmol/L,pH 7.4,NaCl 50 mmol/L,EDTA 5 mmol/L,1%Triton X-100,Benzamidine 1 mmol/L)以10 mL溶液:1 g组织的比例对大鼠肾组织进行蛋白质裂解,期间用匀浆器匀浆10 min(15 W),再冰浴超声,条件设置为超声5 s,间歇5 s,共12个循环,最后4 ℃,13 000 r/min离心15 min,取上清即为大鼠肾组织裂解液。
将等量纯化好的GST和ZS蛋白琼脂糖珠分别加入大鼠肾组织裂解液中,在4℃上下颠倒持续混合3 h,4℃,3 000 r/min离心1 min收集沉淀,并用1 mL预冷的洗涤液Ⅰ(HEPES 10 mmol/L,pH 7.4,NaCl 50 mmol/L,EDTA 5 mmol/L,0.1%Tween 20,3%BSA,Benzamidine 1 mmol/L)洗涤沉淀,共洗涤4次,每次振荡洗涤完用4℃,3 000 r/min离心1 min,收集沉淀,再用1 mL预冷的洗涤液Ⅱ(HEPES 10 mmol/L,pH 7.4,NaCl 50 mmol/L,EDTA 5 mmol/L,0.1%Tween 20,Benzamidine 1 mmol/L)洗涤沉淀1次,最后4℃,3 000 r/min离心1 min,收集沉淀,将此GST-pull down沉淀复合物中加入适量的一维电泳蛋白上样缓冲液,95℃加热5 min使蛋白变性,离心后取上清进行SDS-PAGE,采用7 cm凝胶,浓度为10%,再用考马斯亮蓝染色电泳后凝胶。
1.3 胶内酶切
根据PAGE凝胶的染色结果,从 ZS蛋白 pull down大鼠肾组织后的样品泳道上切下与对照差异有统计学意义的条带,将切下的条带再切碎成小颗粒,经脱色,还原,烷基化,之后30℃水浴酶切18 h[6-7]。
1.4 液质联用鉴定与ZS蛋白相互作用蛋白
将酶切完成的样品经超声振荡后,15 000 r/min离心15 min,取5 μL上清进行纳升级液相与ESI源离子阱质谱联用分析(Bruker Daltonics德国)。仪器由HyStarTM3.2和EsquireControlTM5.2软件(Bruker Daltonics)控制。液相条件:EasyTMC18(2 cm×100 μm,5 μm)为富集柱;EasyTMC18(10 cm ×75 μm,3 μm)为分析柱;流速设300 nL/min;流动相A是含0.1%甲酸的水溶液;流动相B为含0.1%甲酸的乙腈。梯度设置为0 min B液5%,0~45 min B液上升到35%,45~47 min,B液上升到95%,49 min B液95%,共运行50 min。质谱条件:离子化方式是纳升电喷雾正离子模式;每次扫描中5个强度最高的离子进行串联质谱分析;毛细管电压设4 000 V;Skimmer电压设40V;雾化装置压力0.069 MPa;干燥气5 L/min,温度设220℃;采集范围:MS为20~1 500 M/Z,MS/MS为100~2 500 M/Z。数据分析软件:Data Analysis 4.0;数据经软件分析之后通过Mascot检索软件检索本地SwissPort(201005)中的大鼠数据库,检索条件设为,Trypsin酶切,固定修饰选择M氧化,可变修饰为碘乙酰胺烷基化,漏切位点为1,MS质量数误差0.4%,MS/MS的质量数误差为0.7,所用仪器选ESI-Trap。依据MASCOT算法,匹配肽段数在3条以上,并且得分(score值)在可信区间内的蛋白为成功鉴定到的蛋白。
2 实验结果
2.1 ZS蛋白pull-down大鼠肾组织结果
从图1中可看出ZS蛋白pull-down大鼠肾组织裂解液的样品泳道(图中标注为3)比GST pull-down样品泳道(图中标注为2)在相对分子质量55 000与72 000之间明显多出一个条带,标注为#,再对应大鼠肾组织裂解液(lysate)泳道(图中标注为1)和右侧的ZS蛋白泳道(图中标注为4)显示,在ZS蛋白泳道相应位置并未出现此条带,在Lysate泳道此处有条带,这说明该条带是大鼠肾组织裂解液中由ZS蛋白pulldown下来的成分。
2.2 液质联用鉴定结果
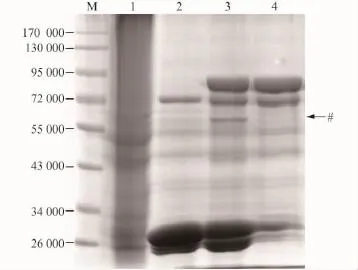
图1 GST pull-down实验寻找大鼠肾组织裂解液中与ZS蛋白相互作用的蛋白,所得沉淀经SDS-PAGE电泳后结果Fig.1 Screening of ZS binding partners by GST pull-down assay.The precipitates were run on SDS-PAGE
将此特异性条带(标记为#)切下之后进行胶内酶切,用酶解原液直接上样,经纳升级液相分离之后由ESI源离子阱质谱检测。图2是样品的基峰离子流图(base peak chromatogram,BPC),由每个时间点质谱图中最强离子的强度连续描绘所得。由BPC可看出,从12 min开始出峰,到45 min B相即有机相从5%升至35%样品基本洗脱完全,液相梯度设置合适,对样品的分离效果很好。液相每时每刻分离的样品进到质谱里进行检测,每个时刻将检测到的强度最高的5个离子作为母离子进行碎裂,做二级质谱(MS/MS),所得一级、二级质谱峰进过软件分析再通过数据库检索,由MASCOT算法得出Score值超过39分的为可信鉴定结果。本研究共鉴定出32种蛋白(表1)。图3显示二氢嘧啶酶(dihydropyrimidinase)的质谱鉴定情况。该蛋白是鉴定结果中得分最高的蛋白质,有127条序列与数据库高度匹配,其中一条得分最高的序列K.IPNGVNGVEDR.M,是质荷比(M/Z)为585.3的母离子经过离子阱的碰撞诱导裂解(collision-induced dissociation,CID)之后鉴定所得。在17.1 min时,该多肽从液相中大量洗脱出来,经质谱分析得到一级质谱峰如图3(A),该母离子为二价形式即(M+2H)2+,经二级碎裂后所得质谱峰如图3(B)。
3 讨论
Pull-down技术是由Smith及其研究团队于1988年利用GST融合标签纯化出GST融合蛋白,由此该技术开始成为一种热门研究方法[1,8]。该技术特异性较强、操作简便,是一种很好的筛选蛋白质相互作用的方法,但是并不能避免假阳性,还需要做进一步的研究来确证蛋白相互作用。
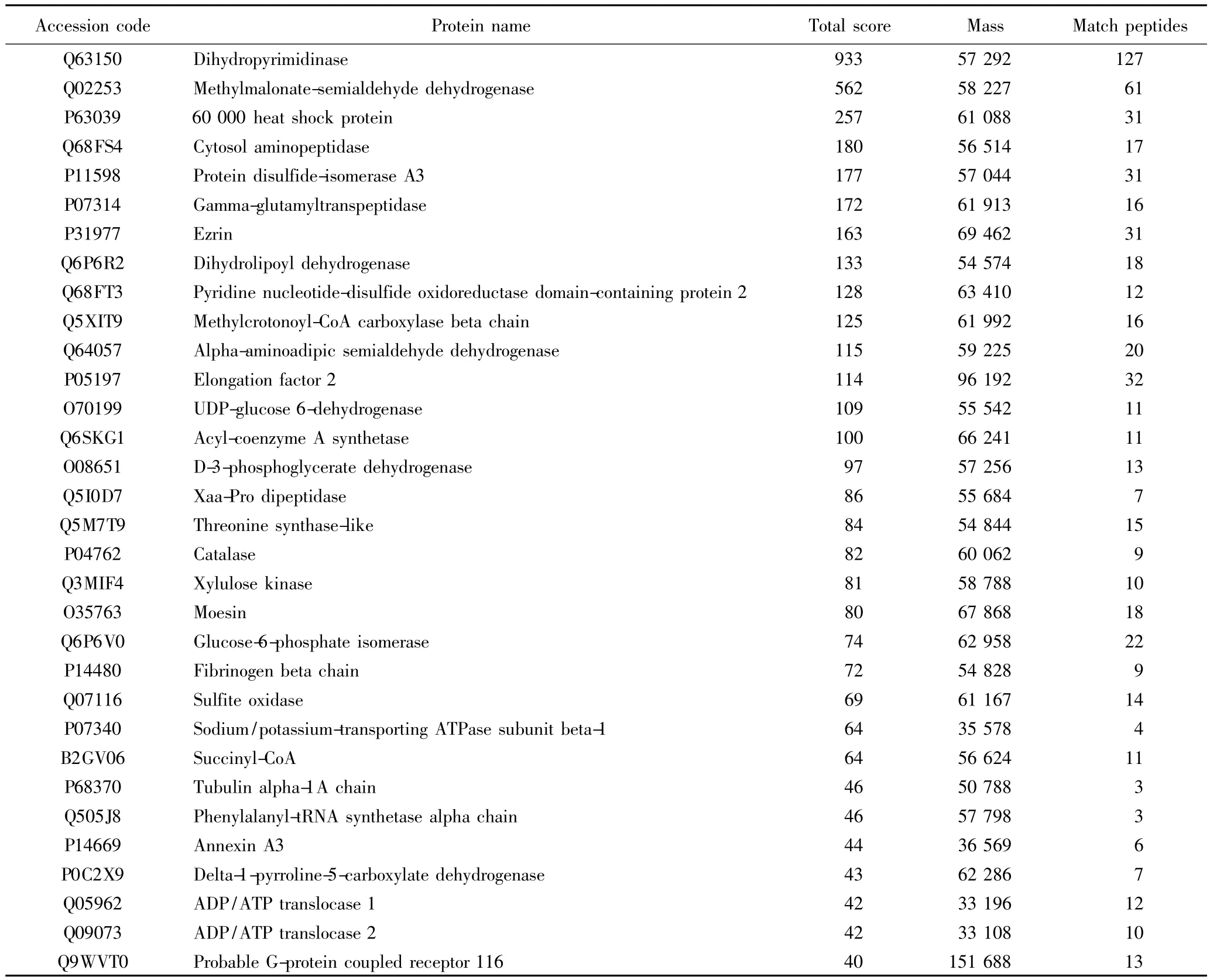
表1 #蛋白条带经液相色谱质谱联用鉴定结果Tab.1 The protein band#identified by liquid chromatography-electrospary ionization mass spectrometry tandem mass spectrometry(LC-MS/MS)
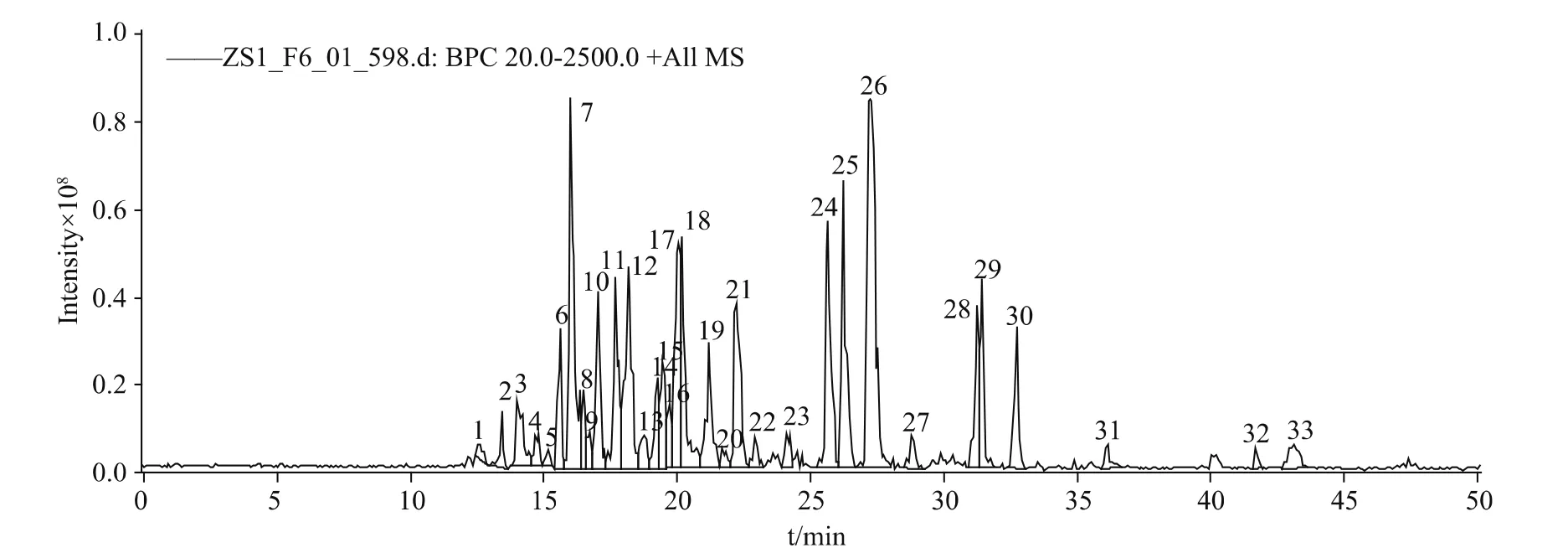
图2 #条带胶内酶切之后经液相色谱/质谱联用分析所得基峰离子流图Fig.2 Base peak chromatogram of the protein band#after digested in gel by liquid chromatography-electrospary ionization mass spectrometry tandem mass spectrometry(LC-MS/MS)
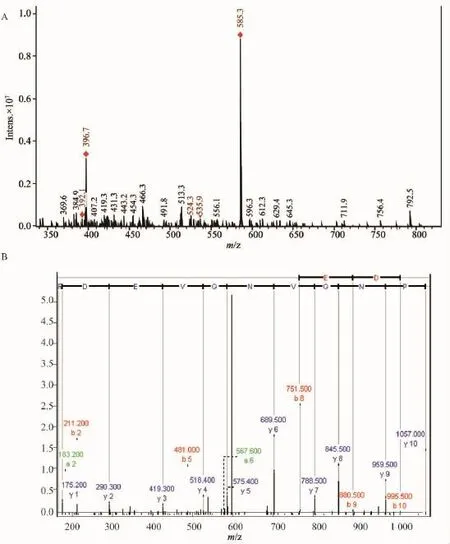
图3 #条带胶内酶切后经液质联用分析所得质谱图Fig.3 MS spectra of band#after digested in gel by liquid chromatography-clectrospary inoization mass spectrometry dandem mass spectrometry(LC-MS/MS)
在蛋白质组学研究中通常使用与纳升级液相联用的电喷雾电离源离子阱质谱来分析样品[9],其液相部分能自动进样,并用C18反向柱对样品进行浓缩分离,由此可实现高通量和高灵敏度。电喷雾源串联质谱法测定多肽氨基酸序列的关键步骤是通过CID过程得到适当碎片离子。采用的方法是在多肽一级质谱的基础上选择母离子,通常是(M+H)+或(M+nH)n+离子,在适当的碰撞能量下与惰性气体发生碰撞,导致多肽碎裂产生碎片离子。CID过程产生的碎片离子一般分为两大组6个系列,从N端开始的碎片离子以an、bn、cn表示,从C端开始的碎片离子以xn、yn、zn表示,母离子的某一系列碎片离子(比如yn系列)内相邻两个离子的质量数之差即是断裂处氨基酸残基的质量,由此可推断出多肽的氨基酸序列,不同系列离子所推断的氨基酸序列可互补[10-11]。本实验中离子阱检测到的二级碎裂峰中大多是y离子,这与母离子碎裂方式及离子阱的检测特点有关。
通过已知蛋白质相互作用网络显示了蛋白质的相互依存关系,有很多蛋白质不仅仅是两两结合的,大多数情况是多个蛋白质形成大的复合体并相互作用来行使某种生理功能,而我们可能只已知某几个蛋白的功能,但是通过对蛋白质相互作用的研究可发现其他蛋白质并了解其功能,由此更丰富并完善蛋白质相互作用网络[12]。传统研究蛋白相互作用的方法在未知蛋白质的鉴定上有困难[13-14],而引用质谱技术正好可弥补这一缺憾,并能实现高通量。
本实验通过pull-down技术结合液质联用鉴定了大鼠肾组织中可能与ZS蛋白相互作用的32种蛋白,此方法的建立为进一步研究ZS蛋白的功能奠定了基础。从表1所示的质谱鉴定结果来看,大多数属代谢相关酶类以及细胞骨架蛋白。其中Ezrin、moesin与ZS蛋白所在家族中其他蛋白有相互作用,而ZS蛋白会与其家族成员形成大的复合体并与细胞骨架蛋白有相互作用[15-16]。由此可说明本实验结果是可靠的。由于pull-down实验并不能保证所拉下来的蛋白一定与诱饵蛋白是特异结合的,所以鉴定到的蛋白是否与ZS蛋白确有特异结合并相互作用仍需进一步实验来证实。
[1]涂占晗,林旭.蛋白质相互作用研究的常用方法进展及比较[J]. 中国当代医药,2012,19(14):18-20.
[2]Bertolazzi P,Bock M E,Guerra C.On the functional and structuralcharacterization of hubs in protein-protein interaction networks[J]. BiotechnolAdv,2012,12(Online).
[3]Dwane S,Kiely P A.Tools used to study how protein complex are assembled in signaling cascades[J].Bioeng Bugs,2011,2(5):247-259.
[4]Zhang J,Cheng S,Xiong Y,et al.A novel association of mGluR1a with the PDZ scaffold protein CAL modulates receptor activity[J].FEBS Lett,2008,582(30):4117-4124.
[5]Yang L,Wang Y,Chen P,et al.Na(+)/H(+)exchanger regulatory factor 1(NHERF1)is required for the estradiol-dependent increase ofphosphatase and tensin homolog(PTEN)protein expression[J].Endocrinology,2011,152(12):4537-4549.
[6]Fulda S,Huang F,Nilsson F, et al.Proteomics of Synechocystis sp. strain PCC 6803. Identification of periplasmic proteins in cells grown at low and high salt concentrations[J].Eur J Biochem,2000,267(19):5900-5907.
[7]Smith M P,Zougman A,Ho J T,et al.A systematic analysis of the effects of increasing degrees of serum immunodepletion in terms of depth of coverage and other key aspects in top-down and bottom-up proteomic analyses[J].Proteomics,2011,11(11):2222-2235.
[8]Smith D B,Johnson K S.Single-step purification of polypeptides expressed in Escherichia coli as fusions with glutathione S-transferase[J].Gene,1988,67(1):131-140.
[9]Batycka M,Inglis N F,Cook K,et al.Ultra-fast tandem massspectrometry scanning combined with monolithic column liquid chromatography increases through put in proteomic analysis[J].Rapid Commun Mass Spectrom,2006,20(14):2074-2080.
[10]Ahmed K E,Chen W Q,John J P,et al.Complete sequencing of the recombinant granulocyte-colony stimulating factor(filgrastim)and detection of biotinylation by mass spectrometry[J].Amino Acids,2010,38(4):1043-1049.
[11]陈主初,肖志强.疾病蛋白质组学[M].北京:化学工业出版社,2006:100-103.
[12]Peter Schuck.Protein interactions biophysical approaches for the study of complex reversible systems[M/OL].New York:Springer,2007[2013-02-21].http://link.springer.com/book/10.1007/978-0-387-359663-3/page/1.
[13]殷爱红,胡家,阮昌,等.微波辅助的蛋白质酶解方法[J]. 首都医科大学学报,2012,33(4):134-136。
[14]徐小燕,夏蒲,邢亚楠,等.冻结破碎法提取组织蛋白方法初探[J].中国医科大学学报,2010,39(5):336 339.
[15]Sugiura T,Shimizu T,Kijima A,et al.PDZ adaptors:their regulation of epithelial transporters and involvement in human diseases[J].J Pharm Sci,2011,100(9):3620-3635.
[16]Lee J H,Nam J H,Park J,et al.Regulation of SLC26A3 activity by NHERF4 PDZ-mediated interaction[J].Cell Signal,2012,24(9):1821-1830.

