肾脏缺血再灌注损伤大鼠肾组织JNK/ATF-2信号通路表达及意义
宋年华,李 丹,徐 岩
(青岛大学医学院附属医院,山东 青岛 266003)
肾脏是发生缺血再灌注损伤(IR)极为常见的器官之一,肾移植、严重创伤、休克后延迟复苏会导致不同程度的肾脏IR,甚至可导致急性肾损伤和移植肾功能丧失[1]。c-jun氨基末端激酶(JNK)信号通路作为丝裂原活化蛋白激酶(MAPKs)超家族成员之一,在肾脏IR中发挥重要的调控作用[2]。JNK及其下游转录因子ATF-2在肾脏IR中的表达尚不清楚。2011年12月~2012年7月,我们观察了肾脏IR大鼠肾小管上皮细胞JNK/ATF-2信号通路的表达变化,探讨其在肾脏IR发生发展中的作用及机制。
1 材料与方法
1.1 材料 实验动物:Wistar大鼠60只,体质量200~250 g,动物实验室温度22~26℃,相对湿度40% ~60%,24 h昼夜灯光照射管制,清洁级颗粒饲料喂养,自来水饮用。主要试剂 :JNK、ATF-2磷酸化抗体(Santa Cruz公司),免疫组化试剂盒(青岛沃尔科生物技术公司),RT-PCR试剂盒(南京凯基公司),PCR 引物(上海生工),DMSO(Sigma公司)。实验仪器:显微镜(日本奥林巴斯)、切片机(德国莱卡RM2015)、离心机(北京LDZ5-2)、电子天平(瑞士METTER AE100)、移液器(德国 EPPENDORF)、干燥箱(日本三洋MDF-382E)、低温冰箱(日本三洋MIR-153)、恒温水浴箱(江苏DSHZ-300)、医用微波炉(浙江 YWY781B)、电泳仪(北京 DYY-12)、PCR仪(基因公司PE9600型)、制冰机(上海LQP-B-4)、纯水系统(Millipore公司Biocel)、核酸蛋白分析仪(贝克曼公司DU650)台式高速冷冻离心机(贝克曼64R)、凝胶成像系统(美国伯乐GEL DOC2000)。
1.2 模型制备 将60只大鼠随机分为假手术组(对照组)和缺血再灌注组(IR组)。大鼠适应性喂养1周,术前自由饮食,IR组参照文献[3],采用夹闭双侧肾动、静脉45 min后去夹再灌注制备IR模型。
1.3 相关指标观察 两组分别于再灌注0、10、30 min及1、24 h各处死大鼠6只,取肾组织4℃预冷生理盐水冲洗,矢状切取一半肾组织(兼顾肾皮髓质)4%甲醛固定,做免疫组化检测;另一半分装置于冻存管于液氮转-80℃保存,留作PCR检测。
1.3.1 肾小管上皮细胞JNK、ATF-2表达 ①磷酸化JNK、ATF-2蛋白表达:采用免疫组化SP法,一抗稀释度均为1∶100,PBS取代一抗作阴性对照。所有切片均在同一放大倍数下,每例随机选取5个高倍视野,观察肾小管上皮细胞JNK、ATF-2蛋白表达情况。结果经Image-Pro Plus分析软件处理,采用免疫组化评分(HIS)进行半定量分析[4],根据每张切片的阳性细胞面积及阳性细胞显色强度进行分级评分,HIS结果以两项乘积表示。②JNK、ATF-2 mRNA表达:采用RT-PCR法。Trizol法提取肾组织总RNA进行半定量RT-PCR反应。引物序列:β-actin 上游 5'-ACCACAGCTGAGAGGGAAATCG-3',下游5'-AGAGGACCTTACGGATGTCAACG-3';JNK上游 5'-ACAGTGAGCAGAGCAGGCATAGTG-3'下游5'-TCCTCCCCAAACAAAATAGAAACCA-3';ATF-2上游 5'-ACGGCAGTGGATTGGTAG-3',下游 5'-CTTCTTCTGCATGGCGGTTAC-3'。反应条件:预变性:95 ℃、5 min,1 个循环;PCR 反应:98 ℃、10 s,60 ℃、30 s,72 ℃、30 s,40个循环;72 ℃ 终延伸 10 min。PCR产物定量:产物用2%琼脂糖凝胶电泳,溴化已锭染色,凝胶成像系统扫描 DNA条带,并应用Quantity One4.6软件分析灰度值。目的基因相对表达量以目的基因/β-actin的灰度值表示。
1.4 统计学方法 采用SPSS17.0统计学软件行数据处理,数据均以表示,组间比较采用t检验,P≤0.05为差异有统计学意义。
2 结果
2.1 磷酸化JNK、ATF-2蛋白表达 磷酸化JNK蛋白阳性反应主要定位于肾小管上皮细胞胞质,磷酸化ATF-2阳性反应主要定位于肾小管上皮细胞胞核,均呈棕黄色颗粒。对照组磷酸化JNK、ATF-2蛋白未见表达或较低表达;IR组表达明显上调,与Sham 组比较,P 均 <0.05,见表1。
表1 两组再灌注不同时间点JNK、ATF-2蛋白表达(n=6,分,)
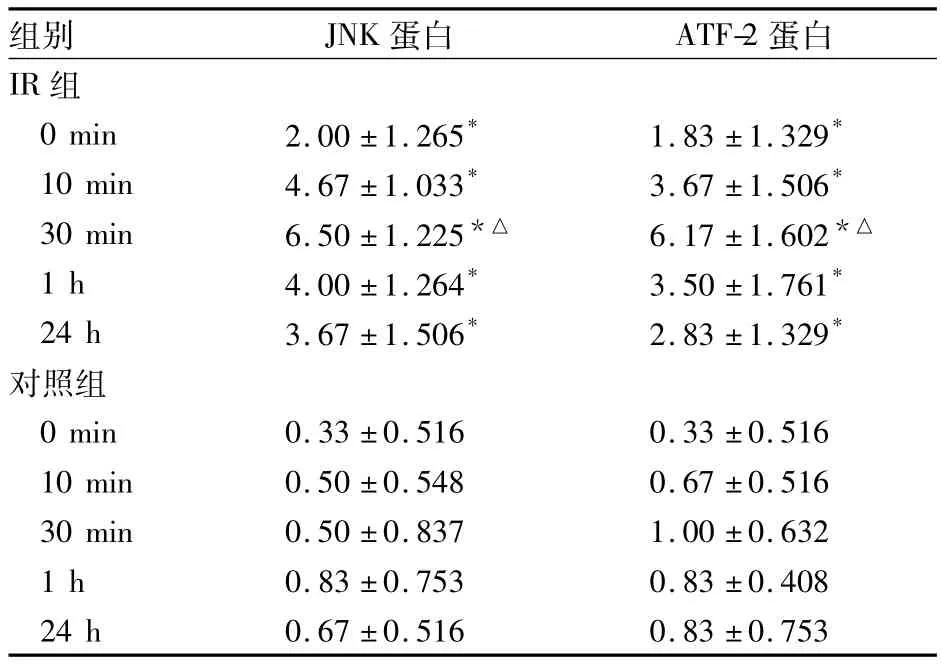
表1 两组再灌注不同时间点JNK、ATF-2蛋白表达(n=6,分,)
注:与对照组同时点比较,*P<0.05;与本组不同时间点比较,△P <0.05
组别 JNK蛋白 ATF-2蛋白IR 组0 min 2.00 ±1.265* 1.83 ±1.329*10 min 4.67 ±1.033* 3.67 ±1.506*30 min 6.50 ±1.225*△ 6.17 ±1.602*△1 h 4.00 ±1.264* 3.50 ±1.761*24 h 3.67 ±1.506* 2.83 ±1.329*对照组0 min 0.33 ±0.516 0.33 ±0.51610 min 0.50 ±0.548 0.67 ±0.51630 min 0.50 ±0.837 1.00 ±0.6321 h 0.83 ±0.753 0.83 ±0.40824 h 0.67 ±0.516 0.83 ±0.753
2.2 JNK、ATF-2 mRNA表达 RT-PCR结果显示,IR组JNK、ATF-2 mRNA表达在早期即有增加,再灌注30 min出现高峰,再灌注1 h表达略减弱,24 h仍有高表达;与假手术组比较,P均<0.05。见表2。
表2 两组再灌注不同时间点JNK、ATF-2 mRNA表达(n=6,灰度值,)
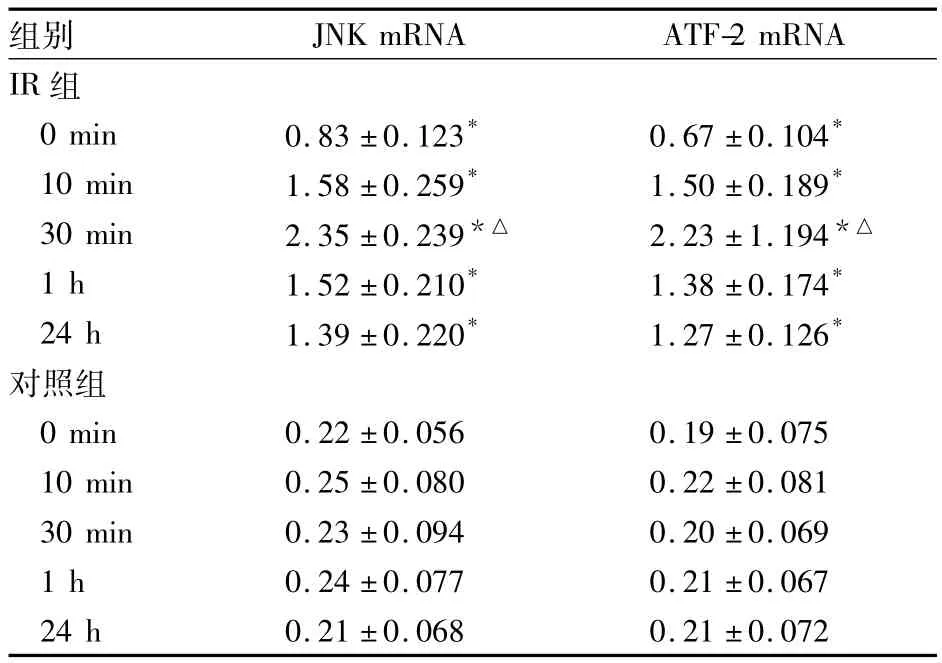
表2 两组再灌注不同时间点JNK、ATF-2 mRNA表达(n=6,灰度值,)
注:与对照组同时点比较,*P<0.05;与本组不同时间点比较,△P <0.05
组别JNK mRNA ATF-2 mRNA IR 组0 min 0.83 ±0.123* 0.67 ±0.104*10 min 1.58 ±0.259* 1.50 ±0.189*30 min 2.35 ±0.239*△ 2.23 ±1.194*△1 h 1.52 ±0.210* 1.38 ±0.174*24 h 1.39 ±0.220* 1.27 ±0.126*对照组0 min 0.22 ±0.056 0.19 ±0.07510 min 0.25 ±0.080 0.22 ±0.08130 min 0.23 ±0.094 0.20 ±0.0691 h 0.24 ±0.077 0.21 ±0.06724 h 0.21 ±0.068 0.21 ±0.072
3 讨论
肾脏是高灌注器官,对缺血及缺血再灌注均较敏感,肾IR是自体肾发生急性肾衰竭的主要原因。JNK信号通路是MAPKs信号转导系统的一条重要通路,IR时其转录在很短时间内(通常为数分钟)被激活,其活化后可调节基因转录,参与细胞生长、发育及凋亡等[5]。ATF-2 又名 m-XBP、CRE-BP1,其作为真核基因特定的转录因子,编码于染色体2q32,隶属于ATF/cAMP反应元件结合蛋白(CREB)转录因子家族,ATF/CREB转录因子家族包含一段高度保守的5'-TGACGTCA-3'碱基回文结构,称为cAMP效应元件(CRE)[6]。ATF-2是JNK的底物,上游激酶JNK将其磷酸化后成为活性形式而启动下游基因转录,ATF-2包含3个磷酸化位点,即 Thr69、Thr71和Ser90,但Ser90不直接参与转录。磷酸化的ATF-2通过与碱性亮氨酸拉链(b-ZIP)、CRE或激活蛋白-1(AP-1)家族如c-jun、c-fos元件组成异源二聚体的形式发挥转录因子的作用,启动转录过程,调控基因表达[7,8],其基因的活化产物参与了细胞凋亡,进而损伤肾脏组织的结构和功能。
本研究结果显示,在肾IR早期,肾组织JNK、ATF-2磷酸化蛋白及mRNA的表达水平均显著增加,于再灌注30 min出现高峰,再灌注1 h表达略减弱,24 h仍有高表达,提示磷酸化JNK通过激活下游信号分子ATF-2参与了肾IR的信号调控。因此可通过抑制肾缺血再灌注引起的JNK活化,影响细胞凋亡相关基因的转录及蛋白表达,进而减少肾小管上皮细胞凋亡,减轻肾脏损伤。
目前IR诱发细胞凋亡信号转导机制的研究已取得较大进展,但仍有许多细节尚不清晰。对介导细胞凋亡的信号通路深入研究并明确其机制,可使阻断细胞的死亡通路成为可能,通过干预改变缺血性损伤的程度,对急性肾损伤和移植肾功能丧失的防治将有重大的推动作用。
[1]Kelly KJ,and Molitoris BA,Acute renal failure in the new millennium:time to consider combination therapy[J].Semin Nephrol,2000,20(1):4-19.
[2]Wang Y,Ji H X,Xing SH,et al.SP600125,a selective JNK inhibitor,protects ischemic renal injury via suppressing the extrinsic pathways of apoptosis[J].Life Sci,2007,80(22):2067-2075.
[3]Xu YF,Liu M,Peng B,et al.Protective effects of SP600125 on renal ischemia-reperfusion injury in rats[J].J Surg Res,2011,169(1):e77-84.
[4]Soslow RA,Dannenberg AJ,Rush D,et al.COX-2 is expressed in human pulmonary,colonic,and mammary tumors[J].Cancer,2000,89(12):2637-2645.
[5]Ma,FY,Liu J,Nikolic-Paterson DJ.The role of stress-activated protein kinase signaling in renal pathophysiology[J].Braz J Med Biol Res,2009,42(1):29-37.
[6]Yamasaki T,Takahashi A,Pan J,et al.Phosphorylation of activation transcription factor-2 at serine 121 by protein kinase C controls c-Jun-mediated activation of transcription[J].J Biol Chem,2009,284(13):8567-8581.
[7]Pejchal J,Osterreicher J,Vilasova Z,et al.Expression of activated ATF-2,CREB and c-Myc in rat colon transversum after whole-body gamma-irradiation and its contribution to pathogenesis and biodosimetry[J].Int J Radiat Biol,2008,84(4):315-324.
[8]Teng CH,Huang WN,Meng TC.Several dual specificity phosphatases coordinate to control the magnitude and duration of JNK activation in signaling response to oxidative stress[J].J Biol Chem,2007,282(39):28395-28407.

