杏采后病害病原拮抗菌的分离筛选及鉴定
郑 琪, 徐秉良, 薛应钰, 梁巧兰, 张 瑾
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,兰州 730070)
杏(Armeniaca vulgaris Lam.)属肉质多汁果实,成熟期集中,采摘后不耐贮藏,极易受到病原菌侵染而发生采后病害,造成的腐烂率高达50%[1]。由细交链孢(Alternaria tenuis Nees)引起的黑斑病和灰葡萄孢(Botrytis cinerea Pers.ex Fr.)引起的灰霉病是杏采后贮藏期间的主要病害[2-3]。国内外防治果实采后病害的方法主要有:低温贮藏、气调贮藏、热处理以及化学药剂处理等,但物理方法成本高,仪器设备复杂,化学防治使病原菌抗药性增加,果品农药残留危害人体健康。自Pusey[4]首次使用B.subtilis防治桃褐腐病以来,生物防治以其安全、无残毒、无污染、不易产生抗药性的特点逐渐成为一种控制果蔬采后病害的新途径被人们所重视。国内外已有报道从苹果、草莓、柑橘、油桃等水果上筛选到几十种拮抗菌防治采后病害[5],但利用拮抗菌防治杏采后病害的报道却很少。因此,本试验从生物防治角度出发,旨在从杏果实表面、叶片及根际土壤中分离筛选出对细交链孢和灰葡萄孢具有明显拮抗作用的菌株,为杏采后病害的生物防治打下基础,以延长果实的贮藏期。
1 材料与方法
1.1 材料
选择刚采摘的大小一致的成熟健康杏果实,放置于贮藏室(25℃)内。PDA培养基、NA培养基和LB培养基参照方中达[6]的方法制备。
1.2 方法
1.2.1 杏采后病害病原菌的分离及致病性测定
采用常规的组织分离法[6],分别对贮藏后7、9、11、13d的发病杏果实进行病原菌的分离,并计算分离频率。初次分离后的菌种采用单孢分离法进行纯化,并将纯化后的菌株保存在PDA斜面上备用。采用刺伤接种和无伤接种的方法[7],对病原菌进行致病性测定。
1.2.2 拮抗菌的分离
1.2.2.1 土壤稀释分离法
参照徐雪莲[8]的方法,土壤采自甘肃农业大学杏园,除去果树根际表层5cm左右的浮土,取5~10cm处的土壤,带回实验室风干、过筛、混匀,每份土样称取10g,置于90mL无菌水中,加入小玻璃珠,在150r/min的摇床上振荡30min,制成土壤悬浮液,用梯度稀释法稀释到1×10-4、1×10-5、1×10-6、1×10-7后涂布于 NA平板上,30℃培养箱内培养2~3d,记录菌株生长情况,然后挑取菌落形态差异明显的单个菌落纯化培养。
1.2.2.2 果实及植物表面拮抗菌的分离
参照Janisiewicz[9]的方法,将杏树叶片及果实表皮分别置于0.05mol/L磷酸缓冲液中,100r/min摇床振荡10min,将洗液梯度稀释为1×10-1、1×10-2、1×10-3后,在 NA培养基上30℃培养2~3 d,记录菌株生长情况,挑取菌落形态差异明显的单个菌落纯化培养。
1.2.2.3 杏果实伤口处拮抗菌的分离
按照Wilson等[10]的方法分离,选取10个杏果实,在每个果实的阴阳面各刺一个3mm×5mm的伤口,再用150mL无菌水分别冲洗10个无伤口的杏健康果实2次,取50μL洗液接种在伤口内,2h后接种20μL 1.0×104个/mL的病原菌孢子悬浮液,25℃、相对湿度RH<95%条件下贮藏5d后,切取未侵染的伤口组织,在10mL无菌水中研磨均匀,取研磨液用稀释平板法分离获得单个菌落,纯化培养。
1.2.3 杏采后病害病原拮抗菌的筛选
1.2.3.1 离体筛选
采用PDA 平板对峙法[11],在平板(90mm)中央分别点接A.tenuis和B.cinerea(d=5mm)为指示菌,将已分离纯化的菌株分别点接在距离指示菌3cm处的4个角点上,以不接拮抗菌株的为对照,28℃恒温箱培养5~7d,观察记录,选取对病原菌有较强抑制作用的菌株进行复筛,比较抑制效果R值的大小,筛选出抑菌效果好的菌株。每处理4次重复。计算公式如下:

1.2.3.2 活体筛选
参照班兆军[5]的方法,选择刚采摘的大小一致的成熟健康杏果实,用2%的NaClO溶液消毒2min,然后用无菌水冲洗掉残余的NaClO后自然晾干。在果实腰部刺一个直径3mm,深3mm的孔,先接种1×108cfu/mL拮抗菌菌悬液30μL,2h后再接种1×104个/mL病原菌孢子悬浮液30μL,对照组加入无菌水和对应的病原菌孢子悬浮液;待果实风干后置于果品周转箱中,用保鲜膜进行密封,以保持95%左右的相对湿度,20℃贮藏5d后统计果实的发病率与病斑直径。每处理10个果实,重复3次。
1.2.4 杏采后病害病原拮抗菌的鉴定
1.2.4.1 拮抗菌的培养特征及形态特征
参照沈萍等[12]的方法,观察拮抗菌在NA培养基上的生长特征及显微形态特征。
1.2.4.2 拮抗菌的生理生化特征
按照《伯杰细菌鉴定手册》[13]和《常见细菌系统鉴定手册》[14]对拮抗作用较好的拮抗菌进行相关生理生化指标的测定。
1.2.4.3 16SrDNA序列测定及分析
以细菌基因组柱式提取试剂盒提取的基因组DNA为模板,以Primer1-F5′-ATCCTTGTTACGACTTGA-3′和Primer1-R:5′-AGTTTGATCCTGGCTCA-3′为引物,进行扩增。PCR反应体系为50μL:模板DNA1μL,Primer1-F和Primer1-R各1μL,灭菌的双蒸水22μL,Premix Taq 25μL。反应条件为:95℃初始变性5min;94℃变性30s,50℃退火30s,72℃延伸1min,30个循环;72℃复性15min。经1%琼脂糖凝胶电泳检测,将检测结果送交上海生工生物工程有限公司进行测序,将测序结果在Gen-Bank上进行同源性比对,参比序列,并利用软件DNAStar进行聚类分析,构建同源性树。
2 结果与分析
2.1 杏采后病害病原菌及拮抗菌的分离
2.1.1 杏采后病害病原菌的分离
通过对不同贮藏时期的发病杏果进行分离发现,细交链孢和灰葡萄孢的分离频率最高,分别为39.7%和31.9%,在贮藏7~13d的病果上均可分离到,黑根霉在贮藏13d的果实上分离频率也较高,平均分离频率为18.2%,指状青霉、粉红聚端孢霉和黑曲霉的平均分离频率分别为6.0%、3.4%和0.9%(表1)。

表1 不同贮藏时期发病杏果病原菌的分离频率Table 1 The isolation frequencies of pathogens on the apricot fruits during different storage periods
经柯赫氏法则验证,确定A.tenuis和B.cinerea为杏采后贮藏期间的主要致病菌。
2.1.2 杏采后病害病原拮抗菌的分离
通过土壤分离法、表面分离法和组织分离法,共从采集的土样、果实及叶片上分离到107个菌株。将107个菌株分别对A.tenuis和B.cinerea进行抑菌试验,筛选抑菌带大于5mm,抑菌效果明显的菌株。结果表明,在所分离到的全部菌株中,对A.tenuis表现明显抑制作用的菌株共44株,占总分离数的41.1%,对B.cinerea具有明显抑制作用的菌株共有27株,占分离总数的25.2%;而同时对这两种病原菌具有抑制效果的菌株仅有14株,占分离总数的13.5%(表2)。
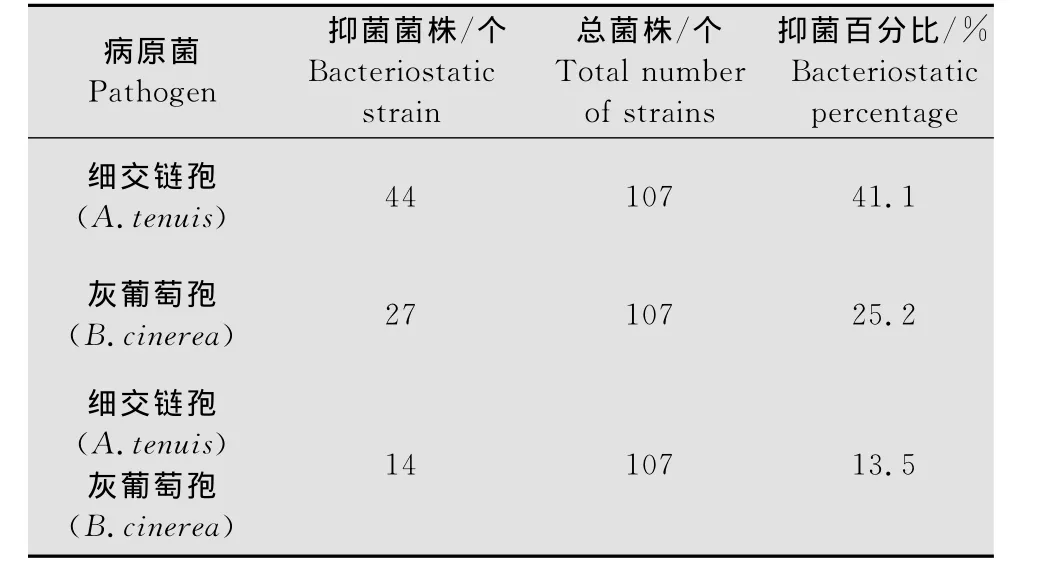
表2 拮抗菌株的分离结果Table 2 The isolation results of antagonistic bacteria
2.2 杏采后病害病原拮抗菌的筛选
2.2.1 离体筛选
将这14株拮抗菌分别编号为JK-1~JK-14,进行离体筛选,比较R的大小,结果表明,14株菌对两种采后病原菌均有不同程度的抑制作用,尤其以JK-14和JK-11的拮抗作用最显著,对A.tenuis的抑制效果R分别为0.74、0.68,拮抗效果最差的是JK-1,R 为0.56,对B.cinerea的抑制效果分别达到0.74、0.73,JK-7的拮抗效果最差,R为0.38。方差分析结果表明,JK-14和JK-11间无显著差异,而与JK-1、JK-7形成显著差异,其余菌株的拮抗效果介于之间(表3)。
2.2.2 活体筛选
将离体筛选效果较好的2株拮抗菌分别对杏果进行活体防效试验,结果表明,2株拮抗菌对A.tenuis和B.cinerea均表现出了较高的防效,且JK-14的防效优于JK-11。经JK-14和JK-11处理5d后的杏果,其A.tenuis的发病率分别为16.3%和19.3%,病斑直径分别为4.4、4.7mm,而对照的发病率为95.6%,病斑直径为12.5mm,两者存在显著差异。JK-14和JK-11处理杏果5d后B.cinerea的发病率分别为14.1%和17.0%,病斑直径分别为3.2、3.4mm,而对照杏果 B.cinerea 的发病率为96.3%,病斑直径为14.9mm,显著高于处理果实(表4),而且对照果实已出现软化、局部腐烂等症状,在伤口处有明显病斑形成(图2)
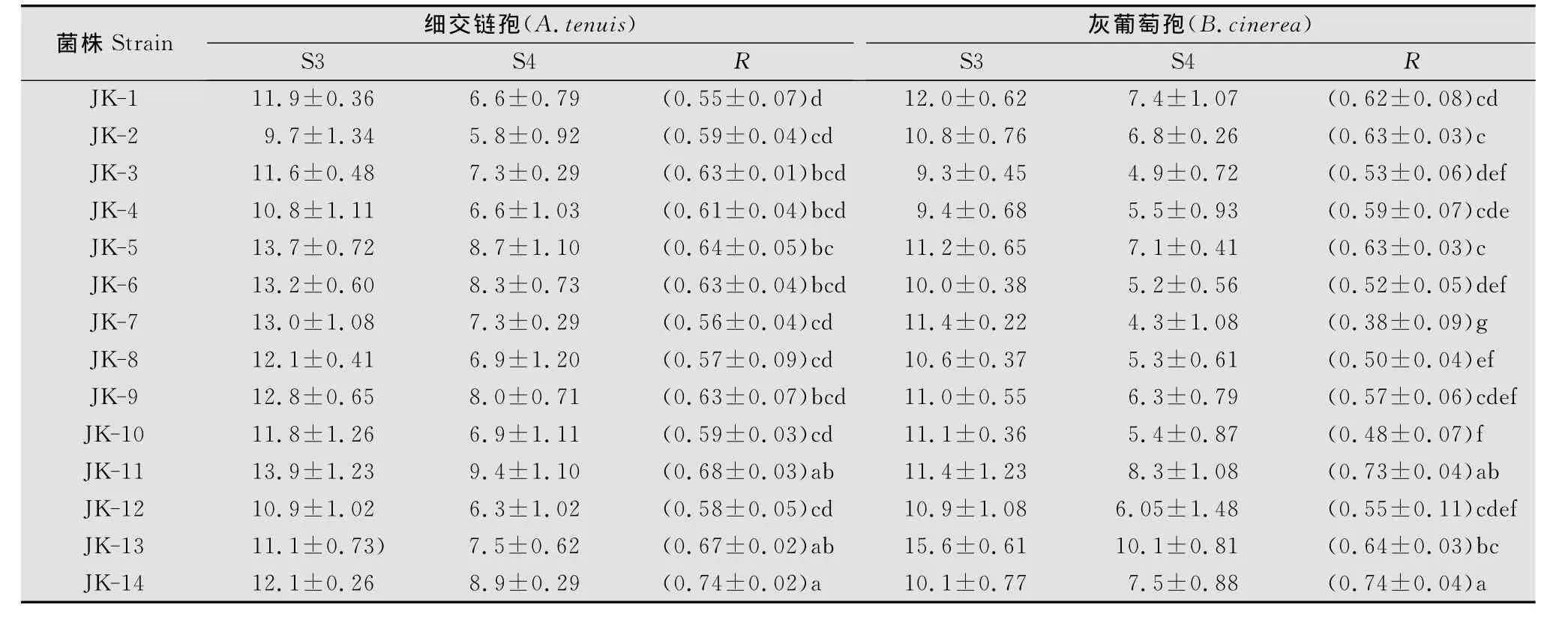
表3 14株拮抗菌株对2种病原菌的拮抗性能Table 3 Antagonistic activity of 14bacteria to 2pathogens mm
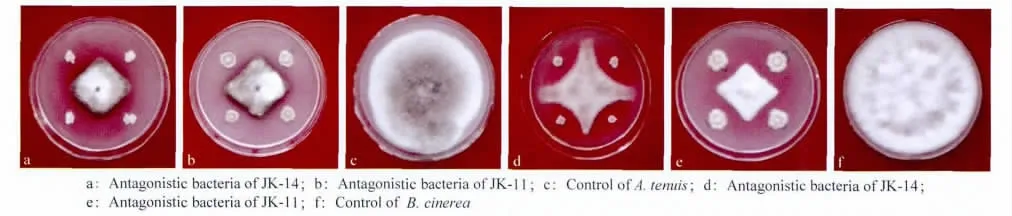
图1 2株拮抗菌对链格孢菌和灰葡萄孢菌的拮抗作用(7d)Fig.1 Antibacterial effects of 2antagonistic bacterial strains on A.tenuis and B.cinerea(7d)

表4 2株拮抗菌株的活体抑制效果Table 4 In vivo inhibitory effects of 2antagonistic bacterial strains
2.3 拮抗菌的鉴定
2.3.1 拮抗菌的形态特征及理化测定
JK-14和JK-11在NA培养基上生长良好,28℃下培养2~3d即可出现明显菌落,其中JK-14的菌落呈椭圆形或不规则形,乳白偏黄色,菌落不透明,表面粗糙有褶皱,革兰氏染色为阳性,菌体呈杆状,大小约为0.8μm×2.5μm。JK-11菌落呈现圆形,白色略透明,表面光滑,菌体杆状,大小为0.9μm×3.2μm,革兰氏染色阳性(图3)。2株拮抗菌的相关生理生化指标测定结果见表5。
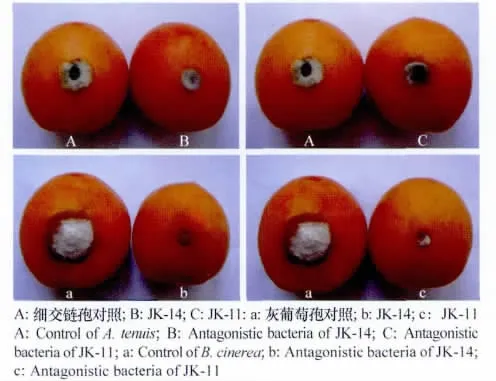
图2 两株拮抗菌对杏果实上细交链孢(A.tenuis)灰葡萄孢(B.cinerea)的抑制作用Fig.2 Inhibitory effects of 2antagonistic bacterial strains on A.tenuis and B.cinereain apricot
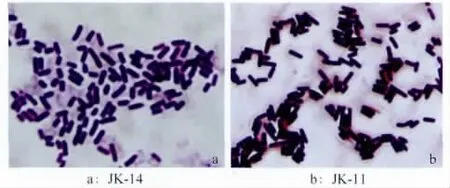
图3 两株拮抗菌的菌体形态(光学显微镜100倍)Fig.3 Morphological characteristics of the thalli of the strain JK-14and JK-11
2.3.2 拮抗菌的分子生物学鉴定
通过对2株拮抗菌进行DNA提取及PCR扩增,对PCR产物纯化后测序,得到JK-14的16SrDNA 的序列长度为1442bp,JK-11的16SrDNA 的序列长度为1437bp,2株拮抗菌的PCR产物电泳检测结果见图4。

表5 拮抗菌株JK-14和JK-11的生理生化鉴定结果Table 5 Physiological and biochemical properties of the strain JK-14and JK-11
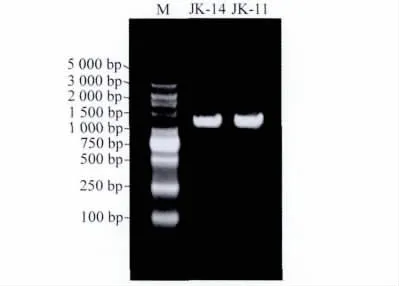
图4 JK-14、JK-11的PCR扩增产物电泳图Fig.4 Electrophoretogram of PCR amplification product of JK-14and JK-11
将条带回收测序后在GenBank上进行比对,选取同源性不低于99%的序列,利用DNAStar软件绘制其聚类图谱(图5),结果表明:JK-14与多株Bacillus的16SrDNA序列具有很高的同源性,与B.subtilis(HQ317149)、B.subtilis(JQ308571)、B.amyloliquefaciens(HQ179100)的 亲 缘 关 系 最近,位于聚类图的同一分支,聚为一类;而与JK-11同源性较高的菌株均属Paenibacillus,与亲缘关系较 近 的 菌 株P.polymyxa(AY302439)、P.polymyxa(FJ940900)和P.polymyxa(EF620470)为同一分支,聚为一类,结合生理生化测定的结果,确定JK-14为芽胞杆菌(Bacillus sp. JK-11为类芽胞杆菌(Paenibacillus sp.
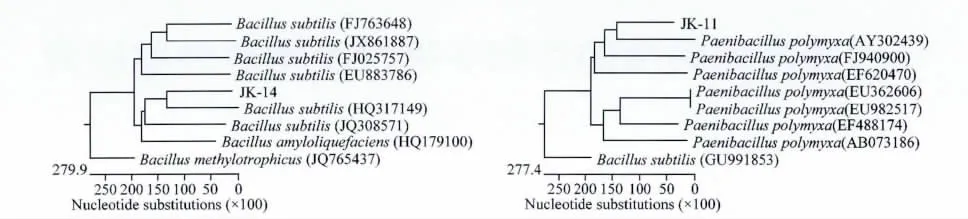
图5 菌株JK-14、JK-11的遗传聚类分析图谱Fig.5 Phylogenetic tree of the isolates JK-14and JK-11
3 结论与讨论
杏采后病害是制约其生产和销售的重要因素,曹建康[2]对引起杏采后黑斑病病原菌链格孢进行了侵染时期、机制、防治时期的研究。张瑾[1]对杏采后病害病原菌进行了分离,其中链格孢和灰葡萄孢对杏果均有一定的致病性。朱子华[3]报道了引起核果类桃、杏、李、樱桃采后病害的病原菌,主要有果生链核盘菌(Monilinia fructicola),灰葡萄孢(B.cinerea),链格孢(A.tenuis)和黑根霉(R.stolonifer)等。本试验通过对杏贮藏7~13d的病原菌进行分离,结果表明,A.tenuis和B.cinerea为杏采后贮藏期间的主要病原菌,并针对这两种主要病原菌在杏果园土壤、果实表面及叶片中进行了拮抗菌的大量分离,共得到14株对A.tenuis和B.cinerea都具有抑制作用的菌株,占分离总数的13.5%。通过离体和活体筛选,得到两株拮抗作用较好的菌株JK-14和JK-11,对A.tenuis的抑菌比值 R 分别为0.74和0.68,对B.cinerea的抑菌比值为0.74和0.73。处理杏果A.tenuis的发病率为16.3%和19.3%,病斑直径为4.4和4.7mm,接种B.cinerea的发病率为14.1% 和17.0%,病斑直径分别为3.2和3.4mm,均明显低于对照果实的发病率和病斑直径。虽然围绕杏果不同生境进行了拮抗菌的大量分离筛选,得到了对其采后病害具有不同程度抑制作用的菌株,然而,对两种病原菌同时具有明显抑制效果的菌种却相对较少,因此,今后还可以从更广泛的不同生境中进行分离筛选,以扩大拮抗菌的筛选源。
JK-14和JK-11对杏果实采后病原菌A.tenuis和B.cinerea具有显著的抑制效果,是较好的生防菌株。通过形态学,生理生化及分子生物学方法对这两株拮抗菌进行了鉴定,结果为JK-14属芽胞杆菌(Bacillus sp.),JK-11为类芽胞杆菌(Paenibacillus sp.)。由于Bacillus和Paenibacillus部分种之间的同源性很高,难以通过16SrDNA序列分析和生化特征予以区分。因此,还应结合gyrA、gyrB基因进行系统发育分析,对两株拮抗菌进行进一步鉴定。
关于拮抗菌防治果蔬病害已有大量报道,杨振[15]将分离出的枯草芽胞杆菌BS-331防治油桃果实采后绿霉病和软腐病,效果较好;陈浩等[16]发现枯草芽胞杆菌B-FS01对葡萄霜霉病的防效显著;多黏类芽胞杆菌作为一种潜在的,有价值的生防菌株也逐渐受到人们关注,陈文俊[17]等报道从西瓜根际分离出的多黏类芽胞杆菌,对番茄早疫病菌、草莓炭疽病等病原菌均具有明显的抑菌作用。但利用拮抗菌防治杏采后病害却很少有报道。本试验筛选出的这两株拮抗菌对杏采后主要病害防治效果显著,具有很好的应用和发展前景。因而,有必要对其防腐抑菌机理进行进一步的研究。
[1] 张瑾,徐秉良,梁巧兰,等.杏采后病害病原菌鉴定及室内药剂筛选[J].植物保护,2011,37(5):118-123.
[2] 曹建康.杏采后黑斑病潜状侵染时期、机制及控制[D].兰州:甘肃农业大学,2002.
[3] 朱子华,盛恒彬,梅象信,等.果实采后病害种类[J].河南林业科技,2004,24(4):17-18.
[4] 游春平,肖爱平,郑小波,等.产后果实病害生物防治的研究进展[J].植物保护学报,2005,32(2):214-215.
[5] 班兆军,李莉,李喜宏,等.隐球酵母对长枣果实的生防效果及诱导抗性[J].植物保护,2009,35(3):77-80.
[6] 方中达.植病研究方法[M].第3版.北京:中国农业出版社,1998.
[7] 赵淑艳,李喜宏,陈丽,等.桃采后病原菌种类及侵染规律研究[J].食品科学,2005,26(10):253-255.
[8] 徐雪莲.果蔬采后病害拮抗细菌的筛选及研究[D].武汉:华中农业大学,2004.
[9] Janisiewicz W J.Biocontrol of postharvest diseases of apples with antagonist mixtures[J].Phytopathology,1988,78:194-198.
[10]Wilson C L,Wisniewski M E,Droby S,et al.A screen strategy for microbial antagonist to control postharvest disease of fruits and vegetables[J].Scientia Horticulturae,1993,53:183-189.
[11]胡青平.番茄早疫病菌(Alternaria solani)广谱拮抗微生物的选育及拮抗机理研究[D].西安:西北大学,2008.
[12]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999.
[13]布坎南R E,吉本斯N E.伯杰细菌鉴定手册:中文版(8版)[M].中国科学院微生物所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[15]杨振,郭红莲,张晓波,等.枯草芽孢杆菌BS-331防治油桃采后病害的研究[J].中国果树,2008,11(6):35-38.
[16]陈浩,胡梁斌,唐春平,等.枯草芽胞杆菌B-FS01对葡萄霜霉病的防治效果[J].植物保护,2011,37(6):194-197.
[17]陈文俊,曾蓉,陆金萍,等.西瓜根际细菌JK-3的鉴定及其拮抗性的初步研究[J].上海农业学报,2011,27(1):68-72.

