缺氧对食管鳞状细胞癌中缺氧诱导因子-1α和己糖激酶-Ⅱ表达的影响
朱智勇 马颖才 唐 莉 荣光宏 (青海省人民医院消化科,青海 西宁 810007)
研究表明,缺氧诱导因子-1α(HIF-1α)以及己糖激酶-Ⅱ(HK-Ⅱ)在体内的高表达能够有效抑制肿瘤细胞的糖酵解,起到良好的抗癌作用〔1〕。本研究分析不同氧浓度对HIF-1α及HK-Ⅱ表达的影响,并观察HK-Ⅱ的表达与乳酸分泌之间的联系,探讨HIF-1α及HK-Ⅱ在肿瘤缺氧耐受机制中的作用。
1 材料与方法
1.1 实验材料 人食管鳞状细胞癌细胞株TEl3和Ecal09,其中TEl3/shRNA细胞为 TEl3的HIF-1α稳定干扰株,Ecal09/shRNA细胞为Ecal09的HIF-1α稳定干扰株。逆转录酶试剂盒、细胞培养箱和缺氧培养箱、定量PCR仪、紫外分光光度仪以及乳酸浓度测定试剂盒、TRIzol、SYBR Green I RT-PCR Master Mix等。
1.2 方法
1.2.1 培养及分组 常规细胞培养。首先将细胞放置于胎牛血清的DMEM培养液内,待细胞生长至60%融合时取出,饥饿24 h。之后更换培养液,可以为无血清培养液。对细胞进行分组,观察组采用1%氧浓度,对照组采用20%氧浓度。观察两组细胞培养24、48 h后的HIF-1α及HK-Ⅱ表达情况。
1.2.2 实时定量PCR 利用TRIzo1提取总RNA,然后使用RT-PCR试剂盒进行逆转录,之后使用SYBR Green荧光染料进行实时定量 PCR扩增,反应条件为50℃ 5 min,95℃ 3 min,95℃ 20 s,60℃ 1 min,55个循环,每个循环结束后测定吸光度(A)值。随着PCR系统在每一个循环结束后测定A值,得到以循环数为横坐标、A值为纵坐标的定量曲线。
1.2.3 分光光度法测定乳酸浓度 取细胞培养上清液以分光光度法测定乳酸浓度。空白管加蒸馏水0.02 ml,标准管加3 mmol/L标准液0.02 ml,测定管加样本0.02 ml,各管中均加入酶工作液1 ml及显色剂0.2 ml,混匀后37℃水浴反应10 min,各管加终止液2 ml。混匀,530 nm,1 cm 光径,蒸馏水调零,分光光度仪测各管A值,根据空白管、标准管及测定管的A值计算得出细胞培养上清液的乳酸浓度(mmol/L)。
1.3 统计学方法 应用SPSS14.0统计软件进行分析,计量资料以±s表示,均数比较采用t检验。
2 结果
2.1 HIF-1α和 HK-ⅡRNA在 TEl3/shRNA及 Ecal09/shRNA中的表达 常氧(20%氧浓度)条件下被干扰的TEl3/shRNA和Ecal09/shRNA细胞中 HIF-1α RNA表达量较未干扰的TEl3、Ecal09细胞明显减弱(P<0.01)。而各细胞株 HIF-1α RNA表达量在常氧和缺氧(1%氧浓度)条件下差异无统计学意义(P>0.05)。HK-ⅡRNA表达结果与HIF-1α RNA一致。见表1。
2.2 各组细胞乳酸分泌量比较 未干扰的TEl3、Ecal09细胞缺氧后乳酸分泌量较常氧培养时明显增多,被干扰的TEl3/shRNA、Ecal09/shRNA细胞乳酸分泌量较TEl3、Ecal09细胞显著减少(P<0.01)。见表2。
表1 各组细胞HIF-1α和HK-ⅡRNA表达(±s)
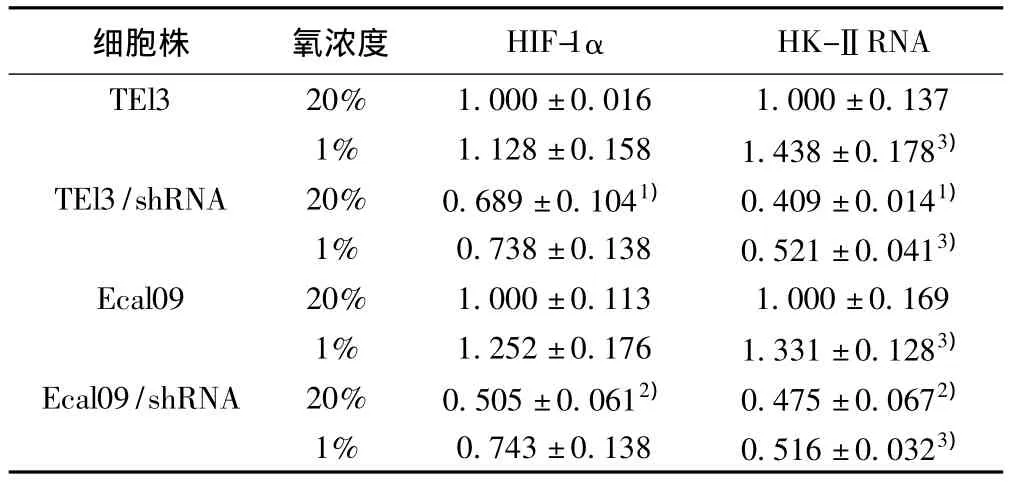
表1 各组细胞HIF-1α和HK-ⅡRNA表达(±s)
与20%氧浓度TEl3比较:1)P<0.01;与20%氧浓度Ecal09比较:2)P<0.01;与各组细胞20%氧浓度比较:3)P<0.01;下表同
细胞株 氧浓度 HIF-1α HK-ⅡRNA TEl3 20% 1.000±0.016 1.000±0.137 1% 1.128±0.158 1.438±0.1783)TEl3/shRNA 20% 0.689±0.1041) 0.409±0.0141)1% 0.738±0.138 0.521±0.0413)Ecal09 20% 1.000±0.113 1.000±0.169 1% 1.252±0.176 1.331±0.1283)Ecal09/shRNA 20% 0.505±0.0612) 0.475±0.0672)1% 0.743±0.138 0.516±0.0323)
表2 各组细胞乳酸含量比较(±s ,mmol/L)

表2 各组细胞乳酸含量比较(±s ,mmol/L)
氧浓度TEl3 Ecal09 TEl3/shRNA Ecal09/shRNA 20% 6.891±1.592 6.070±1.839 2.704±0.9432)2.375±0.8403)1% 15.062±3.9011)14.707±3.5941)4.982±1.953 2.214±0.982
3 讨论
目前研究认为〔2〕,人体内提供细胞能量的主要来源是葡萄糖的代谢。糖代谢能够通过线粒体氧化磷酸化及糖酵解两种方式提供细胞ATP,维持细胞正常运转〔3〕。糖酵解是肿瘤细胞主要产生能量的方式。有研究报道〔4~6〕,无论是在正常氧浓度下还是在低氧浓度下,糖酵解均能为肿瘤细胞提供主要的能量。特别是在某些低氧情况下,糖酵解过程加强,某些肿瘤细胞能够很快适应低氧情况,增强糖酵解的能力,以维持自身的能量供应〔7〕。目前对糖酵解和肿瘤的联系有以下观点〔8~10〕:(1)糖酵解过程中产生的能量能为肿瘤细胞提供相应ATP;(2)糖酵解产生大量乳酸导致微环境酸化,酸化的细胞外液分解破坏细胞外基质,有利于肿瘤细胞的浸润,且一些内源性免疫细胞、免疫分子在明显酸化的条件下均会失效;(3)糖酵解生成的中间代谢产物用于合成蛋白质和脂肪,以满足肿瘤细胞活跃的合成代谢需求。因此,糖酵解酶具有拮抗细胞凋亡的功效,导致恶性肿瘤对放射、化学治疗等促凋亡作用的耐受。
HIF-1α通过对缺氧诱导基因表达的调控,维护人体对低氧浓度的反应及适应能力。有研究报道表明〔11,12〕,改变缺氧时间和氧气的浓度能够显著影响小鼠肺平滑肌细胞HIF-1α的表达。本研究发现,人食管鳞癌中HIF-1α蛋白的表达受环境氧浓度的高度调控,提示HIF-1α在食管癌细胞缺氧耐受机制中可能发挥重要作用。研究报道称〔13〕,肿瘤患者体内HK-Ⅱ的表达较正常人呈明显上升趋势,而且HK-Ⅱ往往是以与线粒体结合的形式存在,因此能够加速肿瘤细胞内糖代谢速率,为其提供足够的能源。本研究结果说明低氧时HK-Ⅱ启动子存在激活反应,这与国外学者在肌肉细胞及肝癌细胞系AS-30D中的研究基本一致。乳酸是糖酵解过程中的最终产物,由于肿瘤细胞的糖酵解得到加强,因此在肿瘤细胞中可见大量乳酸。根据本研究结果认为HIF-1α参与调节肿瘤细胞的糖酵解过程,而HK-Ⅱ可能为HIF-1α的靶基因。
综上所述,低氧情况下,人食管鳞癌中HIF-1α及HK-Ⅱ的含量均显著上升,而HIF-1α表达下降可以下调HK-Ⅱ的表达,使肿瘤细胞糖酵解水平下降。肿瘤细胞具有更高的糖酵解水平与其在缺氧微环境下HIF-1α上调糖酵解途径中关键酶的基因表达有关,是肿瘤细胞耐受缺氧的机制之一。
1 Bartrons R,Caro J.Hypoxia,glucose metabolism and the Warburg-S effect〔J〕.J Bioenerg Biomembr,2007;39(3):223-9.
2 Assaily W,Benchimol S.Differential utilization of two ATP-generating pathways is regulated by p53〔J〕.Cancer Cell,2006;10(1):4-6.
3 Bensaad K,Tsuruta A,Selak MA,et al.TIGAR,a p53-inducible regulator of glycolysis and apotosis〔J〕.Cell,2006;126(1):107-20.
4 Biaglow JE,Cerniglia G,Tuttle S,et al.Effect of oncogene transformation of rat embryo cells on cellular oxygen consumption and glycolysis〔J〕.Biochem Biophys Res Commun,2007;235(3):739-42.
5 Taylor RW,Turnbull DM.Mitochondrial DNA mutations in human disease〔J〕.Nat Rev Genet,2005;12(5):389-402.
6 Pelicano H,Martin DS,Xu RH,et al.Glycolysis inhibition for anticancer treatment〔J〕.Oncogene,2006;25(34):4633-46.
7 Ashrafian H.Cancer's sweet tooth:the Janus effect of glucose metabolism in tumorigenesis〔J〕.Lancet,2006;367(9510):618-21.
8 Gillies RJ,Robey I,Gatenby RA.Causes and consequences of increased glucose metabolism of cancers〔J〕.J Nucl Med,2008;49(2):24-42.
9 Semenza GL.HIF-1 and tumor progression:pathophysiology and therapeutics〔J〕.Trends Mol Med,2002;8(4):62-7.
10 Semenza GL.O2-regulated gene expression:transcriptional control of cardiorespiratory physiology by HIF-1〔J〕.J Appl Physiol,2004;96(3):1173-7.
11 Gosmain Y,Lefai E,Ryser S,et al.Sterol regulatory element-binding protein-1 mediates the effect of insulin on hexokinase II gene expression in human muscle cells〔J〕.Diabetes,2004;53(2):321-9.
12 野战鹰,付玲娣,邢邯英,等.下肢缺血预处理对大鼠心肌HIF-1α表达的影响〔J〕.中国老年学杂志,2011;31(7):1170-2.
13 Semenza GL,Jiang BH,Leung SW,et al.Hypoxia response elements in the aldolase A,enolase 1,and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxia-inducible factor-1〔J〕.J Biol Chem,1995;271(51):32529-37.

