人参中皂苷类化学成分的研究△
杨鑫宝,杨秀伟,刘建勋
(1.中国中医科学院 西苑医院 实验研究中心,北京100091;2.北京中医药大学,北京 100029;3.北京大学 天然药物及仿生药物国家重点实验室,北京大学 药学院 天然药物学系,北京 100191)
专 稿
人参中皂苷类化学成分的研究△
杨鑫宝1,2,3,杨秀伟3*,刘建勋1,2*
(1.中国中医科学院 西苑医院 实验研究中心,北京100091;2.北京中医药大学,北京 100029;3.北京大学 天然药物及仿生药物国家重点实验室,北京大学 药学院 天然药物学系,北京 100191)
人参是常用传统中药之一,主要分为水参、生晒参和红参。本文概述它们所含人参皂苷成分的研究,分析其人参皂苷结构类型特点,为确定它们的药效物质基础提供科学依据。水参和生晒参的人参皂苷苷元具有结构类型单一的特点,包括原人参二醇、原人参三醇和齐墩果酸3种类型,而红参中的人参皂苷苷元具有结构类型多样性的特点,它们与其生物活性具有密切相关性。
人参;红参;人参皂苷;药效物质基础
历版《中国药典》记载人参系五加科(Araliaceae)人参属(Panax)植物人参(PanaxginsengC.A.Mey.)的干燥根和根茎(Ginseng Radix et Rhizoma),为法定药用部位,传统上亦是人种药理学(Ethnopharmacology)实践的成果。集这些成果,人参发展为药食两用。人参始载于《神农本草经》,列为上品,谓之“味甘微寒,主补五脏,安精神,定魂魄,止惊悸,除邪气,明目,开心益智,久服,轻身延年”,概括性较广。伴随“循证医学”和/或“循证药学”的发展,人参活性物质基础的确定是基础科学问题,需要系统梳理或研究。有关人参的生物学活性、药理作用、临床应用等的现代研究,已有总结,如增强机体机能[1]、提高生活质量[2]和认知能力[3]及对阿尔茨海默氏病的作用[4]、对心血管系统的影响[5]、对高血压的作用[6]、对勃起功能障碍的作用[7]、治疗2型糖尿病[8]等,以及与多种疾病皆有相关性的抗氧化作用[9]。从已发表的大量论文资料来看,多涉及到人参皂苷类化合物。
尽管文献中有人参地上部分皂苷类化学成分的总结[10],本文概述传统主流用药部位人参根和根茎(以下简称人参)中皂苷类成分的研究,以期为确定人参的药效物质基础提供参考。
1 商品人参的分类
商品人参分类各式各样。按产地不同分类,有吉林人参、辽宁人参、石柱人参、高丽人参等;按产地初加工分类,有水参(新鲜人参)、生晒参、白干参、全须生晒参等;按炮制方法分类,有红参、白糖参、生晒参等;按栽培方式和生长环境分类,可分为野山参、移山参、林下参和园参。我国的野山参主要生长在吉林省境内的长白山和黑龙江省境内的大、小兴安岭地区,以长白山林区最多且高度集中于抚松县和集安市。吉林省长白山的野山参以其补力宏厚、参味浓郁、质量纯正而著名,在国际上享有极高的声誉。把幼小的野山参移植于田间再行人工培育成长或将人工种植的幼小园参移植到山野让其自然长成,这种人参统称为移山参。由人工种植培育而长成的人参统称园参,亦称秧身。人工种植的人参需要6~8年才能采挖,每年9~10月间采挖生长6年以上的家种人参的根和根茎,防止折断须根及支根,洗净泥土除去茎叶,所得人参称“园参水子”。仅靠采集自然生长、数量极少的野山参远远满足不了社会对人参需求量的增加,特别是人参列为药食两用,需求量更大。因此,必须进行园参种植。虽然我国人工种植人参的历史悠久,但作为商品大面积栽培只是近百年的事,目前园参已成为商品人参的主要来源。有学者认为野山参与园参都是名贵中药材,药效成分只有量的多寡之分而没有质的差别;因园参产量较大,价格也相对便宜,适宜家庭进补选用。近年来,林下人工播种山参式种子,让其自然生长10~20年以上,称其为林下参,亦称为籽海山参,年限越长,其价值也随之增高。因某些地区所生长的药材质量优、药效好,远非其他地区的同种药材所能比拟和替代,历代医家都非常推崇使用“地道药材”,此是古代医家无数次临床实践的经验总结。现代研究表明,除了产地特定的环境、气候等诸多因素外,土质中微量元素含量的多少亦直接影响药材原植物的生命活动及其药材的质量。因为微量元素在地球表面的分布和含量是不均匀,所以产地不同,药材中含有的微量元素亦相差悬殊。许多“地道药材”的质量与其“细胞质”遗传特性具有密切的关系,主产于我国东北地区的人参名闻遐迩独具特色。我国已在吉林省的靖宇、长白、集安、抚松等县建立了人参规范化种植基地(GAP),在一定程度上保证了人参药效物质基础的稳定性。
2 人参皂苷研究的沿革
人参物质基础虽然具有多样性,但人参皂苷类成分是其特征性成分,人参的许多传统上总结的功效都与人参皂苷密切相关。早在十九世纪末,德国、原苏联、日本、朝鲜和中国学者既已开始人参皂苷的研究。1906年从高丽人参获得一种熔点为190℃的皂苷,酸水解释放出皂苷元和葡萄糖;嗣后又得到称为“panaxin”的物质,稀酸水解后获得结晶性皂苷元α-panaxin。由于薄层色谱技术的应用,1961年发现人参皂苷的酸水解产物中至少有4种皂苷元存在,并从中分离得到1种皂苷元-齐墩果酸。1962年见报从红参的乙醇提取物的酸水解产物中得到人参醇(panaxol),同时证明分子中存在2~3个羟基。权威数据库SciFinder收载的人参皂苷研究的较早、稍详细的文献发表在1965年,为日本学者柴田承二教授等所著[11],直至20世纪90年代末,人们一直热衷于人参皂苷类成分的研究,为鼎盛时期,取得了辉煌的成绩。
3 人参皂苷的结构类型
按人参皂苷(ginsenoside)的结构类型,可分为四环三萜类的达玛烷型(dammarane-type,I型)和五环三萜的齐墩果烷型(oleanene type,II型)。按四环母核上C-3、C-6、C-12、C-20四个羟基中无或有C6-OH,可分为原人参二醇型(protopanaxadiol type,I-1型)和原人参三醇型(protopanaxatriol type,I-2型);由于I-1和I-2型的C-20手性碳取代位置的差异,又进一步分为20(S)和20(R)型(图1)。迄今为止,从人参中共分离鉴定了70个三萜皂苷类化合物,总结在表1~4,包括了水参、生晒参等与红参共有的成分和各自特有的成分。
人参皂苷Rb1、Rb2、Rc、Rd、Re、Rg1、Rg2是水参、生晒参和红参的主要成分,人参皂苷Rh1、Rh2、Rg3、Rg5、Rg6、Rs4-Rs7、Rk1-Rk3等是红参的特有成分;人参皂苷Rh1、Rh2、Rg3是人参皂苷Rg2、Rg3、Rd的脱糖基化产物,人参皂苷Rg5和Rg6分别是人参皂苷Rg3和Rg2的脱水产物,人参皂苷Rs1、Rs2、Rs3分别是人参皂苷Rb2、Rc、Rg3的乙酰化产物。某些人参皂苷之间在生源上具有密切关系。
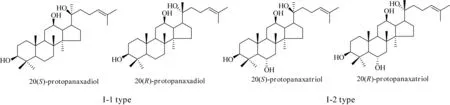
图1 达玛烷型人参皂苷元的结构

表1 原人参二醇型人参皂苷

No.名称R1R2来源文献120S-ginsenosideRa1-glc(2-1)glc-glc(6-1)ara(p)(4-1)xylW,R[12,13]220S-ginsenosideRa2-glc(2-1)glc-glc(6-1)ara(f)(2-1)xylW,R[12,13]320S-ginsenosideRa3-glc(2-1)glc-glc(6-1)glc(3-1)xylW,R[14]420S-ginsenosideRa4-glc(2-1)glc(6)Bu-glc(6-1)ara(p)(4-1)xylW[15]520S-ginsenosideRa5-glc(2-1)glc(6)Ac-glc(6-1)ara(p)(4-1)xylW[15]620S-ginsenosideRa6-glc(2-1)glc(6)Bu-glc(6-1)glcW[15]720S-ginsenosideRa7-glc(2-1)glc(6)Bu-glc(6-1)ara(p)W[15]820S-ginsenosideRa8-glc(2-1)glc(4)Bu-glc(6-1)ara(f)W[15]920S-insenosideRa9-glc(2-1)glc(6)Bu-glc(6-1)ara(f)W[15]1020S-ginsenosideRb1-glc(2-1)glc-glc(6-1)glcW,R[13,16,17]1120S-ginsenosideRb2-glc(2-1)glc-glc(6-1)ara(p)W,R[13,16,17]1220S-ginsenosideRb3-glc(2-1)glc-glc(6-1)xylW,R[13,18]1320S-ginsenosideRc-glc(2-1)glc-glc(6-1)ara(f)W,R[13,16,17]1420S-ginsenosideRd-glc(2-1)glc-glcW,R[13,16,17]1520S-ginsenosideRg3-glc(2-1)glc-HW,R[13,17,19]1620R-ginsenosideRg3-glc(2-1)glc-HR[17]1720R-ginsenosideRh2-glc-HWa[20]1820S-ginsenosideRh2-glc-HR[17]1920S-ginsenosideRs1-glc(2-1)glc(6)Ac-glc(6-1)ara(p)W,R[13,15]2020S-ginsenosideRs2-glc(2-1)glc(6)Ac-glc(6-1)ara(f)W,R[13,15]2120S-ginsenosideRs3-glc(2-1)glc(6)Ac-glc(6-1)ara(f)R[21]22malonyl-20S-ginsenosideRa3-glc(2-1)glc(6)mal-glc(6-1)glc(3-1)xylW[22]23malonyl-20S-ginsenosideRb1-glc(2-1)glc(6)mal-glc(6-1)glcW[15,23]24malonyl-20S-ginsenosideRb2-glc(2-1)glc(6)mal-glc(6-1)ara(p)W[23]25malonyl-20S-ginsenosideRc-glc(2-1)glc(6)mal-glc(6-1)ara(f)W[23]26malonyl-20S-ginsenosideRd-glc(2-1)glc(6)mal-glcW[23]27malonyl-20S-notoginsenosideR4-glc(2-1)glc(6)mal-glc(6-1)glc(6-1)xylW[24]2820S-gypenosideXVII-glc-glc(6-1)glcW[15]2920S-notoginsenoside-Fe-glc-glc(6-1)ara(f)W[25]3020S-notoginsenosideR4-glc(2-1)glc-glc(6-1)glc(6-1)xylW,R[14,26]3120S-pseudo-ginsenosideRC1-glc(2-1)glc(6)Ac-glcW[15]3220S-quinquenosideR1-glc(2-1)glc(6)Ac-glc(6-1)glcW,R[13,15]3320S-vinaginsenosideR16-glc(2-1)xyl-glcW[15]
ara(f):α-L-arabinofuranosyl;ara(p):α-L-arabinopyranosyl;glc:β-D-glucopyranosyl;xyl:β-D-xylopyranosyl;mal:malonyl;Ac:acetyl;Bu:trans-but-2-enoyl。
W:水参或生晒参;Wa:林下参;R:红参

表2 原人参三醇型人参皂苷

No.名称R1R2来源文献3420S-ginsenosideRe-glc(2-1)rha-glcW,R[13,17,27]3520S-ginsenosideRe1-glc-glc(3-1)glcW[28]3620S-ginsenosideRe2-glc(3-1)glc-glcW[28]3720S-ginsenosideRe3-glc-glc(4-1)glcW[28]3820S-ginsenosideRe4-glc-glc(6-1)ara(f)W[28]3920S-ginsenosideRe6-glc-glc(6)BuW[28]4020S-ginsenosideRf-glc(2-1)glcHW,R[13,17,27]4120S-ginsenosideRg1-glc-glcW,R[13,17,19,29]4220S-ginsenosideRg2-glc(2-1)rha-HW,R[13,17,27]4320R-ginsenosideRg2-glc(2-1)rha-HW,R[13,17,26]4420-gluco-20S-ginsenosideRf-glc(2-1)glc-glcW,R[13,18]4520S-ginsenosideRh1-glc-HR[17,19]4620R-ginsenosideRh1-glc-HR[17]4720S-koryoginsenosideR1-glc(6-1)Bu-glcW[19,25,28]4820S-notoginsenosideN-glc(4-1)glc-glcW[28]4920S-notoginsenosideR1-glc(2-1)xyl-glcW,R[13,19,28]5020S-notoginsenosideR2-glc(2-1)xyl-HW[26,28]5120S-yesanchinosideD-glc(6)Ac-glcW[28]
ara(f):α-L-arabinofuranosyl;glc:β-D-glucopyranosyl;rha:α-L-rhamnopyranosyl;xyl:β-D-xylopyranosyl;Bu:trans-but-2-enoyl。
W:水参或生晒参;R:红参。

表3 原人参二醇和三醇型人参皂苷衍生物

No.名称结构R1R2来源文献52ginsenjilinolI-2-1-glc(2-1)glc-HW[25]53ginsenosideF4I-2-2-glc(2-1)rha-R[30,31]54ginsenosideRe5I-2-3-glc(2-1)glc-HW[28]55ginsenosideRf2I-2-4-glc(2-1)rha-R[32]56ginsenosideRg5I-1-1-glc(2-1)glc-R[31,33,34]57ginsenosideRg6I-2-5-glc(2-1)rha-R[31,35]58ginsenosideRh4I-2-6-glc-R[31,36,37]59ginsenosideRk1I-1-2-glc(2-1)glc-HR[31,37]60ginsenosideRk2I-1-3-glc-HR[37]61ginsenosideRk3I-2-7-H-OglcR[31,37]62ginsenosideRs4I-1-4-glc(2-1)glc(6)Ac-R[31,38]63ginsenosideRs5I-1-5-glc(2-1)glc(6)Ac-HR[31,38]64ginsenosideRs6I-2-8-glc(6)Ac-R[38]65ginsenosideRs7I-2-9-H-glc(6)AcR[38]66koryoginsenosideR2I-1-6-glc(2-1)glc-glc(6-1)glcW[19]
glc:β-D-glucopyranosyl;W:生晒参;R:红参。

表4 齐墩果烷型人参皂苷

No.名称结构R1R2来源文献67ginsenosideRoII-1-glcUA(2-1)glc-glcW,R[13,16]68ginsenosideRiII-1-H-ara(f)Wa[39]69ginsenosideRomethylesterII-1-(6'-Me)glcUA(2-1)glc-glcW[40]70polyacetyleneginsenoside-RoII-1-(6'-PAE)glcUA(2-1)glc-glcW[40]
ara(f):α-L-arabinofuranosyl;glc:β-D-glucopyranosyl;glcUA:β-D-glucopyranosiduronic acid;6′-Me:6′-methyl ester;6′-PAE:6′-panaxytriol ester;W:生晒参;Wa:芦头;
4 不同商品人参中人参皂苷的区别及物质基础的思考
迄今,从水参或生晒参中共分离鉴定了53个人参皂苷,其中,人参皂苷Rb1、Rb2、Rc、Rd、Re、Rg1的含量占人参总皂苷的90%以上,为主要成分。尽管随着分离技术和化合物结构鉴定水平的不断提高,一系列新的人参皂苷相继被分离、鉴定,但含量甚微,如高丽人参皂苷(koryoginsenoside)R1和R2的收率仅分别为0.003 9‰和0.010 5‰,在总皂苷发挥生物学活性的贡献度上,可能并非重要。如果考虑到肠道壁垒和肠蠕动等因素,这些极微量成分的生物利用度是难以想象的。尽管从人参中分离出取代模式多样化的人参皂苷,但主要的苷元结构只有原人参二醇和原人参三醇2种。依据现代系统生物学的研究成果,口服人参及其制剂,人参皂苷将在肠内微生态细菌的作用下逐级降解脱去糖基[41],转化为种类较少的少糖基皂苷或其苷元而吸收进入体内,发挥潜在的生物学活性。这些具有潜在生物学活性的物质来源于人参中较复杂的原生苷。人单次服用人参总皂苷(4 mg/胶囊×7,折合人参根1~2 g),在血浆中,给药后30 min可检测到人参皂苷Rh1,3~5.2 h后可检测到人参皂苷Rh1的水解产物,5.2~8.2 h后可检测到人参皂苷Rb1,7.3~10.8 h后可检测到人参皂苷K(C-K),7.8~11.8 h后可检测到人参皂苷F1,8.7-10.3 h后可检测到C-K的水解产物。在尿液中,给药后0~3 h可检测到人参皂苷Rb2、Rc、Rd、Re、Rg1,3~6 h可检测到人参皂苷Rh1,6~12 h可检测到人参皂苷Rb1、C-K,12~24 h可检测到人参皂苷F1/Rh1、C-K[42]。以人参皂苷Rg1和人参皂苷Re为例,口服后可能发生图2所示的体内生物转化过程。
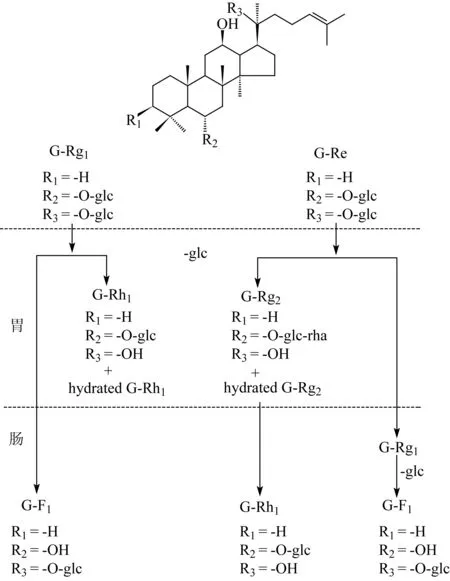
图2 人参皂苷-Rg1和-Re在人消化道内的生物转化过程
人参皂苷Rb2、Rc和Re是人参中的原生苷,由于口服人参总皂苷后在尿液中可检测到它们被排泄,所以我们有理由相信人参中的原生苷可以吸收入血,进入体循环。许多的研究证明了人参单体皂苷和人参总皂苷的生物学活性与人参的功效吻合,即或其人体内生物转化产物C-K对血浆肾上腺酮(corticosterone)的影响也与人参的安神作用吻合。提示人参皂苷是人参作用的物质基础,人参皂苷Rb1、Rb2、Rc、Rd、Re、Rg1皆是人参质量标准的标识物。
目前从红参中共分离鉴定了37个人参皂苷。20R-人参皂苷Rg3,20R-和20S-人参皂苷Rh1,20S-人参皂苷Rh2,人参皂苷F4、Rf2、Rg5、Rg6、Rh4、Rk1-Rk3、Rs4-Rs7等仅在红参中发现,它们似乎是红参特有的成分。在分子结构中,它们仅结合1-2个糖基,具备适中的肠吸收极性,提示它们更易进入体内发挥作用,此可能是红参与生晒参和/或白参作用有别的原因之一。一般来说,分子结构中糖基越多,极性越强,肠吸收越差。水参在加工成红参过程中,糖基的部分脱除,转化成极性适宜于肠吸收的少糖基皂苷,其生物利用度提高是必然的。从水参与红参的皂苷性质、特有成分含量等方面进行综合比较,水参加工为红参的科学性可见一斑。水参、生晒参或白参的苷元结构比较单一且固定。从表3可见,红参中人参皂苷的苷元结构具有多样性,热致脱水是最突出的特点;亦提示其生物活性更丰富。研究表明[43],将4年生生晒参放在盛有水的高压灭菌锅中,分别在100、110或120 ℃加热蒸制2 h,随着温度不断升高,高效液相色谱图(图3)的峰型发生变化,人参皂苷Rb1、Rb2、Rc、Rd、Re和Rg1的含量逐渐降低,而原料中本没有的人参皂苷F4、Rg3和Rg5的含量逐渐升高,在120℃处理组,人参皂苷Rg3和Rg5的含量最高(表5)。
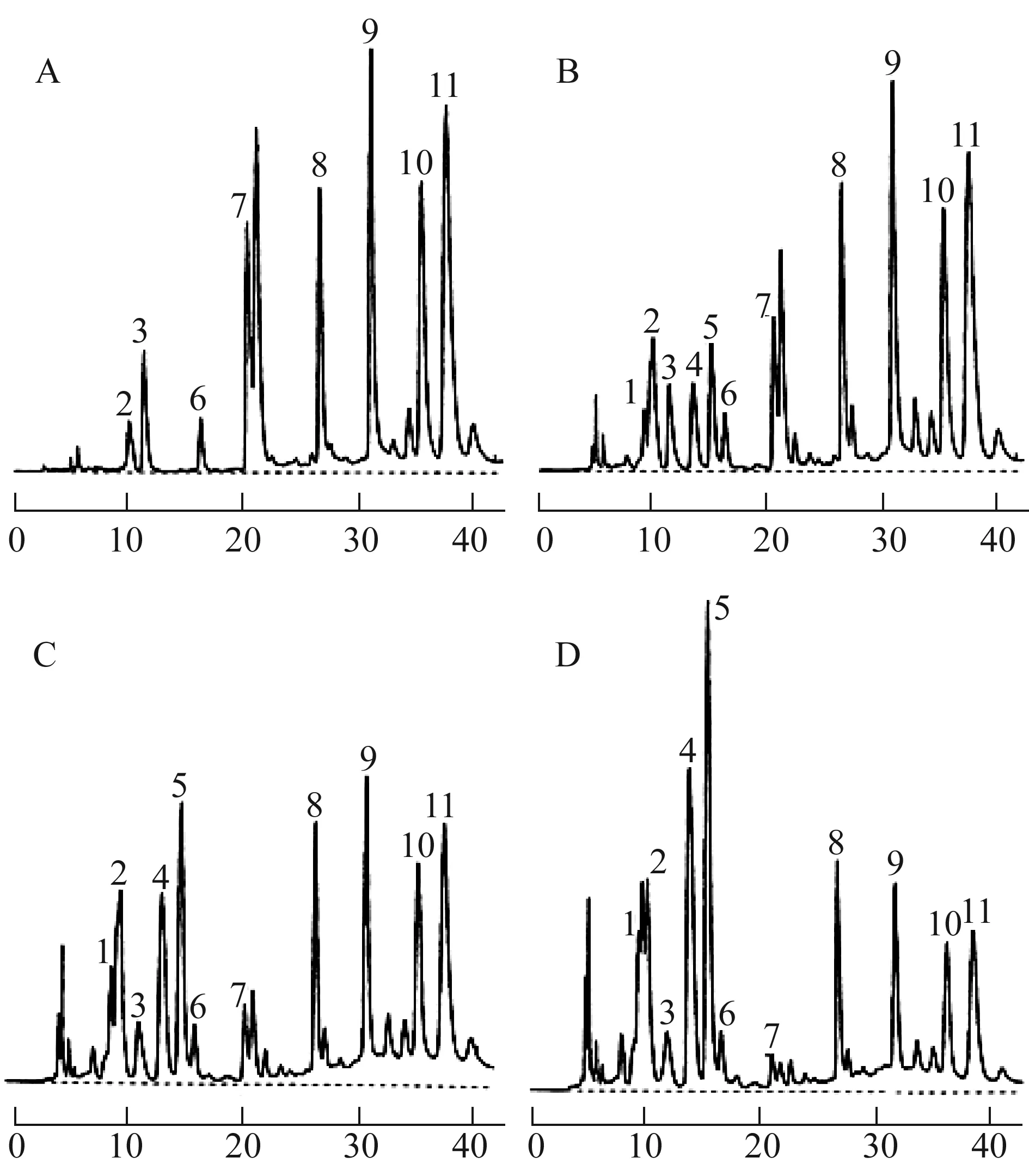
人参皂苷:1.F4,2.Rg2,3.Rg1,4.Rg5,5.Rg3,6.Rf,7.Re,8.Rd,9.Rc,10.Rb2,11.Rb1。图3 原料人参(A)和在100 ℃(B)、110 ℃(C)、120 ℃(D)蒸制人参的人参皂苷高效液相色谱图

分析物原料人参蒸制人参100℃110℃120℃人参皂苷Rb10.56±0.030.50±0.030.30±0.030.12±0.03人参皂苷Rb20.52±0.030.44±0.040.26±0.040.10±0.03人参皂苷Rc0.65±0.030.57±0.050.40±0.080.17±0.06人参皂苷Rd0.28±0.040.27±0.030.20±0.040.14±0.08人参皂苷Re0.38±0.030.30±0.040.08±0.020.02±0.01人参皂苷Rf0.11±0.020.12±0.030.10±0.040.10±0.04人参皂苷Rg10.39±0.020.35±0.020.27±0.040.22±0.04人参皂苷Rg20.13±0.010.20±0.020.32±0.050.30±0.03人参皂苷Rg3未检测到0.24±0.030.62±0.061.32±0.14人参皂苷Rg5未检测到0.15±0.030.35±0.050.64±0.08人参皂苷F4未检测到0.14±0.030.18±0.020.23±0.05
根据各人参皂苷含量的消长和人参皂苷的结构特点,推测人参皂苷Rg3来源于人参皂苷Rb1、Rb2、Rc和Rd;由于C-20糖苷键断裂,羟基位阻减小,得到的是20S-人参皂苷Rg3和20R-人参皂苷Rg3的混合物(图4)。无论是20S-人参皂苷Rg3还是20R-人参皂苷Rg3,C-20羟基与H-22脱水,皆可产生人参皂苷Rg5;C-20羟基与H-21脱水,皆可产生人参皂苷Pk1;人参皂苷Pk1进一步脱去1分子葡萄糖基,则可产生人参皂苷Pk2。通过同样的机制,能够预测由人参皂苷Re可产生人参皂苷Rg2和人参皂苷F4,它们继续通过脱水和脱糖基机制产生人参皂苷Rh4和Pk3等等。
在比较性活性鉴定中,发现蒸制人参无论是捕捉DPPH自由基能力还是松弛大鼠内皮细胞依赖性主动脉环都比非蒸制人参的强。提示了蒸制人参的作用。


G-Rb1R1=-glc(2-1)glcR2=-glc(6-1)glcG-Rb2R1=-glc(2-1)glcR2=-glc(6-1)ara(p)G-RcR1=-glc(2-1)glcR2=-glc(6-1)ara(f)G-RdR1=-glc(2-1)glcR2=-glcG-Rg3R=-glc(2-1)glcG-Rg5R=-glc(2-1)glcG-Pk1R=-glc(2-1)glc
G:人参皂苷
图4人参皂苷Rg3和Rg5的产生过程
在抗血小板凝集活性试验中,人参皂苷F4、Rg6、Rk3对花生四烯酸所致血小板凝集具有抑制作用,半数抑制浓度(IC50)分别为114、76、128 μM。在红参特有的7个人参皂苷F4、Rg6、Rh4、Rk3、Rs3-Rs5中,对U46619(血栓烷A2仿生药)所致血小板凝集,人参皂苷F4、Rg6、Rh4、Rk3抑制活性最强,IC50分别为87、286、119、187 μM,大大强于阳性对照药乙酰水杨酸(IC50为468 μM)。人参皂苷F4、Rg6和Rh4对二磷酸腺苷和胶原所致血小板凝集几乎没有抑制作用;乙酰化的人参皂苷Rs3、Rs4和Rs5对二磷酸腺苷、花生四烯酸、U46619和胶原所致血小板凝集的作用都很弱[44]。与人参茎叶中的人参皂苷[10]比较,红参中的某些稀有皂苷元与人参茎叶中的十分类似和/或相同,如两者皆含有人参皂苷Rg6;C-17侧链脱水衍生的皂苷具有类似性。此外,具有抑制肿瘤细胞增殖活性的人参皂苷Rh1和Rh2亦是稀有人参皂苷,在人参茎叶亦分离得到。因此,今后要在红参与人参茎叶等人参皂苷的生物活性上开展比较性研究。
商业上,林下参的价格不斐,已成为人参系列产品的特殊商品规格。由于资源和成本的限制,林下参人参皂苷成分尚缺乏系统性研究,已报道的人参皂苷成分包括人参皂苷Rb1、Rb2[20]、Rb3[45]、Rc、Rd、Re、Rg1,20(R)-人参皂苷Rg2[20],20(S)-人参皂苷Rg2[45],20(R)-人参皂苷Rg3[20],20(S)-人参皂苷Rg3[45],20(R)-人参皂苷Rh1,20(S)-人参皂苷Rh1,20(R)-人参皂苷Rh2[20]和20(S)-人参皂苷Rh2[45];20(R)-人参皂苷Rh2是其较特异性成分。
5 结语
人参皂苷Rb1、Rb2、Rc、Rd、Re、Rg1、Rg2是水参、生晒参和红参的共有和主要的成分;水参和生晒参的人参皂苷元结构类型比较单一且固定,而红参的则具有多样性;红参特有人参皂苷和少糖基人参皂苷等成分是红参作用有别于水参和生晒参的物质基础。今后应对人参加工过程中稀有人参皂苷的产生开展系统而深入的研究;受红参稀有人参皂苷的启迪,人参茎叶皂苷是有发展前途的人参皂苷。
[1] Bahrke M,Morgan W,Stagner A.Is ginseng an ergogenic aid?[J].Int J Sport Nutr Exer Metab,2009,19(3):298-322.
[2] Coleman C,Hebert J,Reddy P.The effects ofPanaxginsengon quality of life[J].J Clin Pharm Ther,2003,28(1):5-15.
[3] Geng J,Dong J,Ni H,et al.Ginseng for cognition[J].Cochrane Database Syst Rev(Online)2012,12 CD007769.
[4] Lee M,Yang E,Kim J,et al.Ginseng for cognitive function in Alzheimer's disease:a systematic review[J].J Alzheimer's Dis,2009,18(2):339-344.
[5] Buettner C,Yeh G,Phillips R,et al.Systematic review of the effects of ginseng on cardiovascular risk factors[J].Ann Pharmacother,2006,40(1):83-95.
[6] Hur M,Lee M,Yang H,et al.Ginseng for reducing the blood pressure in patients with hypertension:a systematic review and meta-analysis[J].J Ginseng Res,2010,34(4):342-347.
[7] Jang D,Lee M,Shin B,et al.Red ginseng for treating erectile dysfunction:a systematic review[J].Br J Clin Pharmacol,2008,66(4):444-450.
[8] Kim S,Shin B,Lee M,et al.Red ginseng for type 2 diabetes mellitus:a systematic review of randomized controlled trials[J].Chin J Integr Med,2011,17(12):937-944.
[9] Kim H,Yoo S,Park H,et al.Antioxidant effects ofPanaxginsengC.A.Meyer in healthy subjects:a randomized,placebo-controlled clinical trial[J].Food Chem Toxicol,2011,49(9):2229-2235.
[10] 李珂珂,杨秀伟.人参茎叶化学成分的研究进展[J].中国现代中药,2012,14(1):47-50.
[11] Shibata S,Ando T,Tanaka O,et al.Saponins and sapogenins ofPanaxginsengC.A.Meyer and some otherPanaxspp.[J].Yakugaku Zasshi,1965,85(8):753-755.
[12] Besso H,Kasai R,Saruwatari Y,et al.Ginsenoside-Ra1and ginsenoside-Ra2,new dammarane-saponins of ginseng roots[J].Chem Pharm Bull,1982,30(7):2380-2385.
[13] Kasai R,Besso H,Tanaka O,et al.Saponins of red ginseng[J].Chem Pharm Bull,1983,31(6):2120-2125.
[14] Matsuura H,Kasai R,Tanaka O,et al.Further studies on dammarane-saponins of ginseng roots[J].Chem Pharm Bull,1984,32(3):1188-1192.
[15] Zhu G Y,Li Y W,Hau D K P,et al.Acylated protopanaxadiol-type ginsenosides from the root ofPanaxginseng[J].Chem Biodiv,2011,8(10):1853-1863.
[16] Sanada S,Kondo N,Shoji J,et al.Saponins of ginseng.I.Structures of ginsenoside Ro,Rb1,Rb2,Rc,and Rd[J].Chem Pharm Bull,1974,22(2):421-428.
[17] Kitagawa I,Yoshikawa M,Yoshihara M,et al.Chemical studies on crude drug precession.I.On the constituents of Ginseng Radix Rubra(1)[J].Yakugaku Zasshi,1983,103(6):612-622.
[18] Sanada S,Shoji J.Studies on the saponins of ginseng.III.Structures of ginsenoside Rb3and 20-glucoginsenoside Rf[J].Chem Pharm Bull,1978,26(6):1694-1697.
[19] Kim D S,Chang Y J,Zedk U,et al.Dammarane saponins fromPanaxginseng[J].Phytochemistry,1995,40(5):1493-1497.
[20] 钟方丽,刘金平,卢丹,等.林下参化学成分的研究[J].中成药,2008,30(2):241-243.
[21] Baek N I,Kim J M,Park J H,et al.Ginsenoside Rs3,a genuine dammarane-glycoside from Korean red ginseng[J].Arch Pharm Res,1997,20(3):280-282.
[22] Ruan C C,Liu Z,Li X,et al.Isolation and characterization of a new ginsenoside from the fresh root ofPanaxginseng[J].Molecules,2010,15(4):2319-2325.
[23] Kitagawa I,Taniyama T,Hayashi T,et al.Malonyl-ginsenosides Rb1,Rb2,Rc,and Rd,four new malonylated dammarane-type triterpene oligoglycosides from Ginseng radix[J].Chem Pharm Bull,1983,31(9):3353-3356.
[24] 孙光芝,李向高,刘志,等.人参根中丙二酰基三七人参皂苷-R4的分离及其结构表征[J].高等学校化学学报,2007,28(7):1316-1318.
[25] 王洪平,杨鑫宝,杨秀伟,等.吉林人参根和根茎的化学成分研究[J].中国中药杂志,2013,38,进展中.
[26] 窦德强,任杰,陈颖,等.商品人参根的化学成分研究[J].中国中药杂志,2003,28(6):522-524.
[27] Sanada S,Kondo N,Shoji J,et al.Saponins of ginseng.II.Structures of ginsenoside-Re,-Rf,and-Rg2[J].Chem Pharm Bull,1974,22(10):2407-2412.
[28] Zhu G Y,Li Y W,Hau D K P,et al.Protopanaxatriol-type ginsenosides from the root ofPanaxginseng[J].J Agric Food Chem,2011,59(1):200-205.
[29] Nagai Y,Tanaka O,Shibata S.Chemical studies on the oriental plant drugs—XXIV:Structure of ginsenoside-Rg1,a neutral saponin of ginseng root[J].Tetrahedron,1971,27(5):881-892.
[30] Ryu J H,Park J H,Kim T H,et al.A genuine dammarane glycoside,(20E)-ginsenoside F4from Korean red ginseng[J].Arch Pharm Res,1996,19(4):335-336.
[31] Zhang Y C,Pi Z F,Liu C M,et al.Analysis of low-polar ginsenosides in steamedPanaxginsengat high-temperature by HPLC-ESI-MS/MS[J].Chem Res Chin Univ,2012,28(1):31-36.
[32] Park J D,Lee Y H,Kim S I.Ginsenoside Rf2,a new dammarane glycoside from Korean red ginseng(Panaxginseng)[J].Arch Pharm Res,1998,21(5):615-617.
[33] Baek N I,Kim S I,Park J H,et al.Ginsenoside Rg5,a genuine dammarane glycoside from korean red ginseng[J].The Ginseng Review,1996,(22):88-92.
[34] Kim S I,Park J H,Ryu J H,et al.Ginsenoside Rg5,a genuine dammarane glycoside from korean red ginseng[J].Arch Pharm Res,1996,19(5):551-553.
[35] Ryu J H,Park J H,Eun J H,et al.A dammarane glycoside from Korean red ginseng[J].Phytochemistry,1997,44(5):931-933.
[36] Baek N I,Kim D S,Lee Y H,et al.Isolation of a novel dammarane-glycoside,ginsenoside Rh4,from korean red ginseng[J].The Ginseng Review,1995,(20):84-86.
[37] Park I H,Kim N Y,Han S B,et al.Three new dammarane glycosides from heat processed ginseng[J].Arch Pharm Res,2002,25(4):428-432.
[38] Park I H,Han S B,Kim J M,et al.Four new acetylated ginsenosides from processed ginseng(sun ginseng)[J].Arch Pharm Res,2002,25(6):837-841.
[39] 富力,李向高,杨守仁.人参中齐墩果酸型新皂甙的分离鉴定[J].吉林农业大学学报,1998,20(2):30-34,42.
[40] Zhang H J,Lu Z Z,Tan G T,et al.Polyacetyleneg-insenoside-Ro,a novel triterpenesaponin fromPanaxginseng[J].Tetrahedron Lett,2002,43(6):973-977
[41] 杨秀伟.中药成分的吸收、分布、代谢、排泄、毒性与药效(ADME/Tox./Act)(下册)[M],北京:中国医药科技出版社,2006:978-432.1052.
[42] Tawab M A,Bahr U,Karas M,et al.Degradation of ginsenosides in humans after oral administration[J].Drug Metab Dispos,2003,31(8):1065-1071.
[43] Kim W Y,Kim J M,Han S B,et al.Steaming of ginseng at high temperature enhances biological activity[J].J Nat Prod,2000,63(12):1702-1704.
[44] Lee J G,Lee Y Y,Wu B,et al.Inhibitory activity of ginsenosides isolated from processed ginseng on platelet aggregation[J].Pharmazie,2010,65(7):520-522.
[45] 钟方丽,刘金平,卢丹,等.林下参的化学成分研究[J].中草药,2009,40(6):869-871.
StudyonGinsenosidesintheRootsandRhizomesofPanaxginseng
YANG Xin-bao1,2,3,YANG Xiu-wei3*,LIU Jian-xun1,2*
(1.Researchcenter,Xiyuanhospital,ChinaAcademyofChineseMedicalSciences,Beijing100091,China;2.BeijingUniversityofChineseMedicines,Beijing100029,China;3.StateKeyLaboratoryofNaturalandBiomimeticDrugs,DepartmentofNaturalMedicines,SchoolofPharmaceuticalSciences,PekingUniversity,Beijing100191,China)
Ginseng,the roots and rhizomes ofPanaxginsengC.A.Mey.(Araliaceae),is one of the most commonly used traditional Chinese medicines.Of the three main kinds of ginseng,fresh ginseng is crude ginseng harvested from the land of planting,white ginseng is sun-dried ginseng,and red ginseng is produced by steaming raw ginseng.In this article,the studies on ginsenosides in the fresh ginseng,sun-dried ginseng(Ginseng Radix et Rhizoma)and red ginseng(Ginseng Radix et Rhizoma Rubra)were summarized,and the characteristics of chemical structure-types of the aglycone were investigated,to provide scientific foundation for their bioactive material base establishment.The chemical structure-types of the aglycones in the fresh and sun-dried ginsengs were oversimplified,which were divided into the three types of protopanaxadiol,protopanaxatriol and oleanolic acid.The chemical diversity of aglycone types in red ginseng were revealed,which might greatly contribute to the bioactive diversity of red ginseng.
Ginseng Radix et Rhizoma;Ginseng Radix et Rhizoma Rubra;Ginsenosides;Bioactive material base
2013-04-07)
△
国家自然科学基金重点项目(30830118);“十二五”国家科技支撑专项(2011BAI03B01;2011BAI07B08)
*
杨秀伟,E-mail:xwyang@bjmu.edu.cn;刘建勋,E-mail:liujx0324@sina.com

