酪氨酸酶抑制剂的研究进展
叶 丽,刘亚青,巨修练
(武汉工程大学化工与制药学院 绿色化工过程教育部重点实验室,湖北 武汉430074)
1 酪氨酸酶的主要功能
酪氨酸酶又称酚氧化酶、多酚氧化酶、儿茶酚氧化酶,是一种结构复杂的含铜金属氧化酶,广泛存在于微生物、动植物以及人体中[1,2]。在生物体内,酪氨酸酶对酪氨酸和其它酚类化合物的代谢及黑色素的合成起重要的催化作用[3]。在合成黑色素过程中,酪氨酸酶主要参与两类反应:催化L-酪氨酸羟基化为L-多巴(单酚酶活性);氧化L-多巴形成多巴醌(二酚酶活性)[4,5],两类反应都必须有氧的参与。
酪氨酸酶是合成黑色素的关键酶,但其在体内的异常过量表达却可导致人体的许多色素沉淀性皮肤病,如雀斑、黄褐斑、老年斑等[6]。水杨酸类、壬二酸类、熊果甙、曲酸、氢醌、维生素C衍生物以及一些中药提取物等常被用作化妆品中的增白剂,其原理就是作为酪氨酸酶的抑制剂,可以有效地抑制酪氨酸酶的活性,从而阻止黑色素的不断累积,达到美白的效果。水果、蔬菜等食品的褐变也是由于酪氨酸酶的作用,因而酪氨酸酶抑制剂也被用作食品保鲜的添加剂,防止食品的褐变[7]。此外,酪氨酸酶还是昆虫赖以生存的一种重要酶,其催化合成的黑色素可以保护昆虫免受紫外线过度辐射,也与昆虫蜕皮过程中的鞣化以及伤口愈合有关[8]。因此,酪氨酸酶抑制剂越来越受到国内外学者的关注。目前,对其抑制机理、抑制动力学以及应用有了一定的了解,并合成了大量有价值的新型抑制剂,但寻求特异性更高、毒性更低的酪氨酸酶抑制剂仍是该领域的研究热点。
2 酪氨酸酶的活性中心结构
截至目前,已经有几十种酪氨酸酶的蛋白晶体结构被解析出来,这些酪氨酸酶主要来源于Streptomyces castaneoglobisporus (链霉菌)、Bacillus megaterium(巨大芽孢杆菌)、Agaricus bisporus(双孢蘑菇)、Citrobacter freundil(弗式柠檬酸杆菌)、Citrobacter intermedius(柠檬酸杆菌)等。酪氨酸酶的活性中心是疏水性的[7],含有2个Cu2+,每个 Cu2+分别与蛋白质中相邻的3个组氨酸残基结合,另有一个内源桥基将这2个Cu2+联系在一起[9],如图1所示。

图1 蘑菇酪氨酸酶的活性中心Fig.1 Active center of mushroom tyrosinase
酪氨酸酶在催化反应中,其双核Cu2+活性中心以3种形式存在:还原态(Met)、氧化态(Oxy)和脱氧态(Deoxy)。只有氧化态酶(EOxy)具有单酚加羟酶活性,氧化态酶首先与单酚类化合物(M,单酚酶活性)或二酚类化合物(D,二酚酶活性)反应,生成醌及脱氧态酶(EDeoxy);然后脱氧态酶才能够结合氧分子,再度生成氧化态酶,进入循环反应。还原态酶(EMet)只具有二酚酶活性,只能与二酚结合[10]。图2详细阐明了3种形式的酪氨酸酶催化氧化单酚以及二酚的过程。
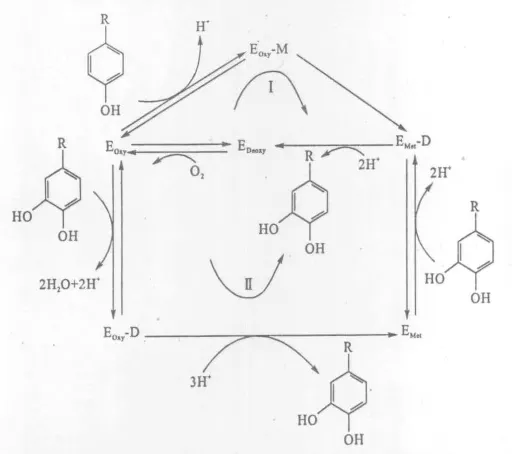
图2 酪氨酸酶催化单酚羟基化(Ⅰ)以及二酚氧化(Ⅱ)过程Fig.2 The catalytic process of the hydroxylation of monophenol(Ⅰ)and oxidation of o-diphenol(Ⅱ)by tyrosinase
3 酪氨酸酶抑制剂的抑制机理
对抑制剂而言,一般根据抑制剂与酶作用后是否引起酶永久性失活,将其分为可逆抑制剂与不可逆抑制剂。酪氨酸酶的抑制特征表现为可逆抑制[11],即抑制剂与酶的结合是一个可逆的动态平衡过程。抑制剂浓度增大会导致酶活力下降,但抑制剂只是使酶活力受到抑制,而不能使酶永久性失活,当抑制剂浓度降低时,酪氨酸酶活力会上升。根据酪氨酸酶抑制剂与酶作用位点及方式的不同,可将其分为竞争型、非竞争型、混合型及缓慢结合型4种类型,其主要机理见表1 。
然而,由于分子的多样性,酪氨酸酶抑制剂的作用机理非常复杂。一种抑制剂可能同时具备几种抑制机理;同种抑制剂针对不同底物,抑制机理也不同。要明确抑制剂属于哪种类型,需综合分析其以哪一种抑制机理为主,并通过动力学实验鉴定其抑制类型。
4 酪氨酸酶抑制剂的研究进展
4.1 竞争型抑制剂
宋康康等[12]和邱龙新等[13]等分别研究了熊果甙和鞣酸对蘑菇酪氨酸酶的抑制作用。熊果甙和鞣酸都是来源于天然物质中的具有游离酚羟基的物质,两者对酪氨酸酶的单酚酶和二酚酶均具有抑制作用,均能使酪氨酸酶的单酚酶迟滞时间明显延长,但对稳定态酶活力影响较小。160mmol·L-1的熊果甙可使单酚酶迟滞时间从82s延长到430s,但稳定态酶活力仅下降16%;2.0μmol·L-1的鞣酸可使单酚酶迟滞时间从104.7s延长到333.6s,但稳定态酶活力仅下降19.8%。熊果甙和鞣酸同为酪氨酸酶二酚酶的可逆竞争型抑制剂,对二酚酶的抑制效应表现出浓度依赖关系,导致二酚酶活力下降50%的抑制浓度(IC50)分别为5.30mmol·L-1和65μmol·L-1。抑制机理是熊果甙本身作为酶底物的类似物,而鞣酸组成中的没食子酸也与酶底物分子结构类似,两者都能竞争性地与酶活性中心结合,从而抑制酶活力。

表1 酪氨酸酶抑制剂的抑制机理Tab.1 Inhibitory mechanisms of tyrosinase inhibitors
陆珊等[14]对曲酸抑制马铃薯酪氨酸酶的作用进行了研究。结果表明,酪氨酸酶催化L-酪氨酸羟基化过程中,曲酸可以延长单酚酶的迟滞时间,并且可降低酶促反应速率。曲酸与酪氨酸酶作用的底物之一L-多巴分子结构较相似,环上有亲水性的羟基结构,在酶催化氧化L-多巴反应中表现为竞争性抑制。曲酸还具有还原性,可以将合成黑色素的反应中间产物多巴醌还原成酚,从而阻碍黑色素的生成。
鉴于曲酸抑制酪氨酸酶活性主要源于γ-吡喃酮结构中含有烯醇的羟基,Rho等设计并合成了3,4-甲二氧基肉桂酸酯曲酸。研究表明,以L-酪氨酸为底物时,3,4-甲二氧基肉桂酸酯曲酸较曲酸具有更强的抑制蘑菇酪氨酸酶活性的能力,这是因为,其分子结构中含有的肉桂酸酯疏水基团可以更好地存在于酪氨酸酶活性中心的疏水环境中,从而增强曲酸对蘑菇酪氨酸酶的抑制作用。另外,动力学研究也表明,3,4-甲二氧基肉桂酸酯曲酸和曲酸是以同一基团(即烯醇羟基)竞争性抑制蘑菇酪氨酸酶的活性。
王勤等[15]研究了对氰基苯酚对蘑菇酪氨酸酶的抑制作用。结果表明,对氰基苯酚对蘑菇酪氨酸酶活性的抑制作用表现为可逆抑制。0.50mmol·L-1的对氰基苯酚可使单酚酶迟滞时间从18s延长到80s,稳定态酶活力下降80%。对氰基苯酚、对羧基苯酚、对醛基苯酚、熊果甙对蘑菇酪氨酸二酚酶活性的影响见表2 。
由表2 可知,对氰基苯酚、对羧基苯酚、对醛基苯酚、熊果甙的IC50值分别为0.80mmol·L-1、1.30 mmol·L-1、1.15mmol·L-1和5.30mmol·L-1。这是因为,4种化合物在分子结构上具有相似性,都主要含有一个苯酚,它们对酪氨酸酶二酚酶均表现为竞争性抑制效应,只是由于对位所含的基团不同,其提供电荷能力就不同,抑制强度也有区别,随着提供电荷能力的增大(4种基团提供电荷能力大小为:氰基>醛基>羧基>糖苷基),抑制强度递增。
Ha等[16]合成了羟基取代苯基萘家族中的一个新化合物4-(6-羟基-2-萘基)-1,3-苯二酚(HNB)。研究表明,作为氧化白藜芦醇的电子等排体,HNB可以竞争性抑制蘑菇酪氨酸酶的活性,抑制效应表现为浓度依赖关系,IC50值为0.07μmol·L-1。HNB及与其结构具有相似性的氢醌、曲酸以及白藜芦醇对酪氨酸酶活性的抑制效应见表3 。
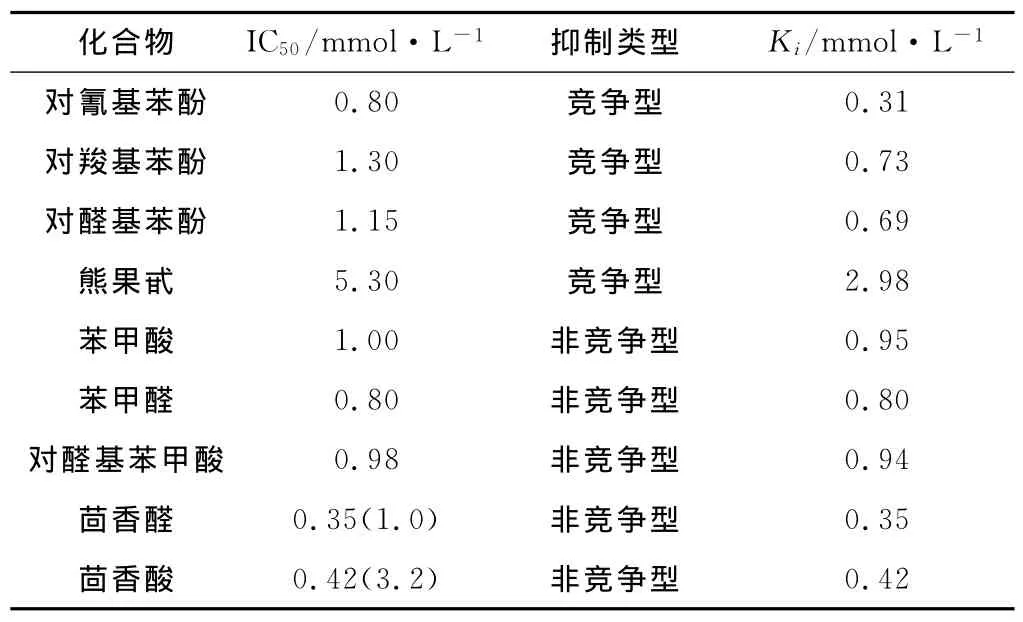
表2 化合物对蘑菇酪氨酸酶二酚酶抑制效应的比较Tab.2 Inhibitory effects comparison of compounds on mushroom tyrosinase

表3 HNB、氢醌、曲酸、白藜芦醇对蘑菇酪氨酸酶活性的抑制效应Tab.3 Inhibitory effects of HNB,hydroquinone,kojic acid and resveratrol on mushroom tyrosinase
傅博强等[17]研究了甘草中4种黄酮类化合物甘草甙、异甘草素-葡萄糖芹菜甙、异甘草甙和甘草查尔酮对酪氨酸酶单酚酶活性的抑制作用。结果表明,甘草甙对酪氨酸单酚酶没有抑制作用,而其它3种黄酮类化合物都是酪氨酸酶单酚酶的竞争型抑制剂,IC50值分别为 0.072mmol·L-1、0.038mmol·L-1、0.0258mmol·L-1。这是因为,甘草甙为双氢黄酮,分子刚性大,故没有抑制作用;其它3种为查尔酮,分子结构与L-酪氨酸类似,易与酶活性中心结合而产生抑制作用。
1999年,Kubo等[18]从藏红花中提取出黄酮醇-堪非醇并研究其对酪氨酸酶的抑制作用及机理。结果表明,黄酮醇-堪非醇具有竞争性抑制蘑菇酪氨酸酶催化氧化L-多巴的能力,IC50值为0.23mmol·L-1、ID50值为67μg·mL-1。Chang等[19]发现6,7,4′-三羟基异黄酮是酪氨酸酶的竞争型抑制剂,其对蘑菇酪氨酸酶抑制作用的IC50值为9.2μmol·L-1。Jeong等[20]从Zanthoxylum piperitum 的叶子中分离出的砾精(Quercetin)对酪氨酸酶具有竞争性抑制作用,IC50值为3.8μg·mL-1。另有研究证实高良栎精、非瑟酮、3,7,4′-三羟基黄酮和桑色素等黄酮醇都是酪氨酸酶的竞争型抑制剂。黄酮醇竞争性抑制酪氨酸酶活性的机理为:这类黄酮醇具有一个公共的3-羟基-4-酮基团,具有螯合酪氨酸酶活性中心Cu2+的作用,从而使得酶失活。
薛超彬等[21]研究了铜铁试剂对菜青虫多酚氧化酶的抑制作用。结果发现,铜铁试剂对多酚氧化酶有明显的可逆竞争性抑制作用。Shiino等[22]合成了一系列N-取代的亚硝基羟基胺类化合物,其中Dopastin是酪氨酸酶的竞争型抑制剂。研究发现这类化合物大多能抑制蘑菇酪氨酸酶的活性,并且N-取代亚硝基和N-取代羟基是这类化合物具有酪氨酸酶抑制活性的必需基团。铜铁试剂和N-取代的亚硝基羟基胺类化合物对不同酪氨酸酶的抑制机理是:通过互变异构体与酶作用底物竞争,螯合了酶活性中心的Cu2+,使酶活性中心的结构发生变化,致使酶活性降低。
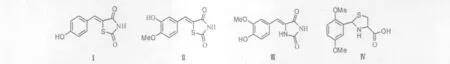
此外,Ha等发现5-取代苯亚甲基-2,4-噻唑烷二酮类化合物Ⅰ和Ⅱ[23]、5-取代苯亚甲基乙内酰脲类化合物Ⅲ[24]以及2-取代苯基-4-取代羧基噻唑烷类化合物Ⅳ[25]都是酪氨酸酶强效的竞争型抑制剂。抑制机理较复杂:一方面分子中的S可以络合酶活性中心的双核Cu2+,这与N-苯基硫脲抑制酪氨酸酶活性的机理一样,即硫脲中的S取代还原态的酪氨酸酶活性中心2个Cu2+之间的桥联配体,与酶活性中心形成稳定结构,从而抑制酪氨酸酶的活性;另一方面,亚氨基、羧基以及酰亚胺可以与酪氨酸酶活性中心以外的氨基酸残基反应或者形成氢键,从而阻断酪氨酸酶和底物L-酪氨酸以及L-多巴的结合。
4.2 非竞争型抑制剂
苯甲酸、苯甲醛、对醛基苯甲酸、茴香醛、茴香酸对蘑菇酪氨酸酶二酚酶的抑制作用见表2 。
由表2 可看出,这几类化合物对蘑菇酪氨酸酶的抑制类型一致,均为非竞争性抑制,说明苯甲醛和苯甲酸结构决定抑制作用类型,而茴香醛、茴香酸分子结构中甲氧基对酶的抑制作用类型并无影响,且对位上的甲氧基可以增强抑制效果。
Wang等[26]发现,4-氟苯甲酸、4-氯苯甲酸、4-溴苯甲酸对蘑菇酪氨酸酶的单酚酶和二酚酶均有抑制作用,它们对二酚酶的抑制作用表现为非竞争性的可逆抑制,其IC50值分别为0.26mmol·L-1、0.20mmol·L-1、0.18mmol·L-1,抑制常数分别为0.25mmol·L-1、0.20mmol·L-1、0.17mmol·L-1。林敏等[27]研究了4-氟苯甲酸、4-氯苯甲酸、4-溴苯甲酸对马铃薯多酚氧化酶的抑制效应,其IC50值分别为0.635 mmol·L-1、0.370mmol·L-1、0.300mmol·L-1,抑制常数分别为0.632mmol·L-1、0.365mmol·L-1、0.303mmol·L-1。两篇文献报道的4-卤代苯甲酸对蘑菇酪氨酸酶二酚酶及马铃薯多酚氧化酶的抑制作用类型一致,均为可逆的非竞争性抑制,并且随着卤族元素分子量的增大,抑制效果不断增强。推测4-卤代苯甲酸抑制酪氨酸酶的活性机理为:4-卤代苯甲酸结合酶活性中心之外的氨基酸残基,通过空间位阻或者改变酶的空间结构,从而抑制酶与底物的结合。
Kubo等发现从茴芹油中提取的茴香醛、从橄榄油中提取的一系列α,β-不饱和醛、从枯茗中提取的对异丙基苯醛、从其它植物中提取的对甲氧基水杨醛以及Matsuura等从柠檬精油中提取的柠檬醛等都是酪氨酸酶的非竞争型抑制剂。这些醛类化合物中的醛基可以结合酪氨酸酶活性中心之外的氨基酸残基,最典型的就是与残基中的-OH、-NH2、-SH等亲核基团结合成稳定的席夫碱配合体结构,生成的产物在疏水性的酪氨酸酶活性中心能稳定存在,并形成空间位阻,阻止底物与酪氨酸酶活性中心的作用,从而抑制酪氨酸酶的活性。另有研究表明,在醛基化合物的醛基对位引入推电子基团将使得化合物的抑制效果明显增强,推电子能力越强,抑制效果越好,这可能是因为推电子基团增强了席夫碱的稳定性。
宫霞等[28]测定了银杏叶提取物对酪氨酸酶的抑制作用,发现其为非竞争型抑制剂。当提取液的浓度为0.16g·L-1时,可最大限度抑制酶的活性,抑制率达到52.38%。银杏叶提取物的主要成分是黄酮和内酯,含有多个还原性的羟基。推测其抑制机理可能为:还原性的羟基具有孤对电子,与酶作用底物竞争性地络合酶分子活性中心的Cu2+,从而影响酶的活性;及时清除氧自由基,终止了自由基链的引发,使得酪氨酸酶的催化氧化反应不能顺利进行;作为强的抗氧化剂,拮抗氧对酪氨酸酶的激活。
Kang等[29]从可食用昆布属多茎目褐藻中提取出5种 Phloroglucinol衍生物,分别为:Glucinol、Eckstolonol、Eckol、Phlorofucofuroeckol及 Dieckol。
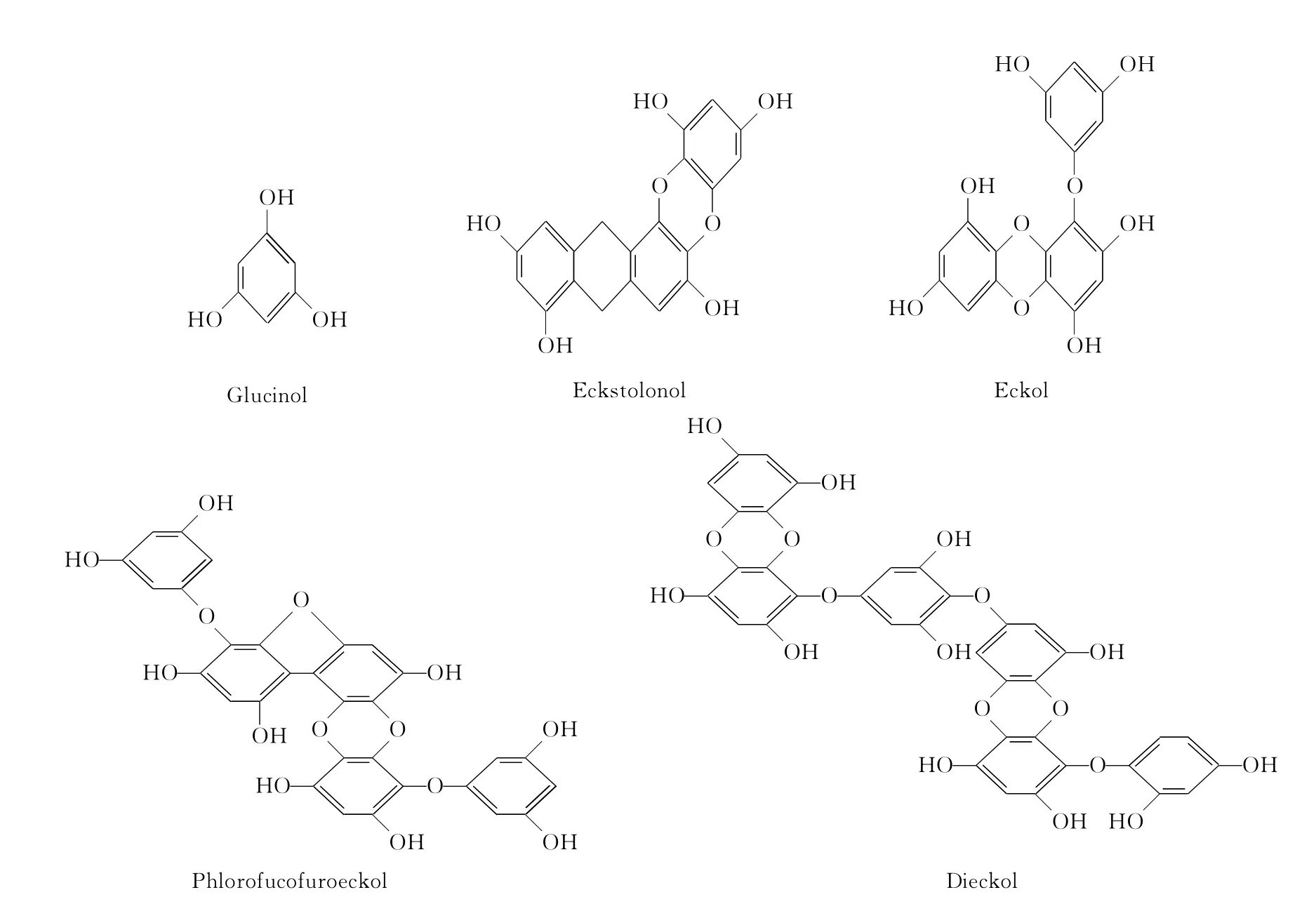
这5种化合物分子中均含有多个酚羟基,对蘑菇酪氨酸酶抑制作用的IC50值分别为92.8μg·mL-1、126μg·mL-1、33.2μg·mL-1、177μg·mL-1、2.16 μg·mL-1。动力学分析可知:Eckol、Phlorofucofuroeckol以及Dieckol为蘑菇酪氨酸酶的非竞争型抑制剂,抑制常数分别为1.9×10-5mol·L-1、1.4×10-3mol·L-1和1.5×10-5mol·L-1。Glucinol和Eckstolonol则为酶的竞争型抑制剂。此外含有多个酚羟基的天然化合物毛地黄黄酮、7-葡萄糖苷毛地黄黄酮以及甘草黄酮也是酪氨酸酶二酚酶的非竞争型抑制剂[3],IC50值分别为0.190mmol·L-1、0.500mmol·L-1和0.004mmol·L-1。
4.3 混合型抑制剂
郭云集等[30]研究了甘醇酸抑制蘑菇酪氨酸酶的作用机理。甘醇酸属于α-羟基酸(又称果酸),可使酪氨酸酶单酚酶的迟滞时间延长、稳定态酶活力下降,IC50值为29.74mmol·L-1。另外甘醇酸能可逆性地抑制蘑菇酪氨酸二酚酶的活性,IC50值为1.80mmol·L-1。根据甘醇酸的分子结构,推测其抑制作用机理为:分子中的羧基结合酶活性中心的Cu2+形成配位物,从而竞争性抑制酶的活性;分子中的羟基与酶活性中心以外的氨基酸残基形成氢键,阻断底物与酶的结合。这两种作用力使得甘醇酸对蘑菇酪氨酸酶具有较强抑制作用,抑制类型表现为混合型。
龚盛昭等[31]研究发现,香草酸对酪氨酸酶具有较好的抑制作用。香草酸与甘醇酸分子结构类似,分子中既含有羟基,又含有羧基,对酪氨酸酶的抑制类型为可逆混合型,推测其抑制作用机理与甘醇酸相似。香草酸可使单酚酶的迟滞时间延长,其IC50值为1.3 mmol·L-1,对二酚酶抑制作用的IC50值为2.6mmol·L-1。
龚盛昭等[32]从牡丹皮中提取出丹皮酚,并研究了丹皮酚对酪氨酸酶的抑制作用。结果表明,丹皮酚是酪氨酸酶二酚酶的混合型抑制剂,其对游离酶和酶-底物复合物的抑制常数分别为0.084mmol·L-1和0.12mmol·L-1,IC50值为0.60mmol·L-1。抑制机理源于丹皮酚一方面可以与酶活性中心的Cu2+络合,另一方面能与酶中氨基酸残基的氨基形成席夫碱。
陈清西等[33]研究发现,毛西蕃莲叶子的水提取物对酪氨酸酶有较显著的抑制作用,其对蘑菇酪氨酸二酚酶抑制作用的IC50值为0.47mg·mL-1,抑制类型为可逆混合型;该提取物既通过与酶作用底物L-多巴竞争酶的活性中心、抑制酶的活性,抑制常数为0.56 mg·mL-1,又能与酶-底物复合物形成酶-底物-抑制剂三元络合物从而产生抑制作用,抑制常数为1.10mg·mL-1。
刘德育等[34]研究了杨梅黄素对酪氨酸酶的抑制作用。结果显示,杨梅黄素对酪氨酸酶的抑制作用表现为浓度依赖关系,IC50值为0.082mmol·L-1。动力学实验表明,杨梅黄素是酪氨酸酶的混合型抑制剂,抑制机理为:一方面杨梅黄素可以清除酶催化反应中的过氧自由基,另一方面杨梅黄素分子中含有的羟基与酶作用底物相似,从而可抑制酶的活性,其对酶及酶-底物复合物的抑制常数分别为0.026mmol·L-1和0.072mmol·L-1。
4.4 缓慢结合型抑制剂
Jiménez等[35]探究了4位取代间苯二酚对蘑菇酪氨酸酶活性的影响。研究表明,4位取代间苯二酚是以非经典模式的缓慢结合机理抑制酪氨酸酶活性的,抑制存在一个缓冲阶段。在酶促反应开始阶段加入抑制剂,反应速度会急剧减慢,随后达到稳定状态,且随着抑制剂浓度的增大,反应初速度和稳定速度都减慢。动力学实验表明,加入抑制剂后,抑制剂与酶迅速形成复合物,随后复合物要经历一个缓慢的可逆异构化过程。
Espín等[36]研究了环庚三烯酮对三种不同来源的蘑菇酪氨酸酶的抑制机理。研究表明,环庚三烯酮是酪氨酸酶的缓慢结合型抑制剂,增大抑制剂浓度,酶反应的初速度和稳定速度都会显著减慢;反应过程中,先形成酶与抑制剂的复合物,随后复合物要经历一个缓慢的可逆异构化过程;另外,抑制剂只能与氧化态的酪氨酸酶结合,这也证明了缓慢结合型抑制剂抑制机理的合理性。此外,Cabanes等发现L-Mimosine(L-含羞草氨酸)也是蘑菇酪氨酸酶的缓慢结合型抑制剂。
酪氨酸酶抑制剂的缓慢结合型抑制模型如图3所示。
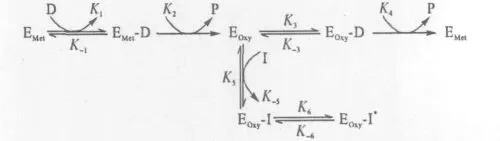
图3 酪氨酸酶抑制剂的缓慢结合型抑制模型Fig.3 Slow-binding inhibitory mechanism of tyrosinase inhibitors
由图3可知,还原态的酪氨酸酶(EMet)与二酚类化合物(D)反应形成复合物(EMet-D),经过一系列反应,脱去酚类化合物(P),形成氧化态酶(EOxy);在没有抑制剂的情况下,氧化态酶结合二酚类化合物形成底物与酶的复合物(EOxy-D);该复合物再经过一系列反应,最终又形成还原态酶,从而循环反应。在有缓慢结合型抑制剂(I)的情况下,该抑制剂(I)能与氧化态的酪氨酸酶迅速结合,形成酶与抑制剂复合物(EOxy-I);该复合物经过一个缓慢的异构化过程,得到异构化的酶与抑制剂复合物(EOxy-I*),从而抑制了酶的循环反应。
5 结语
酪氨酸酶抑制剂主要来源于:从植物的茎、叶、花、根、果实等提取出的糖苷类、黄酮类、多酚类、醛类、羧酸类化合物;采用化学方法合成的化合物,主要包括醛类、羧酸类、羟基化合物类、含氮氧等的杂环化合物;从动物体内提取以及从微生物中分离提取,提取方法主要为溶液浸取和借助仪器提取等。
发现和鉴别新型高效的酪氨酸酶抑制剂,不仅对提高蔬菜、水果等食品的质量和营养价值有重要意义,而且在控制农业害虫和防治人类的许多色素沉着疾病以及其它与黑色素有关的健康问题等方面有着重要的应用价值。研究人员对酪氨酸酶抑制剂的反应动力学、作用机理、抑制效果进行了报道,但仍有很多方面需要深入探究:不同方法获得的同种酪氨酸酶抑制剂对酶的抑制效果为何不同、不同溶液提取出的酪氨酸酶抑制剂对酶的抑制效果为何不同、同一抑制剂对不同底物抑制类型为何不一样、同类化合物的主要取代基的数目和位置对酶抑制作用的影响等。
[1]Sánchez-Ferrer A,Rodríguez-López J N,García-Cánovas F,et al.Tyrosinase:A comprehensive review of its mechanism[J].Biochimica et Biophysica Acta,1995,1247(1):1-11.
[2]Kim Y J,Uyama H.Tyrosinase inhibitors from natural and synthetic sources:Structure,inhibition mechanism and perspective for the future[J].Cellular and Molecular Life Sciences,2005,62(15):1707-1723.
[3]Fenoll L G,Pe alver M J,Rodriguez-López J N,et al.Tyrosinase kinetics:Discrimination between two models to explain the oxidation mechanism of monophenol and diphenol substrates[J].The International Journal of Biochemistry & Cell Biology,2004,36(2):235-246.
[4]Cooksey C J,Garratt P J,Land E J,et al.Evidence of the indirect formation of the catecholic intermediate substrate responsible for the autoactivation kinetics of tyrosinase[J].Journal of Biological Chemistry,1997,272(42):26226-26235.
[5]Zhang X D,Hu X,Hou A J,et al.Inhibitory effect of 2,4,2′,4′-tetrahydroxy-3-(3-methyl-2-butenyl)-chalcone on tyrosinase activity and melanin biosynthesis[J].Biological and Pharmaceutical Bulletin,2009,32(1):86-90.
[6]Chang T S,Ding H Y,Lin H C.Identifying 6,7,4′-trihydroxyisoflavone as a potent tyrosinase inhibitor[J].Bioscience,Biotechnology,and Biochemistry,2005,69(10):1999-2001.
[7]陈清西,林建峰,宋康康.酪氨酸酶抑制剂的研究进展[J].厦门大学学报(自然科学版),2007,46(2):274-282.
[8]张宗炳,冷欣夫.杀虫药剂毒理及应用[M].北京:化学工业出版社,1993:27-63.
[9]Ismaya W T,Rozeboom H J,Weijn A,et al.Crystal structure of Agarices bisporus mushroom tyrosinase:Identity of the tetramer subunits and interaction with tropolone[J].Biochemistry,2011,50(24):5477-5486.
[10]陈清西,宋康康.酪氨酸酶的研究进展[J].厦门大学学报(自然科学版),2006,45(5):731-737.
[11]李航,赵国华,阚建全,等.天然产物对酪氨酸酶的抑制及抑制机理的研究进展[J].日用化学工业,2003,33(6):383-386.
[12]宋康康,邱凌,黄璜,等.熊果甙作为化妆品添加剂对酪氨酸酶抑制作用[J].厦门大学学报(自然科学版),2003,42(6):791-794.
[13]邱龙新,黄浩,陈清西.鞣酸对蘑菇酪氨酸酶的抑制作用[J].厦门大学学报(自然科学版),2005,44(6):839-842.
[14]陆珊,胡源,刘鑫,等.曲酸对马铃薯酪氨酸酶的抑制作用研究[J].化学研究与应用,2005,17(6):729-732.
[15]王勤,邱凌,宋康康,等.对氰基苯酚对蘑菇酪氨酸酶的抑制作用[J].厦门大学学报(自然科学版),2004,43(4):568-571.
[16]Ha Y M,Chung S W,Song S H,et al.4-(6-Hydroxy-2-naphthyl)-1,3-bezendiol:A potent,new tyrosinase inhibitor[J].Biological and Pharmaceutical Bulletin,2007,30(9):1711-1715.
[17]傅博强,李欢,王小如,等.甘草黄酮类化合物对酪氨酸酶单酚酶的抑制[J].天然产物研究与开发,2005,17(4):391-395.
[18]Kubo I,Kinst-Hori I.Flavonols from saffron flower:Tyrosinase inhibitory activity and inhibition mechanism[J].Journal of Agricultural and Food Chemistry,1999,47(10):4121-4125.
[19]Chang T S,Ding H Y,Lin H C.Identifying 6,7,4′-trihydroxyisoflavone as a potent tyrosinase inhibitors[J].Bioscience Biotechnology and Biochemistry,2005,69(10):1999-2001.
[20]Jeong C H,Shim K H.Tyrosinase inhibitor isolated from the leaves of Zanthoxylum piperitum[J].Bioscience Biotechnology and Biochemistry,2004,68(9):1984-1987.
[21]薛超彬,王勤,柯莉娜,等.铜铁试剂对菜青虫多酚氧化酶的抑制作用[J].昆虫学报,2005,48(2):290-294.
[22]Shiino M,Watanabe Y,Umezawa K.Synthesis of N-substituted N-nitrosohydroxylamines as inhibitors of mushroom tyrosinase[J].Bioorganic & Medicinal Chemistry,2001,9(5):1233-1240.
[23]Ha Y M,Park Y J,Kim J A,et al.Design and synthesis of 5-(substituted benzylidene)thiazolidine-2,4-dione derivatives as novel tyrosinase inhibitors[J].European Journal of Medicinal Chemistry,2012,49:245-252.
[24]Ha Y M,Kim J A,Park Y J,et al.Analogs of 5-(substituted benzylidene)hydantoin as inhibitors of tyrosinase and melanin formation[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2011,1810(6):612-619.
[25]Ha Y M,Park Y J,Lee J Y,et al.Design,synthesis and biological evaluation of 2-(substituted phenyl)thiazolidine-4-carboxylic acid derivatives as novel tyrosinase inhibitors[J].Biochimie,2012,94(2):533-540.
[26]Wang Q,Shi Y,Song K K,et al.Inhibitory effects of 4-halobenzoic acids on the diphenolase and monophenolase activity of mushroom tyrosinase[J].The Protein Journal,2004,23(5):303-308.
[27]林敏,邱凌,周盛梅,等.4-卤代苯甲酸对马铃薯多酚氧化酶的抑制效应[J].食品科学,2008,29(5):56-59.
[28]宫霞,李全阳.银杏叶提取物对酪氨酸酶活力的抑制作用[J].食品科学,2001,22(12):25-27.
[29]Kang H S,Kim H R,Byun D S,et al.Tyrosinase inhibitors isolated from the edible brown algaEcklonia stolonifera[J].Archives of Pharmacal Research,2004,27(12):1226-1232.
[30]郭云集,宋康康,李智聪,等.甘醇酸对蘑菇酪氨酸酶的抑制作用[J].厦门大学学报(自然科学版),2008,47(3):383-386.
[31]龚盛昭,杨卓如,林希.香草酸对酪氨酸酶催化活性的抑制作用[J].精细化工,2005,22(12):927-930.
[32]龚盛昭,程江,杨卓如.丹皮酚抑制蘑菇酪氨酸酶催化氧化L-Dopa的动力学[J].药学学报,2006,41(6):561-564.
[33]陈清西,李智聪,吴思辉,等.毛西番莲提取物对蘑菇酪氨酸酶的抑制作用[J].厦门大学学报(自然科学版),2008,47(2):104-106.
[34]刘德育,雷焕强.杨梅黄素及蛇葡萄素对酪氨酸酶的抑制作用[J].生物化学杂志,1996,12(5):618-620.
[35]Jiménez M,García-Carmona F.4-Substituted resorcinols(sulfite alternatives)as slow-binding inhibitors of tyrosinase catecholase activity[J].Journal of Agricultural and Food Chemistry,1997,45(6):2061-2065.
[36]Espín J C,Wichers H J.Slow-binding inhibition of mushroom(Agaricus bisporus)tyrosinase isoforms by tropolone[J].Journal of Agricultural and Food Chemistry,1999,47(7):2638-2644.

