城市生活污水处理厂活性污泥中细菌群落结构组成研究
王 猛,李如刚,肖毅宏,邢梦雅,雷双舟,徐佳宁,徐 欣,赵大勇
(1.河海大学水文水资源学院,江苏 南京210098;2.无锡钱惠污水处理有限公司,江苏 无锡214151)
活性污泥是微生物群体及它们所依附的有机物质和无机物质的总称,具有由多种细菌组成并通过胞外聚合物和离子桥作用形成的絮状结构。细菌是活性污泥组成和净化功能的核心,也是生物法处理工业和城市生活污水的主体[1,2]。了解活性污泥中细菌的群落结构组成及多样性,使其中的微生物更好地发挥净化作用,对于进一步提高污水处理效率具有重要意义。
细菌群落多样性的传统研究方法是分离培养、显微镜观察,这类方法不足以从整体上掌握细菌群落结构组成以及多样性信息。随着分子生态学技术的发展,新兴的分子生物学技术如变形梯度凝胶电泳(Denaturing gradient gel electrophoresis,DGGE)、末端限制性片段长度多态性(Terminal restriction fragment length polymorphism,T-RFLP)、克隆文库等的出现逐渐弥补了这一缺陷[3]。
T-RFLP依据微生物的基因组学信息,选取一段具有系统进化标记特征的DNA序列为分析目标,应用荧光物质标记1个或1对引物的5′端。扩增后的PCR产物经限制性内切酶消化处理,荧光标记末端片段可被测序仪识别,得到不同长度的末端片段峰,根据片段峰的大小和数量就可以检测和分析环境样品中微生物的群落结构组成和动态变化等信息[4,5]。1997年,Liu等[6]首先应用 T-RFLP技术研究微生物多样性。随后,该技术快速发展,已成为研究环境微生物多样性的重要手段之一,与其它指纹图谱技术相比,TRFLP具有更高的灵敏度和重复性[7]。目前,已有应用 T-RFLP技术研究土壤[8]或活性污泥[9]中微生物多样性的研究报道。
作者在此以不同城市生活污水处理厂曝气池中的活性污泥样品作为研究对象,应用T-RFLP技术研究其中的细菌群落结构组成和多样性,分析细菌群落组成与水处理工艺之间的关系,拟为提高污水处理效率提供理论依据。
1 实验
1.1 样品采集
分别从乌鲁木齐、合肥、无锡和西安各选取一个大型生活污水处理厂采集活性污泥样品,其基本信息如表1 所示。
从各污水处理厂曝气池中采集活性污泥样品2L,置于冰上迅速带回实验室。离心收集活性污泥至50 mL离心管,于-20℃保存。
1.2 样品总DNA的提取与PCR扩增

表1 污水处理厂基本信息Tab.1 Information of different sewage treatment plants
将活性污泥样品用真空冷冻干燥机(ALPHA1-2,德国Christ)冻干,取0.25g,利用DNA提取试剂盒(Power Soil DNA Isolation Kit,Mobio,USA)提取样品总DNA。采用1%琼脂糖凝胶电泳检测所提取的DNA样品,于-20℃保存。
PCR扩增反应采用细菌通用引物对8f(5′-AGAGTTTGATCCTGGCTCAG-3′)和 926r (5′-CCGTCAATTCCTTTGAGTTT-3′),前者5′端采用Cy5-N-羟基琥珀酰亚胺酯进行荧光标记。50μL的PCR反应体系包括:5μL 10×PCR缓冲溶液(Ex Taq Buffer,Takara,Otsu,Japan),4 μL dNTPs,4 μL MgCl2,0.1μL上、下游引物,0.4μL Ex Taq DNA 聚合酶和1μL提取的基因组DNA,加水补足至50μL。PCR反应条件为:95℃3min;94℃30s,53℃30s,72℃1min,循环30次;72℃7min。PCR扩增产物采用2%琼脂糖凝胶电泳检测。
1.3 T-RFLP分析
首先,用绿豆酶(Mung bean nuclease)在30℃消化PCR产物30min。用PCR产物纯化试剂盒(Axygen Biotechnology Ltd.,Hangzhou,China)纯化消化后的产物。然后,用限制性内切酶HhaI(Takara,Otsu,Japan)37℃消化3h。消化产物再次纯化后,用CEQ8000(Beckman Coulter,Fullerton,CA,USA)核酸片段分析仪对酶切产物进行T-RFLP分析。进一步分析相对丰度超过1%、长度为60~600bp的TRFs片段。分别计算细菌群落的Shannon-Wiener指数(H′)、Simpson指数(D)和Pielou指数(J),以反映活性污泥样品中细菌的多样性。计算公式为:

式中:Pi表示峰面积占总面积的比例;S表示TRFs数量。
2 结果与讨论
2.1 基于T-RFLP的细菌群落结构分析
2.1.1 细菌多样性分析
根据T-RFLP图谱中T-RFs的数量、种类和丰度,分别计算各样品细菌多样性指数,结果见表2 。
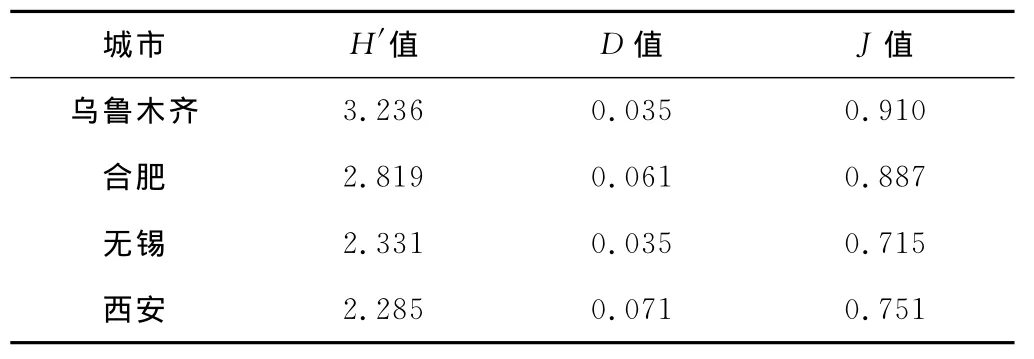
表2 不同活性污泥样品细菌多样性指数Tab.2 Bacterial diversity indexes of the activated sludge samples collected from different cities
从表2 可以看出:4个活性污泥样品的H′值、D值均有显著的差异;而J值则没有显著的差异,基本稳定在0.71~0.91之间;西安活性污泥样品的H′值最低,表明西安活性污泥样品中细菌多样性最低;不同活性污泥样品中细菌多样性的顺序为:乌鲁木齐>合肥>无锡>西安。
2.1.2 细菌群落结构分析
通过对T-RFLP数据进行分析,得到相对丰度图如图1所示。

图1 不同活性污泥样品中各限制性片段的相对丰度Fig.1 Relative abundances of the T-RFs in the activated sludge samples collected from different cities
从图1可以看出:长度为61~100bp T-RFs的总丰度在4个活性污泥样品中都占到50%以上。长度为82bp、85bp、86bp、87bp、91bp、93bp、131bp、132bp、138bp、207bp的T-RFs在4个样品中均有较高的相对丰度,如:长度为87bp的T-RF在4个样品中的相对丰度均超过了15%,长度为86bp的T-RF在4个样品中的相对丰度均超过了5%,可以判断这2个片段为4个活性污泥样品中的优势种群;长度为62 bp的T-RF在乌鲁木齐、合肥、无锡3个样品中的相对丰度超过了5%;长度为88bp、95bp、132bp的T-RFs在合肥与无锡2个样品中的相对丰度超过了5%。
2.2 T-RFs定性推断
通过与数据库 Microbial Community AnalysisⅢ(MiCA 3)(http://mica.ibest.uidaho.edu/pat.php)和Phylogenetic Assignment Tool(PAT)(http://secure.limnology.wisc.edu/trflp/)进行对比,可以鉴定特定长度的T-RF片段所对应的细菌的分类地位。与PAT数据库比对结果表明:实验所得到的优势T-RFs所代表的细菌分别属于芽孢杆菌纲(Bacilli)、α-变形菌纲(α-Proteobacteria)、δ-变形菌纲(δ-Proteobacteria)、γ-变形菌纲(γ-Proteobacteria),如表3 所示。

表3 PAT数据库中与主要T-RFs对应的细菌的分类地位Tab.3 Phylogenetic assignment of the dominant T-RFs in PAT database
从表3 可以看出:62bp、95bp、96bp、211bp的T-RFs均为厚壁菌门(Firmicutes),具有嗜盐特性[10],而检索出的与其最相近的细菌类群却各不相同,分别为玫瑰色盐水球菌(Salinicoccus roseus)、芽孢杆菌属(Bacillus arsenicoselenatis)、福赛类 拟 杆 菌 (Bacteroides forsythus)、气球菌属(Abiotrophia adiacens,在砷的地球化学循环中起重要作用[11])等;82bp、86 bp、88bp的 T-RFs均为变形菌门(Proteobacteria),其相近序列分别为芽单胞菌属(Blastomonas natatoria)、红螺菌属(Rhodospirillum sodomense)、生脂固氮螺菌(Azospirillum lipoferum);91bp、93bp的 TRFs也属于变形菌门(Proteobacteria),却分别属于δ-变形 菌 纲 (δ-Proteobacteria)与 γ-变 形 菌 纲 (γ-Proteobacteria),其相近序列也分别为蛭弧菌属(Bdellovibrio stolpii)和布赫纳式菌属(Buchnera aphidicola,与蚜虫共生[12])。
3 结论
研究了4个城市生活污水处理厂活性污泥中细菌的群落结构和多样性。通过分析4个不同来源活性污泥样品的Shannon-Wiener指数、Simpson指数和Pielou指数,得出4个样品的多样性顺序为:乌鲁木齐>合肥>无锡>西安;通过分析各样品中T-RFs的相对丰度并与PAT数据库进行对比,可以看出:4个活性污泥样品中的优势细菌属于芽孢杆菌纲、α-变形菌纲、δ-变形菌纲和γ-变形菌纲;86bp、87bp的 T-RFs为4个活性污泥样品中的优势种群,其中86bp的TRF属于α-变形菌纲(α-Proteobacteria)。
[1]余彬彬,李钧敏,金则新.分子生物学技术在活性污泥微生物多样性研究中的应用[J].江苏农业科学,2009,(5):313-315.
[2]高平平,赵立平.可用于微生物群落分子生态学研究的活性污泥总 DNA提取方法研究[J].生态学报,2002,22(11):2015-2019.
[3]Theron J,Cloete T E.Molecular techniques for determining microbial diversity and community structure in natural environments[J].Critical Reviews in Microbiology,2000,26(1):37-57.
[4]Marsh T L.Terminal restriction fragment length polymorphism(T-RFLP):An emerging method for characterizing diversity among homologous populations of amplification products[J].Current Opinion in Microbiology,1999,2(3):323-327.
[5]Kitts C L.Terminal restriction fragment patterns:A tool for comparing microbial communities and assessing community dynamics[J].Curr Issues Intest Microbiol,2001,2(1):17-25.
[6]Liu W T,Marsh T L,Cheng H,et a1.Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16SrRNA[J].Applied and Environmental Microbiology,1997,63(11):4516-4522.
[7]任南琪,赵阳国,高崇洋,等.TRFLP在微生物群落结构与动态分析中的应用[J].哈尔滨工业大学学报,2007,39(4):552-556.
[8]葛芸英,陈松,胡兰,等.土壤细菌DNA提取及多样性分析的TRFLP方法[J].微生物学通报,2008,35(1):131-136.
[9]孙庆华,柏耀辉,赵翠,等.DGGE、T-RFLP、LH-PCR对两种活性污泥的微生物种群多样性分析的比较[J].环境工程学报,2009,3(8):1365-1370.
[10]Prasad M M,Seenayya G.Shelf-life of ribbonfish (Trichiurus haumela)cured in salt with red halophlic bacteria(Salinicoccus roseus)and chemical preservatives[J].Journal of Food Science and Technology(Mysore),2009,46(1):41-45.
[11]洪斌.微生物对砷的地球化学行为的影响——暨地下水砷污染机制的最新研究进展[J].地球科学进展,2006,21(1):77-82.
[12]苗雪霞,丁德诚.蚜虫与其胞内共生细菌的相互作用[J].生命科学,2003,15(4):242-247.

