L-半胱氨酸与牛血清白蛋白相互作用的荧光光谱分析
徐大玮,毕玉琦
(1.山东省产品质量监督检验研究院,山东 济南250100;2.山东质量认证中心,山东 济南250014)
L-半胱氨酸(L-Cysteine,L-Cys)是组成蛋白质的重要氨基酸之一,其结构中既有羧基、氨基,又有巯基(-SH),具有重要的生理药理功能。L-Cys能够合成谷胱甘肽,还能维持细胞内外的氧化还原状态[1],广泛应用于生物医药[2]、检测[3]、食品[4]等领域。在医药行业,L-Cys的盐酸盐具有恢复肝功能的作用,其衍生物可以作为溶解性祛痰剂[2];在食品加工行业,L-Cys具有很好的食品保鲜、抗氧化作用;另外人们还将它应用到化妆品行业中[4]。
血清白蛋白能与进入体内的许多物质进行可逆结合,在体内起到贮存、转运物质的作用。因此,研究小分子与血清白蛋白的相互作用对理解物质在体内的代谢、转运等作用机制具有重要意义。牛血清白蛋白(BSA)因与人血清白蛋白(HSA)具有相似的结构,常作为体外模型蛋白用于研究。
目前,有关L-Cys与模型蛋白BSA相互作用的研究还很少见,方盈盈等[5]探讨了L-Cys与BSA相互作用的热转变曲线、变性温度和变性焓等,但是对于LCys与BSA的猝灭常数、结合作用以及热力学参数的变化至今尚未见报道。作者在此运用荧光光谱法研究了L-Cys与BSA的荧光猝灭机制,求得了L-Cys与BSA的猝灭常数、结合常数、结合位点数和热力学参数,为全面了解L-Cys在体内的贮存、转运、代谢作用以及L-Cys的药理、毒理机制提供了依据。
1 实验
1.1 试剂与仪器
牛血清白蛋白(纯度>98%)、L-半胱氨酸(BR),国药集团化学试剂有限公司;Tris试剂、NaCl,分析纯;二次去离子水。
LS-55型荧光仪,美国 Perkin Elmer公司;DF-101S型集热式恒温槽,巩义英峪仪器厂;FA2004B型电子天平,上海精密仪器;PH-3C型酸度计,上海鹏顺。
1.2 方法
1.2.1 溶液的配制
用电子天平准确称取0.6057g Tris试剂和0.2925g NaCl,溶于50mL 二次去离子水中,并与42mL 0.1mol·L-1的盐酸均匀混合,用二次去离子水定容至100mL,用酸度计测其pH值为7.4,即得到0.05mol·L-1pH=7.4的 Tris-HCl缓冲溶液,溶液中NaCl的浓度为0.05mol·L-1。
用上述0.05mol·L-1Tris-HCl缓冲溶液配制浓度为1.24×10-6mol·L-1的BSA溶液,低温保存,备用。
用电子天平准确称取 0.6058g L-Cys,溶于50mL二次去离子水中,其浓度为0.1mol·L-1;取10mL上述溶液,稀释至100mL,即得浓度为1.0×10-2mol·L-1的L-Cys水溶液。
1.2.2 荧光光谱分析
取5mL BSA于比色管中,依次加入不同体积的L-Cys水溶液(加入体积<100μL,忽略体积对浓度的干扰),设定激发波长为285nm、扫描速率为500nm·min-1、荧光发射与激发狭缝比为8∶8,在温度为288K、306K时测量BSA的荧光光谱,记录350nm处的荧光强度,并运用相关公式进行数据处理;在288K时测L-Cys与BSA相互作用的同步荧光光谱,考察L-Cys对BSA结构的影响。
2 结果与讨论
2.1 L-Cys与BSA相互作用的荧光猝灭光谱
蛋白质分子中因含有色氨酸(Trp)、酪氨酸(Tyr)及苯丙氨酸(Phe)3种生色团而产生荧光。三者对于蛋白质荧光强度的贡献差别较大,相对荧光强度Trp∶Tyr∶Phe为100∶9∶0.5[6],也就是说Trp对蛋白质荧光的贡献最大,特别是当激发波长为285nm时,蛋白质所表现的荧光性质主要为Trp的荧光性质。
不同温度下,不同浓度L-Cys与BSA相互作用的荧光猝灭光谱见图1。

图1 不同温度下,不同浓度L-Cys与BSA相互作用的荧光猝灭光谱Fig.1 Fluorescence quenching spectra of BSA with L-Cys as quencher at different temperatures
由图1可看出,288K时,BSA的最大荧光峰位于350nm处;随着L-Cys浓度的增大,BSA的荧光强度不断降低,发生了荧光猝灭,且最大发射峰从350nm蓝移到了347.5nm。表明L-Cys与BSA之间发生了相互作用,L-Cys使BSA的Trp生色团的微环境发生了改变。
温度对溶液的荧光有显著的影响,温度升高时由于分子内部能量转化作用会使溶液的荧光强度下降[7]。由图1可看出,288K时,BSA的荧光强度为734,而306K时BSA的荧光强度下降至538;当LCys的浓度为23.1×10-5mol·L-1时,288K、306K下的荧光强度分别为472和353,表明温度对L-Cys与BSA的相互作用影响显著。
2.2 L-Cys与BSA相互作用的荧光猝灭机制
荧光猝灭是荧光物质与其它分子之间作用,导致荧光强度降低的过程。荧光猝灭的过程非常复杂,常见的有动态猝灭和静态猝灭,动态猝灭是激发态荧光分子和其它分子之间碰撞造成能量损失而形成的,其能量以无辐射形式跃迁回基态,温度越高猝灭越明显;而静态猝灭是形成基态复合物而导致的,受温度影响较小[7]。猝灭机制可以通过Stern-Volmer方程[式(1)]来研究[8,9]:

式中:F0和F分别为猝灭剂不存在和存在时体系的荧光强度;Ksv为Stern-Volmer猝灭常数;[Q]为猝灭剂的浓度。
绘制不同温度下的L-Cys对BSA荧光猝灭的Stern-Volmer曲线,见图2。
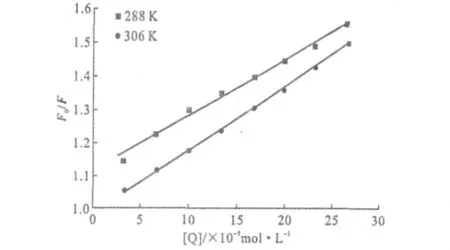
图2 不同温度下,L-Cys与BSA相互作用的Stern-Volmer曲线Fig.2 The Stern-Volmer curves of the interaction between L-Cys and BSA at different temperatures
由图2可看出,Stern-Volmer曲线斜率随着温度的升高而增大,计算得到288K、306K时的Ksv分别为1.69×103L·mol-1、1.89×103L·mol-1。表明,L-Cys与BSA相互作用的猝灭机制为动态猝灭。
2.3 L-Cys与BSA的结合作用及热力学参数
L-Cys与BSA 的结合作用可由式(2)表示[8,9]:


图3 不同温度下,L-Cys与BSA相互作用的log[(F0-F)/F]~log[Q]曲线Fig.3 Plots of log[(F0-F)/F]versus log[Q]of the interaction between L-Cys and BSA at different temperatures
由图3中曲线的斜率和截距求出L-Cys与BSA相互作用的结合常数K及结合位点数n,见表1 。

表1 不同温度下的结合常数、结合位点数及热力学参数Tab.1 Binding constants,binding sites,and the thermodynamic parameters at different temperatures
由表1 可看出,随着温度的升高,结合常数和结合位点数均相应增大。
当温度变化不大时,反应的焓变(△H)可以看作常数,根据van′t Hoff公式[式(3)]和热力学公式[式(4)]求出反应的熵变(△S)和吉布斯自由能(△G),结果见表1 。
蛋白质与小分子之间的结合主要有疏水作用力、范德华力、氢键和静电引力[10],不同小分子与蛋白质结合的作用力类型不尽相同,当△H>0、△S>0时,主要作用力为疏水作用力[11]。
由表1 可看出,△H>0,说明该反应过程是一个吸收热量的过程,升高温度有利于反应的进行,这也与实际相符;△H>0、△S>0,可以判断L-Cys和BSA之间的作用力主要为疏水作用力;此外,L-Cys的等电点在5.05左右,BSA的等电点在4.6左右,实验的pH值为7.4,因此L-Cys和BSA都带负电,二者之间存在较大的静电斥力,这也导致二者的结合作用力较小;考虑到水溶液中水分子和其它共存离子的影响,实际体系的宏观表现应该是几种作用力同时作用的结果。
2.4 L-Cys与BSA相互作用的同步荧光光谱
蛋白质中Trp和Tyr残基的荧光峰位置与蛋白质所处的微环境密切相关,因此可以通过荧光峰位置的改变来判断蛋白质微环境的改变。Trp和Tyr的同步荧光光谱见图4。△λ=60nm时,主要是Trp的荧光光谱特征;△λ=15nm时,主要是Tyr的荧光光谱特征[12]。

图4 L-Cys与BSA相互作用的同步荧光光谱Fig.4 Synchronous fluorescence spectra of BSA with L-Cys as quencher
由图4可看出,随着L-Cys浓度的增大,Trp的最大发射峰略有蓝移,荧光强度逐渐降低;而Tyr的最大发射峰位置没有大的变化。表明Trp所处的微环境疏水性增强、极性减弱,这也与L-Cys和BSA之间的作用力主要是疏水作用力相一致。
3 结论
在模拟动物活体生理条件下,运用荧光光谱法研究了L-Cys与BSA的相互作用。结果表明,L-Cys对BSA的荧光具有猝灭作用,其猝灭机制为动态猝灭;L-Cys与BSA之间的作用力主要为疏水作用力;同步荧光光谱显示,L-Cys使得BSA的Trp微环境发生改变,疏水性增强、极性减弱。
[1]陈慧慧,朱瑞旭,郭艳丽,等.L-半胱氨酸修饰的金纳米粒子与牛血清白蛋白相互作用的荧光光谱研究[J].光谱学与光谱分析,2012,32(12):3276-3280.
[2]贾存江,王英燕,赵丽丽.L-半胱氨酸的生产方法及应用进展[J].齐鲁药事,2007,26(9):553-555.
[3]Ahmadipour M,Taher M A,Beitollahi H,et al.Electrocatalytic determination of L-cysteine using a modified carbon nanotube paste electrode:Application to the analysis of some real samples[J].Chinese Chemical Letters,2012,23(8):981-984.
[4]杨美花,李智聪,刘凤娇,等.L-半胱氨酸作为化妆品美白添加剂的作用机理[J].厦门大学学报(自然科学版),2009,48(4):582-584.
[5]方盈盈,张龙,郭爱娣,等.L-半胱氨酸与牛血清白蛋白的相互作用[J].广州化学,2011,36(2):12-16.
[6]Ni Y,Liu G,Kokot S.Fluorescence spectrometric study on the interactions of isoprocarb and sodium 2-isopropylphenate with bovine serum albumin[J].Talanta,2008,76(3):513-521.
[7]许金钩,王尊本.荧光分析法[M].北京:科学出版社,2006:49-85.
[8]Zhang P J,Lan P,Ma Y N,et al.Spectroscopic investigation on the interaction of Cr(Ⅵ)with bovine serum albumin[J].J Biochem Mol Toxicol,2012,26(2):54-59.
[9]徐科,黄亚励,刘红,等.荧光光谱法研究氢化可的松与牛血清白蛋白的结合作用[J].化学与生物工程,2012,29(11):32-35.
[10]Ross P D,Subramanian S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[11]Mu Y,Lin J,Liu R.Interaction of sodium benzoate with trypsin by spectroscopic techniques[J].Spectrochim Acta A:Mol Biomol Spectrosc,2011,83(1):130-135.
[12]Klajnert B,Bryszewska M.Fluorescence studies on PAMAM dendrimers interactions with bovine serum albumin[J].Bioelectrochemistry,2002,55(1-2):33-35.

